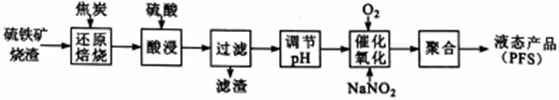
聚合硫酸铁(PFS) 是一种高效的无机高分子絮凝剂。某工厂利用经浮选的硫铁矿烧渣 (有效成分为Fe2O3和Fe3O4) 制备PFS,其工艺流程如下图所示。
(1)“还原焙烧”过程中,CO还原Fe3O4生成FeO的热化学方程式为___________________________ 。
已知:Fe3O4(s)+C(s)=3FeO(s)+CO(g) ΔH1= 191.9kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
C(s)+CO2(g) =2CO(g) ΔH3= 172.5kJ·mol-1
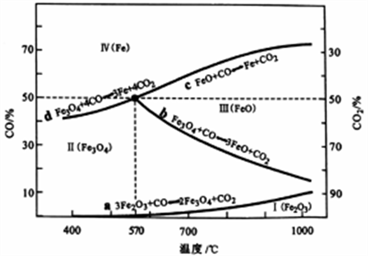
(2)CO是“还原焙烧" 过程的主要还原剂。下图中,曲线表示4个化学反应a、b、c、d达到平衡时气相组成和温度的关系,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域。a属于_________ (填“吸热反应”或“放热反应”);570℃时,d反应的平衡常数K=_________________ 。
(3)工业上,“还原培烧”的温度一般控制在800℃左右,温度不宜过高的理由是____________________ 。
(4)若“酸浸”时间过长,浸出液中Fe2+含量反而降低,主要原因是___________________________ 。
(5)已知:25℃时,Ksp[Fe(OH)2]=1.0×10-17, Ksp[Fe(OH)3]=1.0×10-39,若浸出液中c(Fe2+) =10-1.8mol·L-1,为避免“催化氧化”过程中产生Fe(OH)3,应调节浸出液的pH≤_____________ 。
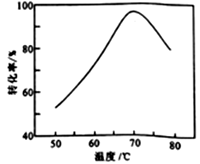
(6)FeSO4溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4,该反应的离子方程式为_________________________ 。“催化氧化”过程用NaNO2作催化剂(NO起实质上的催化作用)时,温度与Fe2+转化率的关系如右图所示(反应时间相同),Fe2+转化率随温度的升高先上升后下降的原因是_______________________________ 。

(1)“还原焙烧”过程中,CO还原Fe3O4生成FeO的热化学方程式为
已知:Fe3O4(s)+C(s)=3FeO(s)+CO(g) ΔH1= 191.9kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
C(s)+CO2(g) =2CO(g) ΔH3= 172.5kJ·mol-1
(2)CO是“还原焙烧" 过程的主要还原剂。下图中,曲线表示4个化学反应a、b、c、d达到平衡时气相组成和温度的关系,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域。a属于

(3)工业上,“还原培烧”的温度一般控制在800℃左右,温度不宜过高的理由是
(4)若“酸浸”时间过长,浸出液中Fe2+含量反而降低,主要原因是
(5)已知:25℃时,Ksp[Fe(OH)2]=1.0×10-17, Ksp[Fe(OH)3]=1.0×10-39,若浸出液中c(Fe2+) =10-1.8mol·L-1,为避免“催化氧化”过程中产生Fe(OH)3,应调节浸出液的pH≤
(6)FeSO4溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4,该反应的离子方程式为

更新时间:2018-04-03 04:42:55
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】甲基叔丁基醚( )是一种高辛烷值汽油添加剂,可由甲醇和异丁烯(以
)是一种高辛烷值汽油添加剂,可由甲醇和异丁烯(以 表示)在催化剂作用下合成:
表示)在催化剂作用下合成: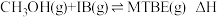 。回答下列问题:
。回答下列问题:
(1)反应过程中反应物首先被催化剂吸附,再经历过渡态,最终得到产物,相对能量与反应历程的关系如图所示(其中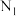 表示甲醇和异丁烯同时被吸附,
表示甲醇和异丁烯同时被吸附, 表示甲醇先被吸附,
表示甲醇先被吸附,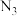 表示异丁烯先被吸附),该反应的
表示异丁烯先被吸附),该反应的
_______  ,下列说法错误的是
,下列说法错误的是_______ 。
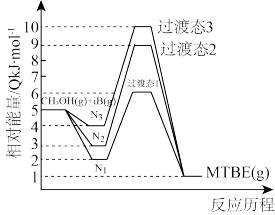
A.三种反应历程中,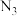 反应速率最快
反应速率最快
B.过渡态1比另两种过渡态稳定
C.降低温度和增大压强都有利于提高反应物平衡转化率
D.同温同压下,只要起始投料相同,相同时间三种途径 的产率一定相同
的产率一定相同
(2)向刚性密闭容器中充入等物质的量的甲醇和异丁烯,在催化剂作用下,分别在 和
和 两个温度反应,异丁烯的转化率随时间的变化关系如图所示。
两个温度反应,异丁烯的转化率随时间的变化关系如图所示。
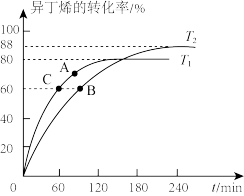
① 时,反应
时,反应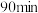 后到达点B,此时甲基叔丁基醚的体积分数为
后到达点B,此时甲基叔丁基醚的体积分数为_______ (保留3位有效数字)
②A、B、C三点中,正反应速率最大的是_______ 。
③比较A、B、C三点的平衡常数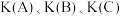 ,从大到小的顺序是
,从大到小的顺序是_______ 。
④已知对于反应 ,标准平衡常数
,标准平衡常数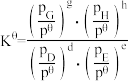 ,其中
,其中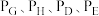 为各组分的平衡分压,分压=总压×该组分物质的量分数,
为各组分的平衡分压,分压=总压×该组分物质的量分数,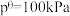 。在
。在 时(如图),将等物质的量的甲醇和异丁烯充入恒容密闭容器中(初始压强为
时(如图),将等物质的量的甲醇和异丁烯充入恒容密闭容器中(初始压强为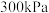 ),甲醇的平衡分压为
),甲醇的平衡分压为_______  ,反应的标准平衡常数
,反应的标准平衡常数
_______ 。(保留1位小数)
 )是一种高辛烷值汽油添加剂,可由甲醇和异丁烯(以
)是一种高辛烷值汽油添加剂,可由甲醇和异丁烯(以 表示)在催化剂作用下合成:
表示)在催化剂作用下合成: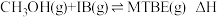 。回答下列问题:
。回答下列问题:(1)反应过程中反应物首先被催化剂吸附,再经历过渡态,最终得到产物,相对能量与反应历程的关系如图所示(其中
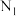 表示甲醇和异丁烯同时被吸附,
表示甲醇和异丁烯同时被吸附, 表示甲醇先被吸附,
表示甲醇先被吸附,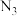 表示异丁烯先被吸附),该反应的
表示异丁烯先被吸附),该反应的
 ,下列说法错误的是
,下列说法错误的是
A.三种反应历程中,
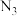 反应速率最快
反应速率最快B.过渡态1比另两种过渡态稳定
C.降低温度和增大压强都有利于提高反应物平衡转化率
D.同温同压下,只要起始投料相同,相同时间三种途径
 的产率一定相同
的产率一定相同(2)向刚性密闭容器中充入等物质的量的甲醇和异丁烯,在催化剂作用下,分别在
 和
和 两个温度反应,异丁烯的转化率随时间的变化关系如图所示。
两个温度反应,异丁烯的转化率随时间的变化关系如图所示。
①
 时,反应
时,反应 后到达点B,此时甲基叔丁基醚的体积分数为
后到达点B,此时甲基叔丁基醚的体积分数为②A、B、C三点中,正反应速率最大的是
③比较A、B、C三点的平衡常数
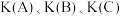 ,从大到小的顺序是
,从大到小的顺序是④已知对于反应
 ,标准平衡常数
,标准平衡常数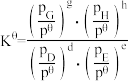 ,其中
,其中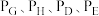 为各组分的平衡分压,分压=总压×该组分物质的量分数,
为各组分的平衡分压,分压=总压×该组分物质的量分数,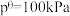 。在
。在 时(如图),将等物质的量的甲醇和异丁烯充入恒容密闭容器中(初始压强为
时(如图),将等物质的量的甲醇和异丁烯充入恒容密闭容器中(初始压强为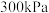 ),甲醇的平衡分压为
),甲醇的平衡分压为 ,反应的标准平衡常数
,反应的标准平衡常数
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】印刷电路板在科技领域具有不可替代的作用,它的制备方法为高分子化合物和铜箔压合,通过FeCl3溶液“腐蚀”而成。某实验小组在实验室用废弃的印刷电路板和“腐蚀液”提取铜的一种工艺流程如下:
请回答下列问题:
(1) 检验“腐蚀液”中含有Fe2+的方法为_________________ 。
(2)“分离”所用的操作名称为____________ ,该操作所用的主要玻璃仪器有烧杯、_____________ 。
(3)用电解法在铁上镀铜时,阴极材料为_____________ (填化学式),理论上电镀过程中电解质溶液的浓度_______________ (填“增大”“减小”或“不变”)。
(4) Fe2+溶液有很多重要用途。
①已知:常温下,Ksp[Fe(OH)2]=1.8×10-16。保存1.8mol·L-1的FeSO4溶液时,为确保溶液中不出现浑浊,应调节溶液的pH不超过_________________ 。
②Fe2+可使Ag+与Fe3+之间相互转化。一定温度下,0.1 mol·L-1的Fe(NO3)2溶液中,c(Fe3+)与c(Ag+)的关系如图所示:
该温度下,A点溶液中转化反应的平衡常数为____________ (溶液体积变化忽略不计);若将0.6mol·L-1 Fe(NO3)2溶液、0.15 mol·L-1 Fe(NO3)3溶液、0.06 mol• L-1 AgNO3溶液等体积混合后,再加入1.08 g Ag,可观察到的现象为_________________________ 。
③Fe2+转化为Fe3+后,可用于制备高铁酸盐。向FeCl3溶液中加入NaOH、NaClO溶液制备Na2FeO4的化学方程式为_________________________ 。
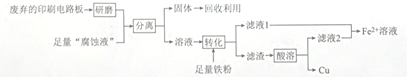
请回答下列问题:
(1) 检验“腐蚀液”中含有Fe2+的方法为
(2)“分离”所用的操作名称为
(3)用电解法在铁上镀铜时,阴极材料为
(4) Fe2+溶液有很多重要用途。
①已知:常温下,Ksp[Fe(OH)2]=1.8×10-16。保存1.8mol·L-1的FeSO4溶液时,为确保溶液中不出现浑浊,应调节溶液的pH不超过
②Fe2+可使Ag+与Fe3+之间相互转化。一定温度下,0.1 mol·L-1的Fe(NO3)2溶液中,c(Fe3+)与c(Ag+)的关系如图所示:
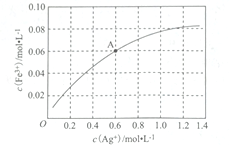
该温度下,A点溶液中转化反应的平衡常数为
③Fe2+转化为Fe3+后,可用于制备高铁酸盐。向FeCl3溶液中加入NaOH、NaClO溶液制备Na2FeO4的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
合成氨的反应中的能量变化如图所示。

①该反应是___________ 反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量_____ (填“大于”或“小于”)生成物化学键形成放出的总能量。
②在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述不能说明该反应达到平衡状态的是___________ (填序号)。
A.容器中混合气体的密度不随时间变化
B.单位时间内断裂3 mol H-H键的同时断裂6 mol N-H键
C.N2 、H2 、NH3的物质的量之比为1:3:2
D.容器中混合气体的平均相对分子质量不随时间变化
③一种用于驱动潜艇的液氨-液氧燃料电池原理示意如图:

电极A上发生的电极反应为:_____________________ 。
若电池工作一段时间后,消耗标准状况下的氧气11.2L,则该过程转移电子______ mol.
 2NH3(g)
2NH3(g)合成氨的反应中的能量变化如图所示。

①该反应是
②在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述不能说明该反应达到平衡状态的是
A.容器中混合气体的密度不随时间变化
B.单位时间内断裂3 mol H-H键的同时断裂6 mol N-H键
C.N2 、H2 、NH3的物质的量之比为1:3:2
D.容器中混合气体的平均相对分子质量不随时间变化
③一种用于驱动潜艇的液氨-液氧燃料电池原理示意如图:

电极A上发生的电极反应为:
若电池工作一段时间后,消耗标准状况下的氧气11.2L,则该过程转移电子
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】甲烷是一种重要的基础化工原料,不仅可制备多种重要有机产品,还可用于环境保护。请回答下列问题:
(1)用甲烷催化还原氮的氧化物可消除氮氧化物的污染。已知:

反应过程(2)是__ 反应(填“放热”或“吸热”),甲烷还原NO2生成H2O(g)、N2和CO2时的热化学方程式是__ 。
(2)工厂利用甲烷与氯气的反应原理制取氯甲烷,为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化条件下,通过下列反应:CCl4(g)+H2(g) CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应)。在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应)。在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
①此反应在110℃时平衡常数为___ 。
②实验l中,CCl4的转化率为__ 。
③判断该反应的正反应是__ (填“放热”或“吸热”),理由是__ 。
④为提高实验3中CCl4的转化率,可采取的措施是__ 。
a.使用高效催化剂
b.向容器中再投入1molCCl4和1molH2
c.温度升高到200℃
d.向容器中再投入1molHCl
e.向容器中再投入1molH2
(1)用甲烷催化还原氮的氧化物可消除氮氧化物的污染。已知:

反应过程(2)是
(2)工厂利用甲烷与氯气的反应原理制取氯甲烷,为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化条件下,通过下列反应:CCl4(g)+H2(g)
 CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应)。在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应)。在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:| 实验 序号 | 温度℃ | 初始n(CCl4)( mol) | 初始n(H2)( mol) | 平衡时n(CHCl3)( mol) |
| 1 | 110 | 0.8 | 1.2 | |
| 2 | 110 | 2 | 2 | 1 |
| 3 | 100 | 1 | 1 | 0.6 |
①此反应在110℃时平衡常数为
②实验l中,CCl4的转化率为
③判断该反应的正反应是
④为提高实验3中CCl4的转化率,可采取的措施是
a.使用高效催化剂
b.向容器中再投入1molCCl4和1molH2
c.温度升高到200℃
d.向容器中再投入1molHCl
e.向容器中再投入1molH2
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明,美丽中国具有重要意义。
(1)海水中无机碳的存在形式及分布如图所示:

用离子方程式表示海水呈弱碱性的原因______________ 。已知春季海水pH=8.1,预测夏季海水碱性将会_____________ (填“增强”或“减弱”)。
(2)工业上以CO和H2为原料合成甲醇的反应:
CO(g)+2H2(g) CH3OH(g) ΔH<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系。下列说法正确的是
CH3OH(g) ΔH<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系。下列说法正确的是________ (填字母)。
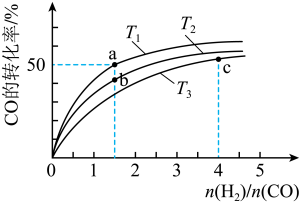
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点状态下再通入0.5 mol CO和0.5 mol CH3OH,平衡不移动
D.c点状态下再通入1 mol CO和4 mol H2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如下图所示:

①NO的作用是___________________ 。
②已知:
O3(g)+O(g)=2O2(g) ΔH=-143 kJ·mol-1
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2 kJ·mol-1。
反应2:热化学方程式为______________________ 。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随
N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随 的变化曲线如下图。
的变化曲线如下图。
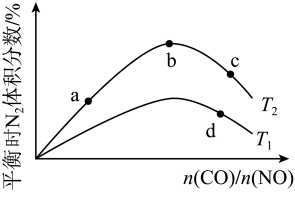
①b点时,平衡体系中C、N原子个数之比接近________ 。
②a、b、c三点CO的转化率从大到小的顺序为________ ;a、c、d三点的平衡常数从大到小的顺序为__________ 。
③若 =0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为__________ 。
(1)海水中无机碳的存在形式及分布如图所示:

用离子方程式表示海水呈弱碱性的原因
(2)工业上以CO和H2为原料合成甲醇的反应:
CO(g)+2H2(g)
 CH3OH(g) ΔH<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系。下列说法正确的是
CH3OH(g) ΔH<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系。下列说法正确的是
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点状态下再通入0.5 mol CO和0.5 mol CH3OH,平衡不移动
D.c点状态下再通入1 mol CO和4 mol H2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如下图所示:

①NO的作用是
②已知:
O3(g)+O(g)=2O2(g) ΔH=-143 kJ·mol-1
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2 kJ·mol-1。
反应2:热化学方程式为
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随
N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随 的变化曲线如下图。
的变化曲线如下图。
①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从大到小的顺序为
③若
 =0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】  的资源化有利于碳中和,利用
的资源化有利于碳中和,利用 氧化烷烃可制得烯烃。以
氧化烷烃可制得烯烃。以 和乙苯(
和乙苯( )为原料合成苯乙烯(
)为原料合成苯乙烯( )为例,涉及以下反应:
)为例,涉及以下反应:
①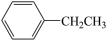 (g)
(g)
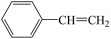 (g)+H2(g)
(g)+H2(g) 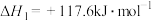
②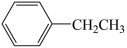 (g)+CO2(g)
(g)+CO2(g)
 (g)+CO(g)+H2O(g)
(g)+CO(g)+H2O(g) 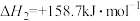
回答下列问题:
(1)根据盖斯定律,写出 与
与 反应的热化学方程式
反应的热化学方程式___________ 。
(2)判断下列说法正确的是___________。
(3)刚性容器中,进料浓度比c(乙苯):c(CO2)分别等于1:5、1:15、1:50时,乙苯平衡转化率随条件X的变化关系如图1所示:
①曲线a的进料浓度比c(乙苯):c(CO2)为___________ 。
②条件X是___________ (填“温度”或“压强”),依据是___________ 。
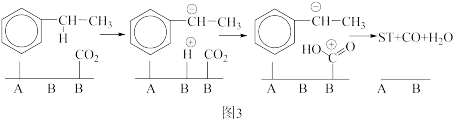
(4)图3为乙苯与 在催化剂表面反应的机理:
在催化剂表面反应的机理:
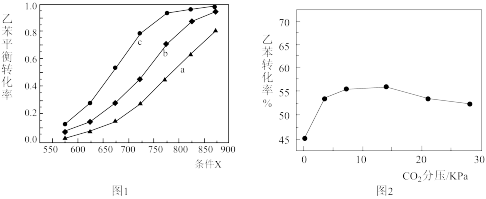
在刚性容器中乙苯分压不变时,继续增加 分压,乙苯转化率反而下降(见图2)的原因是
分压,乙苯转化率反而下降(见图2)的原因是___________ 。
(5)某温度下,等物质的量的乙苯和 在刚性容器内发生反应②,初始压强为p0平衡时苯乙烯的体积分数为20%,则平衡总压为
在刚性容器内发生反应②,初始压强为p0平衡时苯乙烯的体积分数为20%,则平衡总压为___________ ,该反应的平衡常数Kp=___________ 。
 的资源化有利于碳中和,利用
的资源化有利于碳中和,利用 氧化烷烃可制得烯烃。以
氧化烷烃可制得烯烃。以 和乙苯(
和乙苯( )为原料合成苯乙烯(
)为原料合成苯乙烯( )为例,涉及以下反应:
)为例,涉及以下反应:①
 (g)
(g)
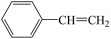 (g)+H2(g)
(g)+H2(g) 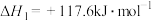
②
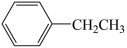 (g)+CO2(g)
(g)+CO2(g)
 (g)+CO(g)+H2O(g)
(g)+CO(g)+H2O(g) 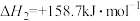
回答下列问题:
(1)根据盖斯定律,写出
 与
与 反应的热化学方程式
反应的热化学方程式(2)判断下列说法正确的是___________。
A.当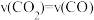 ,反应②达到平衡状态 ,反应②达到平衡状态 |
| B.升高温度,反应②的正、逆反应速率都增大 |
| C.增大压强,反应①平衡逆向移动,平衡常数K减小 |
| D.加入反应①的催化剂,可减小反应①的活化能 |

①曲线a的进料浓度比c(乙苯):c(CO2)为
②条件X是
(4)图3为乙苯与
 在催化剂表面反应的机理:
在催化剂表面反应的机理:
在刚性容器中乙苯分压不变时,继续增加
 分压,乙苯转化率反而下降(见图2)的原因是
分压,乙苯转化率反而下降(见图2)的原因是(5)某温度下,等物质的量的乙苯和
 在刚性容器内发生反应②,初始压强为p0平衡时苯乙烯的体积分数为20%,则平衡总压为
在刚性容器内发生反应②,初始压强为p0平衡时苯乙烯的体积分数为20%,则平衡总压为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】近年来,全球丙烯需求快速增长,研究丙烷制丙烯有着重要的意义。相关反应有:
I.C3H8在无氧条件下直接脱氢:C3H8(g) C3H6(g)+H2(g) △H1=+124kJ•mol-1
C3H6(g)+H2(g) △H1=+124kJ•mol-1
II.逆水煤气变换:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
III.CO2氧化C3H8脱氢制取丙烯:C3H8(g)+CO2(g) C3H6(g)+CO(g)+H2O(g) △H3
C3H6(g)+CO(g)+H2O(g) △H3
已知:CO和H2的燃烧热分别为-283.0kJ•mol-1、-285.8kJ•mol-1;
H2O(g)=H2O(l) △H=-44kJ•mol-1
(1)反应II的△H2=______ 。
(2)下列说法正确的是______ 。
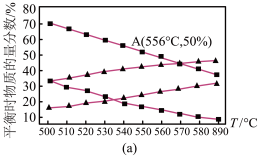
(3)对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p•x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数。在不同压强下(0.1MPa、0.01MPa),反应I中丙烷和丙烯的物质的量分数随温度变化如图(a)所示,请计算556℃反应I的平衡常数Kp=______ 。______ 。
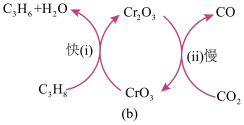
(5)研究表明,二氧化碳氧化丙烷脱氢制取丙烯可采用铬的氧化物为催化剂,其反应机理如图(b)所示。该工艺可有效维持催化剂活性,请结合方程式说明原因:______ 。
I.C3H8在无氧条件下直接脱氢:C3H8(g)
 C3H6(g)+H2(g) △H1=+124kJ•mol-1
C3H6(g)+H2(g) △H1=+124kJ•mol-1II.逆水煤气变换:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2III.CO2氧化C3H8脱氢制取丙烯:C3H8(g)+CO2(g)
 C3H6(g)+CO(g)+H2O(g) △H3
C3H6(g)+CO(g)+H2O(g) △H3已知:CO和H2的燃烧热分别为-283.0kJ•mol-1、-285.8kJ•mol-1;
H2O(g)=H2O(l) △H=-44kJ•mol-1
(1)反应II的△H2=
(2)下列说法正确的是
| A.升高温度反应I的平衡常数增大 |
| B.选择合适的催化剂可提高丙烷平衡转化率 |
| C.若反应II能自发,则△S<0 |
| D.恒温恒压下,通入水蒸气有利于提高丙烷转化率 |
(5)研究表明,二氧化碳氧化丙烷脱氢制取丙烯可采用铬的氧化物为催化剂,其反应机理如图(b)所示。该工艺可有效维持催化剂活性,请结合方程式说明原因:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】Ⅰ.利用CO2和CH4重整可制合成气(主要成分为CO、H2),已知重整过程中部分反应的热化学方程式为:
① CH4(g) = C(s)+2H2(g) △H= + 75.0 kJ·mol—1
② CO2(g)+H2(g)= CO(g)+H2O(g) △H = + 41.0 kJ·mol—1
③ CO(g)+H2(g) = C(s)+H2O(g) △H = -131.0 kJ·mol—1
反应CO2(g)+CH4(g) = 2CO(g)+2H2(g)的△H =___________ kJ·mol—1。
II.用CO合成尿素的反应为:2NH3(g) + CO(g) CO(NH2)2(g) + H2(g) ΔH <0。
CO(NH2)2(g) + H2(g) ΔH <0。
(1)T ℃时,向体积为2 L的恒容密闭容器中,充入2 molNH3和1 mol CO发生反应。
① 5 min时反应达到平衡状态,CO的转化率为80%,则5 min内NH3的平均反应速率为________ ,此温度下反应的平衡常数K的值为 ____________ 。
②对该反应,下列说法正确的是______ (填字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.反应达到平衡后,其它条件不变,升高温度,尿素的百分含量增大
C.反应达到平衡后,其它条件不变,在原容器中充入一定量氦气,CO的转化率不变
D.反应达到平衡后,其它条件不变,充入一定量NH3,平衡向正反应方向移动,但K值不变
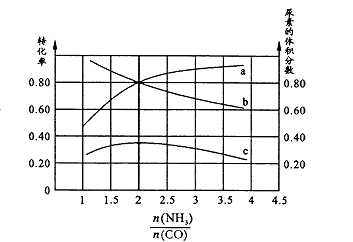
(2)若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示:若图中c表示平衡体系中尿素的体积分数,则b表示________ 的转化率。当尿素含量最大时,则 =
=______ ,此时,对于该反应既能增大反应速率又能提高尿素体积分数的措施为_____ 。
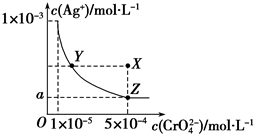
Ⅲ.下图是铬酸银(Ag2CrO4)T ℃时,在水溶液中的沉淀溶解平衡曲线。
(1)向饱和Ag2CrO4溶液中加入固体K2CrO4______ (填“能”或“不能”)使溶液由Y点变为X点
(2)图中ɑ =_________ 。
① CH4(g) = C(s)+2H2(g) △H= + 75.0 kJ·mol—1
② CO2(g)+H2(g)= CO(g)+H2O(g) △H = + 41.0 kJ·mol—1
③ CO(g)+H2(g) = C(s)+H2O(g) △H = -131.0 kJ·mol—1
反应CO2(g)+CH4(g) = 2CO(g)+2H2(g)的△H =
II.用CO合成尿素的反应为:2NH3(g) + CO(g)
 CO(NH2)2(g) + H2(g) ΔH <0。
CO(NH2)2(g) + H2(g) ΔH <0。(1)T ℃时,向体积为2 L的恒容密闭容器中,充入2 molNH3和1 mol CO发生反应。
① 5 min时反应达到平衡状态,CO的转化率为80%,则5 min内NH3的平均反应速率为
②对该反应,下列说法正确的是
A.若容器内气体密度不变,则表明反应达到平衡状态
B.反应达到平衡后,其它条件不变,升高温度,尿素的百分含量增大
C.反应达到平衡后,其它条件不变,在原容器中充入一定量氦气,CO的转化率不变
D.反应达到平衡后,其它条件不变,充入一定量NH3,平衡向正反应方向移动,但K值不变
(2)若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示:若图中c表示平衡体系中尿素的体积分数,则b表示
 =
=
Ⅲ.下图是铬酸银(Ag2CrO4)T ℃时,在水溶液中的沉淀溶解平衡曲线。
(1)向饱和Ag2CrO4溶液中加入固体K2CrO4
(2)图中ɑ =
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】捕集二氧化碳是实现温室气体减排的重要途径之一
(1)目前,NH3和(NH4)2CO3,可与CO2可发生如下可逆反应:
2NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq) K1
(NH4)2CO3(aq) K1
NH3(l)+H2O(l)+CO2(g) NH4HCO3(aq) K2
NH4HCO3(aq) K2
(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3(aq) K3
2NH4HCO3(aq) K3
则K3=_______ (用含K1、K2的代数式表示)。
(2)对于可逆反应2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH=a kJ·mol-1,起始时按n(CO2):n(H2)=1:3的投料比充入20 L的恒容密闭容器中,不同温度下平衡时H2和H2O的物质的量如图所示:
C2H4(g)+4H2O(g) ΔH=a kJ·mol-1,起始时按n(CO2):n(H2)=1:3的投料比充入20 L的恒容密闭容器中,不同温度下平衡时H2和H2O的物质的量如图所示:
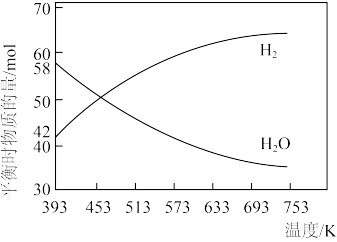
①a_______ 0(填“>”或“<”)。
②下列说法正确的是_______ (填序号)。
A.使用催化剂,可降低反应的活化能,加快反应速率
B.其他条件不变时,若扩大容器容积,则v正减小,v逆增大
C.测得容器内混合气体的密度不再随时间改变时,说明反应已达到平衡
③393 K时,H2的平衡转化率为_______ 。
④393 K时,该反应达到平衡后,再向容器中再向容器中按n(CO2):n(H2)=1:3的投料比投入CO2和H2,反应再次达到平衡时,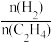 将
将_______ (填“变大”“不变”或“变小”)。
(3)相同温度下,根据三种酸的电离常数如下:
①请排列三种酸的强弱关系_______ ;
② 反应HZ+Y-=HY+Z-________ 填“能”或“不能)”发生;
③ 电离常数只与_______ 有关。
(1)目前,NH3和(NH4)2CO3,可与CO2可发生如下可逆反应:
2NH3(l)+H2O(l)+CO2(g)
 (NH4)2CO3(aq) K1
(NH4)2CO3(aq) K1NH3(l)+H2O(l)+CO2(g)
 NH4HCO3(aq) K2
NH4HCO3(aq) K2(NH4)2CO3(aq)+H2O(l)+CO2(g)
 2NH4HCO3(aq) K3
2NH4HCO3(aq) K3则K3=
(2)对于可逆反应2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) ΔH=a kJ·mol-1,起始时按n(CO2):n(H2)=1:3的投料比充入20 L的恒容密闭容器中,不同温度下平衡时H2和H2O的物质的量如图所示:
C2H4(g)+4H2O(g) ΔH=a kJ·mol-1,起始时按n(CO2):n(H2)=1:3的投料比充入20 L的恒容密闭容器中,不同温度下平衡时H2和H2O的物质的量如图所示:
①a
②下列说法正确的是
A.使用催化剂,可降低反应的活化能,加快反应速率
B.其他条件不变时,若扩大容器容积,则v正减小,v逆增大
C.测得容器内混合气体的密度不再随时间改变时,说明反应已达到平衡
③393 K时,H2的平衡转化率为
④393 K时,该反应达到平衡后,再向容器中再向容器中按n(CO2):n(H2)=1:3的投料比投入CO2和H2,反应再次达到平衡时,
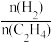 将
将(3)相同温度下,根据三种酸的电离常数如下:
| 酸 | HX | HY | HZ |
| 电离常数K | 9×10-7 | 9×10-6 | 10-2 |
①请排列三种酸的强弱关系
② 反应HZ+Y-=HY+Z-
③ 电离常数只与
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】某废钼镍催化剂主要含MoS2、 NiS、 Al2O3等,一种从其中回收金属元素Mo和Ni的工艺流程如图所示:

已知:
①H2MoO4是一种二元弱酸;“ 加碱焙烧”过程中有Na2MoO4生成。
②25℃时,H2CO3的Ka1=4.5×10-7, Ka2=5. 0×10-11; Ksp( CaMoO4)=4.0×10-8,Ksp(CaCO3)= 3. 2 ×10-9。
回答下列问题:
(1)“低温焙烧”过程时,粉碎后的废钼镍催化剂从炉顶进入,空气从炉底进入,其目的是_______ ;该过程中MoS2转化成MoO3,写出相关的化学方程式:_______ 。
(2)生成固体X的离子方程式为_______ 。
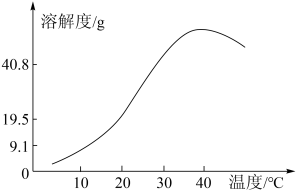
(3)将“含Ni固体”用稀硫酸溶解,再经_______ 、过滤、洗涤可得到NiSO4·6H2O(NiSO4的溶解度随温度的变化曲线如图所示)。
(4)“沉钼”时溶液pH与沉钼率之间的关系如图所示:

①当溶液pH小于7. 0时,沉钼率较低的原因可能为_______ 。
②“沉钼”时若条件控制不当,CaCO3也会沉淀。若“ 沉钼”时控制溶液pH=8.0,为避免CaCO3沉淀,当溶液中c( ) : c(
) : c( )=
)=_______ 时,应停止加入CaCl2溶液。

已知:
①H2MoO4是一种二元弱酸;“ 加碱焙烧”过程中有Na2MoO4生成。
②25℃时,H2CO3的Ka1=4.5×10-7, Ka2=5. 0×10-11; Ksp( CaMoO4)=4.0×10-8,Ksp(CaCO3)= 3. 2 ×10-9。
回答下列问题:
(1)“低温焙烧”过程时,粉碎后的废钼镍催化剂从炉顶进入,空气从炉底进入,其目的是
(2)生成固体X的离子方程式为
(3)将“含Ni固体”用稀硫酸溶解,再经

(4)“沉钼”时溶液pH与沉钼率之间的关系如图所示:

①当溶液pH小于7. 0时,沉钼率较低的原因可能为
②“沉钼”时若条件控制不当,CaCO3也会沉淀。若“ 沉钼”时控制溶液pH=8.0,为避免CaCO3沉淀,当溶液中c(
 ) : c(
) : c( )=
)=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
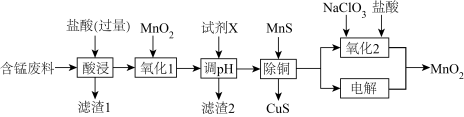
【推荐2】某含锰废料中主要含MnCO3及少量的FeCO3、SiO2、Cu2(OH)2CO3,以此为原料制备MnO2的流程如下:
Ⅰ.氢氧化物开始沉淀和完全沉淀的pH如下表:
Ⅱ.常温下Ksp(MnS)=2.0×10-10、Ksp(CuS)=6.0×10-36。
回答下列问题:
(1)滤渣1的主要成分是_________ (填化学式)。
(2)“氧化1”的目的是_________ (用离子方程式表示)。
(3)“调pH”时,试剂X为_________ (任写一种),pH的调节范围为_________ 。
(4)“除铜”时,当溶液中c(Mn2+)=12mol·L-1,溶液中c(Cu2+)=_________  。
。
(5)“氧化2”制备MnO2 (恰好完全反应)时,n(Mn2+):n(ClO )=
)=_________ ( ClO →Cl-);“电解”制备MnO2的阳极电极反应式为
→Cl-);“电解”制备MnO2的阳极电极反应式为_________ 。

Ⅰ.氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时pH | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时pH | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)滤渣1的主要成分是
(2)“氧化1”的目的是
(3)“调pH”时,试剂X为
(4)“除铜”时,当溶液中c(Mn2+)=12mol·L-1,溶液中c(Cu2+)=
 。
。(5)“氧化2”制备MnO2 (恰好完全反应)时,n(Mn2+):n(ClO
 )=
)= →Cl-);“电解”制备MnO2的阳极电极反应式为
→Cl-);“电解”制备MnO2的阳极电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法治金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
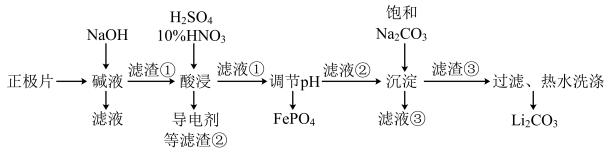
(1)从“正极”可以回收的金属有___________________ 。
(2)“碱溶”时Al箔溶解的离子方程式_________________________ 。
(3)“酸浸”时产生标准状况下2.24L NO时,则被氧化的LiFePO4为_________ mol。(其他杂质不与HNO3反应)
(4)实验测得滤液②中c(Li+)=4 mol·L-1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则滤液③中c(CO )=
)=________ mol·L-1。 [Ksp(Li2CO3)=1.6×10-3]
(5)磷酸亚铁锂电池总反应为:LiFePO4+6C Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。放电时,正极反应式为
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。放电时,正极反应式为________________________ 。
(6)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取1.40g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.030 mol·L-1重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液40.00mL。
已知:2Fe3++Sn2++6Cl-= SnCl +2Fe2+
+2Fe2+
4Cl-+Sn2++2HgCl2= SnCl +Hg2Cl2
+Hg2Cl2
6Fe2++Cr2O +14H+ = 6Fe3++2Cr3++7H2O
+14H+ = 6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是________________________ 。
②磷酸亚铁锂电池中铁的含量为_______________ 。

(1)从“正极”可以回收的金属有
(2)“碱溶”时Al箔溶解的离子方程式
(3)“酸浸”时产生标准状况下2.24L NO时,则被氧化的LiFePO4为
(4)实验测得滤液②中c(Li+)=4 mol·L-1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则滤液③中c(CO
 )=
)=(5)磷酸亚铁锂电池总反应为:LiFePO4+6C
 Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。放电时,正极反应式为
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。放电时,正极反应式为(6)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取1.40g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.030 mol·L-1重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液40.00mL。
已知:2Fe3++Sn2++6Cl-= SnCl
 +2Fe2+
+2Fe2+ 4Cl-+Sn2++2HgCl2= SnCl
 +Hg2Cl2
+Hg2Cl26Fe2++Cr2O
 +14H+ = 6Fe3++2Cr3++7H2O
+14H+ = 6Fe3++2Cr3++7H2O①实验中加入HgCl2饱和溶液的目的是
②磷酸亚铁锂电池中铁的含量为
您最近一年使用:0次



