(1)表达式:对于一般的可逆反应
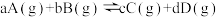 ,当在一定温度下达到化学平衡状态时,平衡常数的表达式为
,当在一定温度下达到化学平衡状态时,平衡常数的表达式为(2)意义
①K越大,说明
②K只受
(3)应用:判断反应是否达到平衡状态.
对化学反应
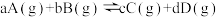 的任意状态有浓度商:
的任意状态有浓度商: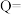
若
 ,说明反应
,说明反应若
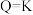 ,说明反应达到
,说明反应达到若
 ,说明反应
,说明反应相似题推荐
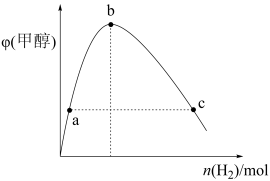
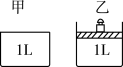
【推荐1】CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH<0。现在体积为1L的恒容密闭容器(如图甲所示)中通入1mol CO和2mol H2,测定不同时间、不同温度(T/℃)下容器中CO的物质的量,如下表:
CH3OH(g) ΔH<0。现在体积为1L的恒容密闭容器(如图甲所示)中通入1mol CO和2mol H2,测定不同时间、不同温度(T/℃)下容器中CO的物质的量,如下表:
0min | 10min | 20min | 30min | 40min | |
T1 | 1mol | 0.8mol | 0.62mol | 0.4mol | 0.4mol |
T2 | 1mol | 0.7mol | 0.5mol | a | a |
请回答:
①T1
②若将1mol CO和2mol H2通入原体积为1L的恒压密闭容器(如图乙所示)中,在T2℃下达到平衡,此时反应的平衡常数为
③达到平衡后若再向恒压容器乙中通入1mol CH3OH(g),重新达到平衡后,CH3OH(g)在体系中的百分含量
④达到平衡后若再向恒容容器甲中通入1mol CH3OH(g),重新达到平衡后,CH3OH(g)在体系中的百分含量
⑤在T2温度下,向甲容器中重新加入1mol CO、2mol H2、3mol CH3OH时,υ正
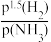 -k2
-k2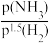 ,γ为反应的瞬时总速率,为正反应和逆反应速率之差,k1、k2是正、逆反应速率常数。合成氨反应N2+3H2
,γ为反应的瞬时总速率,为正反应和逆反应速率之差,k1、k2是正、逆反应速率常数。合成氨反应N2+3H2 2NH3的平衡常数Kp=
2NH3的平衡常数Kp=2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(g)① 298K时,K1=2.95×1011
CH3CH2OH(g)+3H2O(g)① 298K时,K1=2.95×10112CO(g)+4H2(g)
 CH3CH2OH(g)+H2O(g)② 298K时,K2=1.71×1022
CH3CH2OH(g)+H2O(g)② 298K时,K2=1.71×1022(1)写出反应①的平衡常数表达式K=
(2)条件相同时,反应①与反应②相比,转化程度更大的是
 CO(g)+H2O(g)其平衡常数K和温度的关系如下表所示:
CO(g)+H2O(g)其平衡常数K和温度的关系如下表所示:| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的平衡常数表达式K=
(2)在830℃时,向容器中充入1molCO、5molH2O,保持温度不变,反应达到平衡后,其平衡常数
(3)在1200℃时,在某时刻反应混合物中CO2、H2、CO、H2O浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,则此时平衡移动方向为
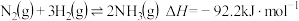 ,其部分工艺流程如图所示。
,其部分工艺流程如图所示。
反应体系中各组分的部分性质如表所示。
| 气体 |  |  |  |
| 熔点/℃ | 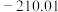 |  | 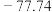 |
| 沸点/℃ | 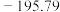 | 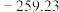 | 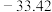 |
(1)该反应的化学平衡常数表达式K=
(2)合成氨反应的平衡常数很小,所以在工业上将气体循环利用,即反应后通过把混合气体的温度降低到
 N2(g)+2CO2(g) ΔH的反应物NO、CO的起始物质的量比、温度对平衡时CO2的体积分数的影响。
N2(g)+2CO2(g) ΔH的反应物NO、CO的起始物质的量比、温度对平衡时CO2的体积分数的影响。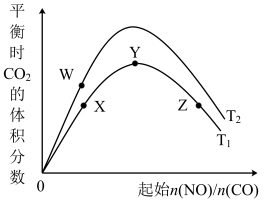
(1)W、Y、Z三点的平衡常数的大小关系为:
(2)T1℃时,在1L密闭容器中,0.1molCO和0.1molNO,达到Y点时,测得NO的浓度为0.02mol/L,则此温度下平衡常数K=
 CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。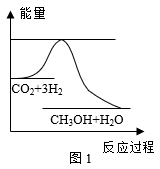
(1)该反应平衡常数K的表达式为
(2)温度降低,平衡常数K
(3)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2)为

(4)下列措施中能使(3)题中
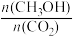 增大的有
增大的有A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.充入He(g),使体系总压强增大
E.再充入1mol CO2和3mol H2
已知:2NO2(g)
 N2O4(g) ΔH(298 K)=-52.7 kJ·mol-1
N2O4(g) ΔH(298 K)=-52.7 kJ·mol-1(1)该化学反应的浓度平衡常数的表达式为
(2)该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如右图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。
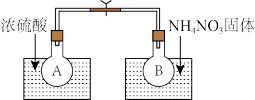
请回答:
①A中的现象为
②由上述实验现象可知,降低温度,该反应化学平衡向
③升高温度,该反应的化学平衡常数将

 和
和