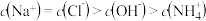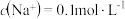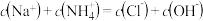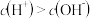已知水在25 ℃和95 ℃时的电离平衡曲线如图所示。
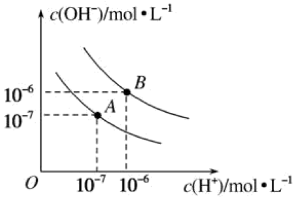
(1)25 ℃时水的电离平衡曲线应为_______ (填“A”或“B”)。25 ℃时,将pH=9的 NaOH 溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则 NaOH 溶液与 H2SO4溶液的体积比为 _______ 。
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是_______ 。
(3)在曲线 A 所对应的温度下,pH=2的 HCl溶液和pH=11的某BOH 溶液中,若水的电离程度分别用α1、α2表示,则α1_______ α2(填“大于”“小于”“等于”“无法确定”)
(4)在曲线B所对应的温度下,将0.02mol·L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=_______
(5)已知 HClO 的 Ka=2.98×10-8,CH3COOH 的 Ka=1.75×10-5,下列有关说法不正确的是

(1)25 ℃时水的电离平衡曲线应为
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是
(3)在曲线 A 所对应的温度下,pH=2的 HCl溶液和pH=11的某BOH 溶液中,若水的电离程度分别用α1、α2表示,则α1
(4)在曲线B所对应的温度下,将0.02mol·L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=
(5)已知 HClO 的 Ka=2.98×10-8,CH3COOH 的 Ka=1.75×10-5,下列有关说法不正确的是
| A.在pH=2的醋酸溶液中加入少量0.01mol·L-1的稀盐酸,溶液的pH 不变 |
| B.在pH=2的醋酸溶液中加少量水,能促进醋酸的电离平衡,但是溶液的pH 会变大 |
| C.100mL pH=2的新制氯水中:n(OH- )+n(ClO-)+n(HClO)=0.001mol |
| D.由电离平衡常数分析,CH3COOH 溶液的pH 一定比 HClO 溶液的pH 小 |
更新时间:2021-12-07 21:57:40
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】水的离子积常数Kw与温度t(℃)的关系如图所示:
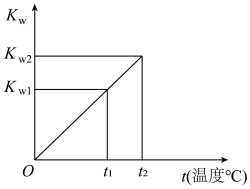
(1)若t1=25℃,则Kw1=_______ ;若t2=100℃时,Kw2=10-12,则此时0.05 mol·L-1的Ba(OH)2溶液的pH=______ ,此时溶液中水电离出的c(OH-)水=________ mol·L-1
(2)已知25℃时,0.1 L0.1 mol·L-1的NaA溶液的pH=10,则NaA溶液中所存在的平衡有:_______ 。溶液中各离子的物质的量浓度由大到小的顺序为:_______ 。
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为______ 。

(1)若t1=25℃,则Kw1=
(2)已知25℃时,0.1 L0.1 mol·L-1的NaA溶液的pH=10,则NaA溶液中所存在的平衡有:
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】已知水的电离平衡曲线如图所示,试回答下列问题:

(1)图中五点的Kw间的关系是___________ 。
(2)若从A点到D点,可采用的措施是________ 。
a. 升温 b. 加入少量的盐酸 c. 加入少量的NaOH
(3)点E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________ 。
(4)点B对应的温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是___ 。

(1)图中五点的Kw间的关系是
(2)若从A点到D点,可采用的措施是
a. 升温 b. 加入少量的盐酸 c. 加入少量的NaOH
(3)点E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
(4)点B对应的温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题
(1)某温度时,测得0. 01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数KW=_______ 。该温度_______ 25℃(填“>”、“=”或“<”)。
(2)常温下,将1 mL pH=1的H2SO4溶液加水稀释至100 mL,稀释后的溶液中c(H+)/ c(OH-)=_______ 。
(3)常温下若将0.2 mol/LMOH溶液与0.1 mol/L HCl溶液等体积混合,测得混合溶液中,c(M+)<c(MOH),则说明混合溶液的pH_______ 7 (填“>”、“=”或“<”)。
(4)某温度下Kw=10-13,CH3COONa溶液中由水电离的c(OH-)=10-4 mol·L-1,则该溶液的pH为_______ 。
(5)常温下将0.1 mol/L HA(A表示酸根)溶液与0.1 mol/L NaOH溶液等体积混合,测得混合溶液的pH>7,原因是_______ (用离子方程式表示)。
(6)将Al2(SO4)3溶液与NaHCO3溶液混合,可以产生大量气体和泡沫,常用于灭火,写出溶液混合时发生的离子反应方程式_______
(1)某温度时,测得0. 01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数KW=
(2)常温下,将1 mL pH=1的H2SO4溶液加水稀释至100 mL,稀释后的溶液中c(H+)/ c(OH-)=
(3)常温下若将0.2 mol/LMOH溶液与0.1 mol/L HCl溶液等体积混合,测得混合溶液中,c(M+)<c(MOH),则说明混合溶液的pH
(4)某温度下Kw=10-13,CH3COONa溶液中由水电离的c(OH-)=10-4 mol·L-1,则该溶液的pH为
(5)常温下将0.1 mol/L HA(A表示酸根)溶液与0.1 mol/L NaOH溶液等体积混合,测得混合溶液的pH>7,原因是
(6)将Al2(SO4)3溶液与NaHCO3溶液混合,可以产生大量气体和泡沫,常用于灭火,写出溶液混合时发生的离子反应方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】25℃时,有浓度均为0.1mol·L-l的下列4种溶液:
①NaCN溶液②NaOH溶液③CH3COONa溶液④NaHCO3溶液
(1)这4种溶液pH由大到小的顺序是___________ (填序号),其中②由水电离的H+浓度为___________ 。
(2)①中各离子浓度由大到小的顺序是___________ 。
(3)25℃时,测得HCN和NaCN的混合溶液的pH=11,则 =
=___________ (填写数值)。向NaCN溶液中通入少量CO2,则发生反应的离子方程式为___________ 。
①NaCN溶液②NaOH溶液③CH3COONa溶液④NaHCO3溶液
| HCN | H2CO3 | CH3COOH |
| Ka=5.0×10-10 | Ka1=4.5×10-7 Ka2=4.7×10-11 | Ka=1.75×10-5 |
(2)①中各离子浓度由大到小的顺序是
(3)25℃时,测得HCN和NaCN的混合溶液的pH=11,则
 =
=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】已知pOH也可以用来表示溶液的酸碱度,规定pOH=−lgc平(OH-)。不同温度下,水溶液中pOH与pH的关系如图所示。
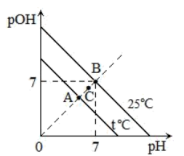
回答下列问题:
(1)t_______ 25(填“>”或“<”),图中A、B、C三点对应水的电离程度由大到小的顺序是_______ 。
(2)25℃时,向 溶液中逐滴加入等浓度的
溶液中逐滴加入等浓度的 溶液至
溶液至 恰好沉淀完全。
恰好沉淀完全。
①此过程中水的电离平衡_______ (填“正向”、“逆向”或“不”)移动。
②写出该过程发生反应的离子方程式_______ ;若反应前后溶液体积的变化忽略不计,则反应后所得溶液的pH值为_______ (已知 )。
)。

回答下列问题:
(1)t
(2)25℃时,向
 溶液中逐滴加入等浓度的
溶液中逐滴加入等浓度的 溶液至
溶液至 恰好沉淀完全。
恰好沉淀完全。①此过程中水的电离平衡
②写出该过程发生反应的离子方程式
 )。
)。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】温度25℃时,纯水中Kw=1.0×10-14,现有0.1mol/L的NaOH溶液和盐酸各10mL。请回答下列问题:
(1)两种溶液的pH分别为_________ 和_______ ;各取1mL该盐酸和NaOH溶液混合,离子方程式为___________________ 。
(2)该NaOH溶液中由水电离出的c(OH−)为__________ 。
(3)25℃时0.1mol/L的Na2CO3溶液pH = 10,此时溶液中c(H+)=______ ,水电离出的c(OH-)=_______ 。
(1)两种溶液的pH分别为
(2)该NaOH溶液中由水电离出的c(OH−)为
(3)25℃时0.1mol/L的Na2CO3溶液pH = 10,此时溶液中c(H+)=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】磷能形成次磷酸( )、亚磷酸(
)、亚磷酸( )、磷酸(
)、磷酸( )等多种含氧酸。
)等多种含氧酸。
(1)次磷酸( )是一种精细化工产品,已知10mL 1mol/L
)是一种精细化工产品,已知10mL 1mol/L  与20mL 1mol/L的NaOH溶液充分反应后生成组成为
与20mL 1mol/L的NaOH溶液充分反应后生成组成为 的盐,回答下列问题:
的盐,回答下列问题:
① 属于
属于_______ (填“正盐”“酸式盐”或“无法确定”)。
②若25℃时, ,则0.02mol/L的
,则0.02mol/L的 溶液的pH=
溶液的pH=_______ 。
③设计一种实验方案,证明次磷酸是弱酸:_______ 。
(2)亚磷酸( )是二元中强酸,某温度下,0.11mol/L的
)是二元中强酸,某温度下,0.11mol/L的 溶液的pH为2,该温度下
溶液的pH为2,该温度下 的电离平衡常数
的电离平衡常数 约为
约为_______ (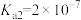 ,
, 的二级电离和水的电离忽略不计)。
的二级电离和水的电离忽略不计)。
(3)向 溶液中滴加NaOH溶液,回答下列问题:
溶液中滴加NaOH溶液,回答下列问题:
①恰好中和生成 时,所得溶液的pH
时,所得溶液的pH_______ (填“>”“<”或“=”,下同)7。
②溶液呈中性时,所得溶液的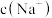
_______ 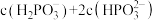 。
。
③若用甲基橙作指示剂,用NaOH溶液滴定,达到滴定终点时,所得溶液的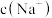
_______ 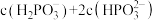 。
。
(4)磷酸( )是三元中强酸,若含
)是三元中强酸,若含 和
和 的溶液中
的溶液中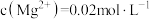 ,加入双氧水和磷酸(设溶液体积增加1倍),使
,加入双氧水和磷酸(设溶液体积增加1倍),使 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中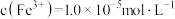 ,此时是否有
,此时是否有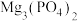 沉淀生成?
沉淀生成?_______ (列式计算)。 、
、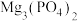 的
的 分别为
分别为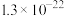 、
、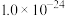 。
。
 )、亚磷酸(
)、亚磷酸( )、磷酸(
)、磷酸( )等多种含氧酸。
)等多种含氧酸。(1)次磷酸(
 )是一种精细化工产品,已知10mL 1mol/L
)是一种精细化工产品,已知10mL 1mol/L  与20mL 1mol/L的NaOH溶液充分反应后生成组成为
与20mL 1mol/L的NaOH溶液充分反应后生成组成为 的盐,回答下列问题:
的盐,回答下列问题:①
 属于
属于②若25℃时,
 ,则0.02mol/L的
,则0.02mol/L的 溶液的pH=
溶液的pH=③设计一种实验方案,证明次磷酸是弱酸:
(2)亚磷酸(
 )是二元中强酸,某温度下,0.11mol/L的
)是二元中强酸,某温度下,0.11mol/L的 溶液的pH为2,该温度下
溶液的pH为2,该温度下 的电离平衡常数
的电离平衡常数 约为
约为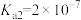 ,
, 的二级电离和水的电离忽略不计)。
的二级电离和水的电离忽略不计)。(3)向
 溶液中滴加NaOH溶液,回答下列问题:
溶液中滴加NaOH溶液,回答下列问题:①恰好中和生成
 时,所得溶液的pH
时,所得溶液的pH②溶液呈中性时,所得溶液的
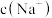
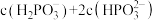 。
。③若用甲基橙作指示剂,用NaOH溶液滴定,达到滴定终点时,所得溶液的
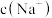
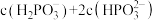 。
。(4)磷酸(
 )是三元中强酸,若含
)是三元中强酸,若含 和
和 的溶液中
的溶液中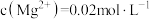 ,加入双氧水和磷酸(设溶液体积增加1倍),使
,加入双氧水和磷酸(设溶液体积增加1倍),使 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中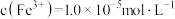 ,此时是否有
,此时是否有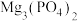 沉淀生成?
沉淀生成? 、
、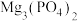 的
的 分别为
分别为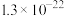 、
、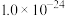 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】回答下列问题。
(1)双氧水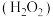 和水都是极弱电解质,若把
和水都是极弱电解质,若把 看成是二元弱酸,请写出在水中的电离方程式:
看成是二元弱酸,请写出在水中的电离方程式:___________ 。鉴于 显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐。请写出
显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐。请写出 与
与 作用形成盐的两个化学方程式:
作用形成盐的两个化学方程式:___________ 。
(2)如图是向 的盐酸中逐渐加入
的盐酸中逐渐加入 溶液时,溶液的
溶液时,溶液的 变化图像。
变化图像。___________  。
。
②X的值为___________ 。
(3)已知 的高碘酸
的高碘酸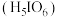 溶液与
溶液与 的
的 溶液等体积混合,所得混合溶液呈酸性,
溶液等体积混合,所得混合溶液呈酸性, 的碘酸
的碘酸 或高锰酸
或高锰酸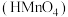 溶液与
溶液与 的
的 溶液等体积混合,所得溶液呈中性,高碘酸是
溶液等体积混合,所得溶液呈中性,高碘酸是___________ (填“强酸”或“弱酸”),理由是___________ 。
(4) 时,在一定体积
时,在一定体积 的
的 溶液中,逐滴加入一定物质的量浓度的
溶液中,逐滴加入一定物质的量浓度的 溶液,当溶液中的
溶液,当溶液中的 恰好完全沉淀时,溶液
恰好完全沉淀时,溶液 ,忽略溶液体积变化,则
,忽略溶液体积变化,则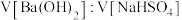 为
为___________ 。
(1)双氧水
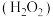 和水都是极弱电解质,若把
和水都是极弱电解质,若把 看成是二元弱酸,请写出在水中的电离方程式:
看成是二元弱酸,请写出在水中的电离方程式: 显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐。请写出
显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐。请写出 与
与 作用形成盐的两个化学方程式:
作用形成盐的两个化学方程式:(2)如图是向
 的盐酸中逐渐加入
的盐酸中逐渐加入 溶液时,溶液的
溶液时,溶液的 变化图像。
变化图像。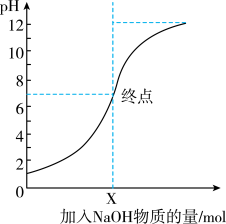
 。
。②X的值为
(3)已知
 的高碘酸
的高碘酸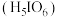 溶液与
溶液与 的
的 溶液等体积混合,所得混合溶液呈酸性,
溶液等体积混合,所得混合溶液呈酸性, 的碘酸
的碘酸 或高锰酸
或高锰酸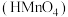 溶液与
溶液与 的
的 溶液等体积混合,所得溶液呈中性,高碘酸是
溶液等体积混合,所得溶液呈中性,高碘酸是(4)
 时,在一定体积
时,在一定体积 的
的 溶液中,逐滴加入一定物质的量浓度的
溶液中,逐滴加入一定物质的量浓度的 溶液,当溶液中的
溶液,当溶液中的 恰好完全沉淀时,溶液
恰好完全沉淀时,溶液 ,忽略溶液体积变化,则
,忽略溶液体积变化,则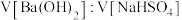 为
为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】已知一元强酸 和一元弱酸
和一元弱酸 是生活中常用的两种酸。某实验小组对两种酸溶液进行以下实验:
是生活中常用的两种酸。某实验小组对两种酸溶液进行以下实验:
(1) 的电离方程式为
的电离方程式为___________ 。
(2)25℃时,随着不断加水稀释, 的电离程度
的电离程度___________ (填“增大”“减小”或“不变”)。
(3)常温下,在
 溶液加水稀释的过程中,下列表达式的数值一定变小的是___________。
溶液加水稀释的过程中,下列表达式的数值一定变小的是___________。
(4)常温下 的
的 、
、 溶液稀释过程如下图,曲线I代表的酸是
溶液稀释过程如下图,曲线I代表的酸是___________ , 溶液中由水电离出的
溶液中由水电离出的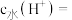
___________  ,a、b、c三点导电能力由大到小的顺序是
,a、b、c三点导电能力由大到小的顺序是___________ 。

(5)25 ℃时,水电离出的H+浓度为1×10-13mol·L-1的硫酸溶液中,溶液的pH为___________ ;pH为12的NaOH溶液100mL,要使pH变为11,加入0.01mol·L-1HCl溶液___________ mL。(忽略溶液体积变化)
 和一元弱酸
和一元弱酸 是生活中常用的两种酸。某实验小组对两种酸溶液进行以下实验:
是生活中常用的两种酸。某实验小组对两种酸溶液进行以下实验:(1)
 的电离方程式为
的电离方程式为(2)25℃时,随着不断加水稀释,
 的电离程度
的电离程度(3)常温下,在

 溶液加水稀释的过程中,下列表达式的数值一定变小的是___________。
溶液加水稀释的过程中,下列表达式的数值一定变小的是___________。A. | B. | C. | D. |
 的
的 、
、 溶液稀释过程如下图,曲线I代表的酸是
溶液稀释过程如下图,曲线I代表的酸是 溶液中由水电离出的
溶液中由水电离出的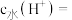
 ,a、b、c三点导电能力由大到小的顺序是
,a、b、c三点导电能力由大到小的顺序是
(5)25 ℃时,水电离出的H+浓度为1×10-13mol·L-1的硫酸溶液中,溶液的pH为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】Na2SO3是中学化学中常用的试剂。测定0.1 mol·L-1的Na2SO3溶液的pH与温度关系如下表所示(已知d>c>b>a)。
(1)水的离子积:Kw(a)___________ (填“>”“<”或“=”,下同)Kw(d);水解常数:Kh1(a)___________ Kh1(b)。
(2)分别取a、d时刻的溶液各10 mL,加入足量的用盐酸酸化的BaCl2溶液做对比实验,d时刻溶液产生的白色沉淀比a时刻的多。该白色沉淀的化学式是___________ ,d时刻沉淀比a时刻溶液多的原因是___________ 。
(3)数据显示:a→c的过程中,___________ (填“浓度”或“温度”)对水解平衡移动方向的影响程度更大。
(4)为了证明上述规律的普遍性,可以选择下列物质做类似实验,该物质是___________(填字母)。
| 时刻 | a | b | c | d |
| 温度/℃ | 25 | 30 | 40 | 25 |
| pH | 9.66 | 9.52 | 9.37 | 9.25 |
(1)水的离子积:Kw(a)
(2)分别取a、d时刻的溶液各10 mL,加入足量的用盐酸酸化的BaCl2溶液做对比实验,d时刻溶液产生的白色沉淀比a时刻的多。该白色沉淀的化学式是
(3)数据显示:a→c的过程中,
(4)为了证明上述规律的普遍性,可以选择下列物质做类似实验,该物质是___________(填字母)。
| A.Na2CO3 | B.NaHCO3 | C.Na2S | D.Na2SO4 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】已知常温下H2C2O4的电离平衡常数Ka1=5.4×10-2,Ka2=5.4×10-5,反应NH3·H2O+HC2O4-=NH4++C2O42-+H2O的平衡常数K=9.45×104,则NH3·H2O的电离平衡常数Kb=______________ 。
您最近一年使用:0次


 的下列溶液:
的下列溶液: 硫酸
硫酸  醋酸
醋酸  氢氧化钠
氢氧化钠  氯化铵
氯化铵  醋酸铵
醋酸铵  硫酸铵
硫酸铵  硫酸氢铵
硫酸氢铵  氨水,请回答下列问题:
氨水,请回答下列问题: 、
、 浓度由大到小的顺序是
浓度由大到小的顺序是 填序号
填序号
 、
、 浓度由大到小的顺序是
浓度由大到小的顺序是 将
将