实验室用酸碱中和滴定法测定某市售白醋中醋酸的浓度。回答下列问题:
(1)量取待测白醋溶液20.00mL于__ 中,滴加2滴酚酞作指示剂;将0.1000mol/LNaOH溶液盛装于碱式滴定管中,调至“0”刻度并进行滴定;当出现___ 现象时,停止滴定,并记录NaOH溶液的最终读数。
(2)在完成上述第1次滴定后,重复滴定3次.记录数据如下:
①计算得:c(CH3COOH)=__ mol•L-1。
②碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果__ (填“偏小”、“偏大”或“无影响”)。
(3)用0.1molNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
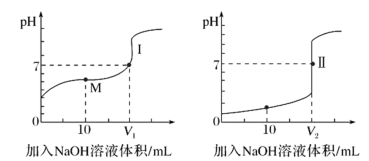
①滴定醋酸的曲线是__ (填“Ⅰ”或“Ⅱ”)。
②V1和V2的关系:V1__ V2(填“>”、“=”或“<”)。
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是__ 。
(1)量取待测白醋溶液20.00mL于
(2)在完成上述第1次滴定后,重复滴定3次.记录数据如下:
| 实验数据(mL)/滴定次数 | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V[NaOH(aq)](消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
②碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果
(3)用0.1molNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是
②V1和V2的关系:V1
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是
更新时间:2021-12-22 18:46:33
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】测定NaOH和Na2CO3的混合液中NaOH的含量时,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用已知浓度的盐酸滴定(用酚酞作指示剂,其变色pH范围为8~10)。试回答:
(1)滴定时BaCO3能否不断溶解?______ (填“能” 或“不能”),理由是______ 。
(2)如用甲基橙作指示剂(其变色pH范围为3.1~4.4),则测定的结果______ (填“偏高”“偏低”或“无影响”)。原因是______

(3)上图是3种定量仪器的一部分,在酸碱中和滴定时应选______ (填序号),在滴定接近终点时,应用蒸馏水润洗锥形瓶内壁,目的是______
(1)滴定时BaCO3能否不断溶解?
(2)如用甲基橙作指示剂(其变色pH范围为3.1~4.4),则测定的结果

(3)上图是3种定量仪器的一部分,在酸碱中和滴定时应选
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】酸碱混合时可以得到滴定图象、微粒分布图象等。
I.已知HA为一元弱酸。室温下,取20.00 mL HA溶液,逐滴加入0.1000 mol/L的标准NaOH溶液进行滴定。
(1)滴定实验中,选_______ (“酚酞"或“甲基橙”)做指示剂。
(2)①实验操作中,盛装NaOH溶液后排气泡动作正确的是_______ (填序号)。

②在滴定的某时刻,滴定管中液面如图所示,此时滴定管读数为_______ mL。

③滴定过程中部分操作如下,下列各操作使测量结果偏高的是_______ (填字母)。
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.快速滴定后立即读数
D. 滴定结束后,俯视液面,读取NaOH溶液体积
II.氧化还原滴定实验与酸碱中和滴定类似,用0.1 mol/L高锰酸钾溶液滴定无色草酸溶液:2 +5H2C2O4+ 6H+ =10CO2↑+2Mn2++8H2O,取25.00mL草酸稀溶液于锥形瓶中进行滴定。滴定数据如下:
+5H2C2O4+ 6H+ =10CO2↑+2Mn2++8H2O,取25.00mL草酸稀溶液于锥形瓶中进行滴定。滴定数据如下:
(1)该实验滴定至终点时的标志是_______ 。
(2)草酸溶液的物质的量浓度为_______ mol/L。
I.已知HA为一元弱酸。室温下,取20.00 mL HA溶液,逐滴加入0.1000 mol/L的标准NaOH溶液进行滴定。
(1)滴定实验中,选
(2)①实验操作中,盛装NaOH溶液后排气泡动作正确的是

②在滴定的某时刻,滴定管中液面如图所示,此时滴定管读数为

③滴定过程中部分操作如下,下列各操作使测量结果偏高的是
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.快速滴定后立即读数
D. 滴定结束后,俯视液面,读取NaOH溶液体积
II.氧化还原滴定实验与酸碱中和滴定类似,用0.1 mol/L高锰酸钾溶液滴定无色草酸溶液:2
 +5H2C2O4+ 6H+ =10CO2↑+2Mn2++8H2O,取25.00mL草酸稀溶液于锥形瓶中进行滴定。滴定数据如下:
+5H2C2O4+ 6H+ =10CO2↑+2Mn2++8H2O,取25.00mL草酸稀溶液于锥形瓶中进行滴定。滴定数据如下:实验序号 | 待测液体积(mL) | 标准溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 3.00 | 23.00 |
第三次 | 25.00 | 4.00 | 24.10 |
(2)草酸溶液的物质的量浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】Ⅰ.实验室中有一瓶含有一定量杂质的烧碱NaOH样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中所含杂质与酸不反应,请根据实验回答:
(1)将准确称取的5g烧碱样品配成100mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、托盘天平外,还必须用到的玻璃仪器有:___________ 、___________ 。
用碱式滴定管取10.00mL待测液。
(2)用0.5000mol/L标准盐酸滴定待测烧碱溶液,以酚酞为指示剂。滴定时左手旋转滴定管玻璃活塞,右手不停地摇动锥形瓶,两眼注视___________ ,直到滴定终点。滴定终点判断:___________ 。
(3)根据下列数据,烧碱的纯度为:___________ 。
Ⅱ.氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定;
③终点时用去20mL1.0×10-4mol·L-1的KMnO4溶液。
(4)配平:KMnO4滴定H2C2O4的化学方程式:___________ 。
___________KMnO4+___________H2C2O4+___________H2SO4=___________K2SO4+___________MnSO4+___________CO2↑+___________H2O
(5)滴定时,用___________ (填“甲”或“乙”)KMnO4溶液来移取
①如果滴定管用蒸馏水洗后未用酸性KMnO4标准液润洗,则测量结果___________ 。
②滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则测量结果___________ 。
(1)将准确称取的5g烧碱样品配成100mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、托盘天平外,还必须用到的玻璃仪器有:
用碱式滴定管取10.00mL待测液。
(2)用0.5000mol/L标准盐酸滴定待测烧碱溶液,以酚酞为指示剂。滴定时左手旋转滴定管玻璃活塞,右手不停地摇动锥形瓶,两眼注视
(3)根据下列数据,烧碱的纯度为:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 2.10 | 23.80 |
| 第三次 | 10.00 | 4.00 | 24.10 |
Ⅱ.氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定;
③终点时用去20mL1.0×10-4mol·L-1的KMnO4溶液。
(4)配平:KMnO4滴定H2C2O4的化学方程式:
___________KMnO4+___________H2C2O4+___________H2SO4=___________K2SO4+___________MnSO4+___________CO2↑+___________H2O
(5)滴定时,用

①如果滴定管用蒸馏水洗后未用酸性KMnO4标准液润洗,则测量结果
②滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则测量结果
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某化学兴趣小组用中和滴定法测定一瓶烧碱溶液的浓度(该烧碱溶液中不含与酸反应的杂质),测定过程如下:
a.将锥形瓶置于酸式滴定管下,锥形瓶下垫一张白纸;
b.分别取25.00mL酸、碱滴定管各一支,洗涤并用待装液润洗;
c.打开酸式滴定管旋塞开始滴定直到终点,记录下终点时滴定管上的读数;
d.取一个用蒸馏水洗净的锥形瓶,从碱式滴定管中放出20.00mL待测碱液于锥形瓶中,滴入2至3滴酚酞试液;
e.碱式滴定管中加入待测烧碱溶液,酸式滴定管中加入0.1000mol·L-1的稀盐酸标准溶液,并将两支滴定管尖嘴部分的气泡均赶尽,记下液面刻度;
f.再重复上述操作2次。
三次测定获得的数据如下表:
(1)上述实验操作的正确顺序是___ (填字母序号)。
(2)实验中,除用酚酞作指示剂外,还可以选用___ 作该实验的指示剂,在锥形瓶下垫一张白纸的作用是___ 。
(3)如何判断滴定达到了终点?___
(4)根据实验数据,计算待测碱液的浓度为___ mol·L-1(保留两位小数)。
(5)下列操作中可能使所测烧碱溶液的浓度数值偏低的是___ 。(填正确答案标号)
A.操作b中,未润洗酸式滴定管
B.操作e中,碱式滴定管尖嘴处的气泡未赶出,而取液后其尖嘴处的气泡消失了
C.操作d中,装碱液时,锥形瓶中还有少量蒸馏水
D.操作c中,滴定终点时发现酸式滴定管尖嘴处悬挂着一滴溶液
E.酸式滴定管读数时,滴定前仰视读数,滴定结束时俯视读数
a.将锥形瓶置于酸式滴定管下,锥形瓶下垫一张白纸;
b.分别取25.00mL酸、碱滴定管各一支,洗涤并用待装液润洗;
c.打开酸式滴定管旋塞开始滴定直到终点,记录下终点时滴定管上的读数;
d.取一个用蒸馏水洗净的锥形瓶,从碱式滴定管中放出20.00mL待测碱液于锥形瓶中,滴入2至3滴酚酞试液;
e.碱式滴定管中加入待测烧碱溶液,酸式滴定管中加入0.1000mol·L-1的稀盐酸标准溶液,并将两支滴定管尖嘴部分的气泡均赶尽,记下液面刻度;
f.再重复上述操作2次。
三次测定获得的数据如下表:
| 实验次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.45 | 24.40 |
| 2 | 20.00 | 2.20 | 26.25 |
| 3 | 20.00 | 0.10 | 17.10 |
(2)实验中,除用酚酞作指示剂外,还可以选用
(3)如何判断滴定达到了终点?
(4)根据实验数据,计算待测碱液的浓度为
(5)下列操作中可能使所测烧碱溶液的浓度数值偏低的是
A.操作b中,未润洗酸式滴定管
B.操作e中,碱式滴定管尖嘴处的气泡未赶出,而取液后其尖嘴处的气泡消失了
C.操作d中,装碱液时,锥形瓶中还有少量蒸馏水
D.操作c中,滴定终点时发现酸式滴定管尖嘴处悬挂着一滴溶液
E.酸式滴定管读数时,滴定前仰视读数,滴定结束时俯视读数
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】铬酸盐是指含铬酸根(CrO )的盐类。铬酸盐最显著的特点是具有鲜明的颜色,如BaCrO4呈黄色,Ag2CrO4呈砖红色,均不易溶于水。
)的盐类。铬酸盐最显著的特点是具有鲜明的颜色,如BaCrO4呈黄色,Ag2CrO4呈砖红色,均不易溶于水。
I、工业废水中常含有一定量的Cr2O 和CrO
和CrO ,它们会对人类及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的处理方法之一,工艺流程如下:CrO
,它们会对人类及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的处理方法之一,工艺流程如下:CrO
 Cr2O
Cr2O
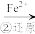 Cr3+
Cr3+ Cr(OH)3
Cr(OH)3
(1)第①步中,离子不能完全转化,转化反应的离子方程式为:_______ 。
(2)第③步中,要使Cr3+沉淀完全,应调整溶液的pH≥_______ 。(已知常温下,Ksp[Cr(OH)3]=1.0×10-32)
II、莫尔法是用K2CrO4作指示剂,用AgNO3作标准溶液的测定Cl-(或Br-)的方法。现用莫尔法测定亚硝酰氯样品中NOCl的纯度,实验步骤如下:
步骤1:取m g NOCl样品,溶于蒸馏水(发生反应:NOCl+H2O=HNO2+HCl),配制成250mL溶液,准确量取25.00 mL溶液于锥形瓶中;
步骤2:加入适量K2CrO4溶液作指示剂,用c mol·L-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为V mL;
(3)滴定终点的标志是_______ 。
(4)亚硝酰氯样品中NOCl的纯度为_______ 。
(5)若滴定终点时俯视读数,所测NOCl的纯度_______ (填“偏高”、“偏低”、“不变”)。
 )的盐类。铬酸盐最显著的特点是具有鲜明的颜色,如BaCrO4呈黄色,Ag2CrO4呈砖红色,均不易溶于水。
)的盐类。铬酸盐最显著的特点是具有鲜明的颜色,如BaCrO4呈黄色,Ag2CrO4呈砖红色,均不易溶于水。I、工业废水中常含有一定量的Cr2O
 和CrO
和CrO ,它们会对人类及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的处理方法之一,工艺流程如下:CrO
,它们会对人类及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的处理方法之一,工艺流程如下:CrO
 Cr2O
Cr2O
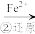 Cr3+
Cr3+ Cr(OH)3
Cr(OH)3(1)第①步中,离子不能完全转化,转化反应的离子方程式为:
(2)第③步中,要使Cr3+沉淀完全,应调整溶液的pH≥
II、莫尔法是用K2CrO4作指示剂,用AgNO3作标准溶液的测定Cl-(或Br-)的方法。现用莫尔法测定亚硝酰氯样品中NOCl的纯度,实验步骤如下:
步骤1:取m g NOCl样品,溶于蒸馏水(发生反应:NOCl+H2O=HNO2+HCl),配制成250mL溶液,准确量取25.00 mL溶液于锥形瓶中;
步骤2:加入适量K2CrO4溶液作指示剂,用c mol·L-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为V mL;
(3)滴定终点的标志是
(4)亚硝酰氯样品中NOCl的纯度为
(5)若滴定终点时俯视读数,所测NOCl的纯度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】酸碱中和滴定是依据中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法。回答下列问题:
(1)选用以下主要仪器和试剂,___________ (填“能”或“不能”)达到测定 溶液浓度的目的。
溶液浓度的目的。
主要仪器:滴定管、锥形瓶。试剂: 溶液、
溶液、 盐酸。
盐酸。
(2)现用
 标准溶液来测定未知浓度的盐酸。
标准溶液来测定未知浓度的盐酸。
①用 标准溶液滴定时,应将
标准溶液滴定时,应将 标准溶液注入
标准溶液注入___________ (填“甲”或“乙”)中。

②某学生的操作步骤如下:
A.移取20.00mL待测盐酸溶液注入到洁净的锥形瓶中,并加入2~3滴酚酞溶液
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液
D.取 标准溶液注入碱式滴定管中至“0”刻度以上2~3mL
标准溶液注入碱式滴定管中至“0”刻度以上2~3mL
E.调节液面至“0”或“0”以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准 溶液滴定至终点并记下滴定管液面的刻度。
溶液滴定至终点并记下滴定管液面的刻度。
正确的操作顺序是___________ (填标号)。上述B步骤操作的目的是___________ 。到达滴定终点时的实验现象是___________ 。
③下图是用
 标准溶液来测定未知浓度的盐酸(体积为20.00mL)的滴定过程中碱式滴定管中液面在滴定前后的读数,则
标准溶液来测定未知浓度的盐酸(体积为20.00mL)的滴定过程中碱式滴定管中液面在滴定前后的读数,则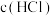 =
=___________  。
。

(1)选用以下主要仪器和试剂,
 溶液浓度的目的。
溶液浓度的目的。主要仪器:滴定管、锥形瓶。试剂:
 溶液、
溶液、 盐酸。
盐酸。(2)现用

 标准溶液来测定未知浓度的盐酸。
标准溶液来测定未知浓度的盐酸。①用
 标准溶液滴定时,应将
标准溶液滴定时,应将 标准溶液注入
标准溶液注入
②某学生的操作步骤如下:
A.移取20.00mL待测盐酸溶液注入到洁净的锥形瓶中,并加入2~3滴酚酞溶液
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液
D.取
 标准溶液注入碱式滴定管中至“0”刻度以上2~3mL
标准溶液注入碱式滴定管中至“0”刻度以上2~3mLE.调节液面至“0”或“0”以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准
 溶液滴定至终点并记下滴定管液面的刻度。
溶液滴定至终点并记下滴定管液面的刻度。正确的操作顺序是
③下图是用

 标准溶液来测定未知浓度的盐酸(体积为20.00mL)的滴定过程中碱式滴定管中液面在滴定前后的读数,则
标准溶液来测定未知浓度的盐酸(体积为20.00mL)的滴定过程中碱式滴定管中液面在滴定前后的读数,则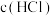 =
= 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】按要求回答下列问题:
(1)实验室中通常用NaOH溶液进行洗气和提纯,当用100mL3mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__ 。
(2)常温下,向一定体积的0.1mol·L-1的醋酸溶液中加水稀释后,下列说法正确的是__ (填字母)。
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)也增大
C.溶液中 不变
不变
D.溶液中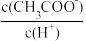 减小
减小
(3)①常温下将0.15mol·L-1的稀硫酸V1mL与0.1mol·L-1的NaOH溶液V2mL混合,所得溶液的pH为1,则V1∶V2=__ (溶液体积的变化忽略不计)。
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是__ (填字母)。
A.若混合后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1
B.若V1=V2,混合后溶液的pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol·L-1的下列五种溶液的pH如表所示:
①根据表中数据,将浓度均为0.01mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最小的是__ (填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是__ (填字母)。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
(5)几种离子开始沉淀时的pH如表所示:
当向含相同浓度Cu2+、Mg2+和Fe2+的溶液中滴加NaOH溶液时,__ (填离子符号)先沉淀。
(1)实验室中通常用NaOH溶液进行洗气和提纯,当用100mL3mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为
(2)常温下,向一定体积的0.1mol·L-1的醋酸溶液中加水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)也增大
C.溶液中
 不变
不变D.溶液中
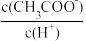 减小
减小(3)①常温下将0.15mol·L-1的稀硫酸V1mL与0.1mol·L-1的NaOH溶液V2mL混合,所得溶液的pH为1,则V1∶V2=
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是
A.若混合后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1
B.若V1=V2,混合后溶液的pH一定等于7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol·L-1的下列五种溶液的pH如表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①根据表中数据,将浓度均为0.01mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最小的是
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
(5)几种离子开始沉淀时的pH如表所示:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+和Fe2+的溶液中滴加NaOH溶液时,
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】通过学习,同学们对宏观辨识与微观探析,变化观念与平衡思想等学科素养有了进一步的认识和理解。请根据所学知识回答下列问题
(1)FeCl3溶液呈酸性原因是__________________ (用离子方程式表示);若把FeCl3溶液蒸干,灼烧,最后得到固体产物是 ____________ 。
(2)将1L 0.2 mol·L-1HA溶液与1L 0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)> c(A-),则混合溶液中c(HA)+c(A-)_____ 0.1 mol·L-1(填“>”、“<”或“=”)。
(3)浓度均为0.1 mol/L的四种溶液①氯化铵溶液、②碳酸氢铵溶液、③氨水、④硫酸氢铵中,NH4+浓度由大到小的顺序为________________________ 。(填序号)
(4)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常温下,某酸性MgCl2溶液中含有少量的FeCl3 ,为了得到纯净的MgCl2·2H2O晶体,应加入________ (填化学式),调节溶液的pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________ mol·L-1。
②常温下,若将0.01 mol·L-1 MgCl2溶液与________ mol·L-1 NaOH溶液等体积混合时有沉淀生成。
(1)FeCl3溶液呈酸性原因是
(2)将1L 0.2 mol·L-1HA溶液与1L 0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)> c(A-),则混合溶液中c(HA)+c(A-)
(3)浓度均为0.1 mol/L的四种溶液①氯化铵溶液、②碳酸氢铵溶液、③氨水、④硫酸氢铵中,NH4+浓度由大到小的顺序为
(4)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常温下,某酸性MgCl2溶液中含有少量的FeCl3 ,为了得到纯净的MgCl2·2H2O晶体,应加入
②常温下,若将0.01 mol·L-1 MgCl2溶液与
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】回答下列问题:
(1)根据表中数据回答下列问题。
①(NH4)2C2O4溶液呈酸性,溶液中各离子浓度由大到小的顺序为______ 。
②将0.1mol•L-1的Na2CO3溶液逐渐滴加到同浓度的HCN溶液中,写出发生反应的离子方程式______ 。
③浓度均为0.1mol•L-1的Na2CO3、NaHCO3、NaCN、NaHC2O4溶液,pH最大的是______ 。
(2)氮化铵是最常见的铵盐,在工业生产中用途广泛。
①热的浓氯化铵溶液可以清洗铁器表面锈迹,写出相关反应的离子方程式:______ 。
②常温下,向100mL0.2mol•L-1的氨水中逐滴加入0.2mol•L-1的盐酸,所得溶液的pH、溶液中NH 和NH3•H2O的物质的量分数与加入盐酸的体积的关系如图所示。
和NH3•H2O的物质的量分数与加入盐酸的体积的关系如图所示。
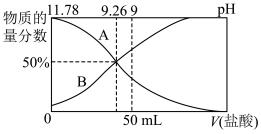
a.NH3•H2O的电离常数为______ 。
b.当加入盐酸的体积为50mL时,溶液中c(NH )-c(NH3•H2O)=
)-c(NH3•H2O)=______ mol•L-1(用式子表示即可,不用算出结果)。
③常温下,在20mLamol•L-1氨水中滴加20mLbmol•L-1盐酸恰好使溶液呈中性,常温下,NH 的水解常数Kh=
的水解常数Kh=______ (用含a、b的代数式表示)。
(1)根据表中数据回答下列问题。
| 酸 | H2C2O4 | HCN | H2CO3 |
| 电离常数(25℃) | K1=5.4×10-2 K2=5.4×10-5 | 4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
②将0.1mol•L-1的Na2CO3溶液逐渐滴加到同浓度的HCN溶液中,写出发生反应的离子方程式
③浓度均为0.1mol•L-1的Na2CO3、NaHCO3、NaCN、NaHC2O4溶液,pH最大的是
(2)氮化铵是最常见的铵盐,在工业生产中用途广泛。
①热的浓氯化铵溶液可以清洗铁器表面锈迹,写出相关反应的离子方程式:
②常温下,向100mL0.2mol•L-1的氨水中逐滴加入0.2mol•L-1的盐酸,所得溶液的pH、溶液中NH
 和NH3•H2O的物质的量分数与加入盐酸的体积的关系如图所示。
和NH3•H2O的物质的量分数与加入盐酸的体积的关系如图所示。
a.NH3•H2O的电离常数为
b.当加入盐酸的体积为50mL时,溶液中c(NH
 )-c(NH3•H2O)=
)-c(NH3•H2O)=③常温下,在20mLamol•L-1氨水中滴加20mLbmol•L-1盐酸恰好使溶液呈中性,常温下,NH
 的水解常数Kh=
的水解常数Kh=
您最近一年使用:0次



