下列事实不能用勒夏特列原理解释的是
| A.二氧化氮转化为四氧化二氮的平衡体系,缩小容器体积后混合气体颜色加深 |
| B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 |
C.用钠与氯化钾共融的方法制备气态钾: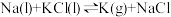 |
D.反应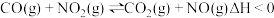 ,达到化学平衡后,升高温度体系的颜色加深 ,达到化学平衡后,升高温度体系的颜色加深 |
21-22高二上·天津西青·期中 查看更多[2]
更新时间:2021-12-18 16:36:36
|
相似题推荐
单选题
|
较易
(0.85)
【推荐1】下列生产、生活等实际应用,不能用勒沙特列原理解释的是
| A.冰镇的啤酒打开后泛起泡沫 |
| B.工业合成氨时选择高温能极大加快反应速率 |
| C.实验室中常用排饱和食盐水的方法收集Cl2 |
| D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】已知在200℃,101kPa下,氢气与碘蒸气混合发生应:H2(g)+I2(g) 2HI(g),则下列叙述正确的是( )
2HI(g),则下列叙述正确的是( )
 2HI(g),则下列叙述正确的是( )
2HI(g),则下列叙述正确的是( )| A.反应达平衡后,增大压强(缩小容器体积),混合气体颜色不变 |
| B.由反应需在200℃进行可推测该反应是吸热反应 |
| C.反应达平衡后,保持容器体积不变,充入大量I2蒸气可提高H2的转化率 |
| D.当v(H2)生成:v(HI)生成=2:1时,反应达到平衡状态 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】某可逆反应过程能量变化如图所示,下列说法中正确的是
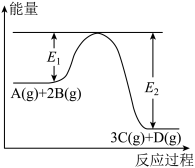

A.该反应热化学方程式为: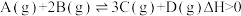 |
| B.其它条件不变,升高温度,A的转化率增大 |
C.其它条件不变,加催化剂,反应速率增大, 和 和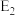 均减小,ΔH不变 均减小,ΔH不变 |
| D.其它条件不变,增大压强,平衡向逆向移动,平衡常数K减小 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】以[Cu(H2O)]2+(蓝)+4Cl- [CuCl4]2-(黄)+4H2O △H>0为例,探究影响平衡移动的因素。取相同浓度的CuCl2溶液,分别进行下列实验,对实验现象的分析不正确的是
[CuCl4]2-(黄)+4H2O △H>0为例,探究影响平衡移动的因素。取相同浓度的CuCl2溶液,分别进行下列实验,对实验现象的分析不正确的是
 [CuCl4]2-(黄)+4H2O △H>0为例,探究影响平衡移动的因素。取相同浓度的CuCl2溶液,分别进行下列实验,对实验现象的分析不正确的是
[CuCl4]2-(黄)+4H2O △H>0为例,探究影响平衡移动的因素。取相同浓度的CuCl2溶液,分别进行下列实验,对实验现象的分析不正确的是| 操作和现象 | 分析 | |
| A. | 观察溶液为绿色 | [Cu(H2O)]2+和[CuCl4]2-同时存在 |
| B. | 升高温度,溶液变为黄绿色 | 平衡正移,[CuCl4]2-的浓度增大 |
| C. | 加几滴AgNO3溶液,静置,上层清液为蓝色 | 平衡逆移,[CuCl4]2-的浓度减小 |
| D. | 加少量Zn片,静置,上层清液为浅黄绿色 | 平衡正移,[CuCl4]2-的浓度增大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】反应X(g)+2Y(g) 4Z(g) ΔH<0,在一密闭容器中充入0.1molX和0.2molY,达到平衡时,下列说法不正确的是( )
4Z(g) ΔH<0,在一密闭容器中充入0.1molX和0.2molY,达到平衡时,下列说法不正确的是( )
 4Z(g) ΔH<0,在一密闭容器中充入0.1molX和0.2molY,达到平衡时,下列说法不正确的是( )
4Z(g) ΔH<0,在一密闭容器中充入0.1molX和0.2molY,达到平衡时,下列说法不正确的是( )| A.升温,X的转化率减小 |
| B.增加一定量的X,X的转化率减小 |
| C.保持体积和温度不变,再充入0.1molX和0.2molY,平衡逆移,X的转化率减小 |
| D.加入催化剂,Z的产率不变 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】下列实验事实不能用平衡移动原理解释的是( )
| A.工业合成氨反应中加压有利于提高氨气的产率 |
B.将NO2球浸泡在冷水和热水中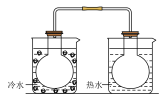 |
| C.红棕色的NO2,加压后颜色先变深后变浅 |
D. |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】已知 的电离平衡常数:
的电离平衡常数: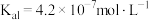 和
和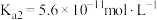 ,
, 的电离平衡常数:
的电离平衡常数: 。在反应
。在反应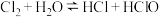 达到平衡后,要使
达到平衡后,要使 的浓度增大可加入
的浓度增大可加入
 的电离平衡常数:
的电离平衡常数: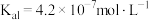 和
和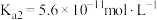 ,
, 的电离平衡常数:
的电离平衡常数: 。在反应
。在反应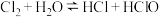 达到平衡后,要使
达到平衡后,要使 的浓度增大可加入
的浓度增大可加入A. | B. | C. | D. |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】下列叙述及解释正确的是
| A.2NO2(g)(红棕色)⇌N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取升高温度的措施,因为平衡向正反应方向移动,故体系颜色变浅 |
| B.H2(g)+I2(g)⇌2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 |
| C.FeCl3+3KSCN⇌Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅 |
| D.对于N2+3H2⇌2NH3,平衡后,压强不变,充入氦气,平衡左移 |
您最近一年使用:0次

 ,温度T1、T2下X的物质的量浓度
,温度T1、T2下X的物质的量浓度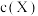 随时间
随时间 变化的曲线如图所示。下列叙述正确的是
变化的曲线如图所示。下列叙述正确的是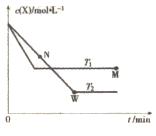
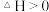

 ,达到平衡时,下列说法错误的是
,达到平衡时,下列说法错误的是 的浓度增大
的浓度增大 ,平衡不移动
,平衡不移动

