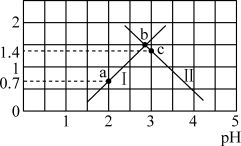
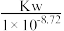草酸 是二元弱酸,常温下,用NaOH溶液滴定草酸溶液,溶液中
是二元弱酸,常温下,用NaOH溶液滴定草酸溶液,溶液中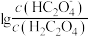 或
或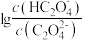 与混合溶液pH关系如图所示。下列说法错误的是
与混合溶液pH关系如图所示。下列说法错误的是
 是二元弱酸,常温下,用NaOH溶液滴定草酸溶液,溶液中
是二元弱酸,常温下,用NaOH溶液滴定草酸溶液,溶液中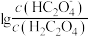 或
或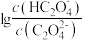 与混合溶液pH关系如图所示。下列说法错误的是
与混合溶液pH关系如图所示。下列说法错误的是
A.曲线Ⅰ为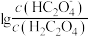 随溶液pH的变化曲线 随溶液pH的变化曲线 |
B.b点时,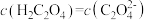 |
C.常温下,草酸的电离常数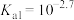 , ,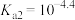 |
| D.a、b、c三点,水的电离程度先增大后减小 |
更新时间:2022-01-21 10:27:11
|
相似题推荐
多选题
|
较难
(0.4)
名校
【推荐1】常温下,用0.1 mol⋅L 的NaOH溶液滴定10.00 mL 0.1 mol⋅L
的NaOH溶液滴定10.00 mL 0.1 mol⋅L 二元酸
二元酸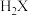 ,滴定过程中混合溶液的pH随滴加NaOH溶液的体积的变化曲线如图所示,下列说法正确的是
,滴定过程中混合溶液的pH随滴加NaOH溶液的体积的变化曲线如图所示,下列说法正确的是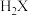 的电离常数
的电离常数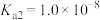 ;忽略混合时溶液体积变化。
;忽略混合时溶液体积变化。
 的NaOH溶液滴定10.00 mL 0.1 mol⋅L
的NaOH溶液滴定10.00 mL 0.1 mol⋅L 二元酸
二元酸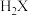 ,滴定过程中混合溶液的pH随滴加NaOH溶液的体积的变化曲线如图所示,下列说法正确的是
,滴定过程中混合溶液的pH随滴加NaOH溶液的体积的变化曲线如图所示,下列说法正确的是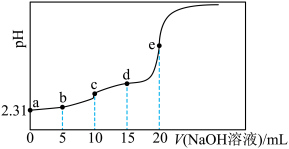
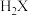 的电离常数
的电离常数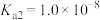 ;忽略混合时溶液体积变化。
;忽略混合时溶液体积变化。A. 的电离常数 的电离常数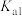 约为 约为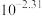 |
| B.e点溶液能使pH试纸变红 |
| C.c点水的电离程度比b点水的电离程度大 |
D.d点溶液中存在: mol⋅L mol⋅L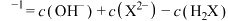 |
您最近一年使用:0次
多选题
|
较难
(0.4)
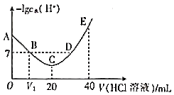
【推荐2】羟胺的电离方程式: (25℃时,
(25℃时, )。用0.1mol/L的盐酸滴定
)。用0.1mol/L的盐酸滴定 羟胺溶液,温度恒定为25℃时,滴定过程中由水电离出来的
羟胺溶液,温度恒定为25℃时,滴定过程中由水电离出来的 浓度的负对数与盐酸体积的关系如图所示(已知:
浓度的负对数与盐酸体积的关系如图所示(已知: )。下列说法错误的是
)。下列说法错误的是
 (25℃时,
(25℃时, )。用0.1mol/L的盐酸滴定
)。用0.1mol/L的盐酸滴定 羟胺溶液,温度恒定为25℃时,滴定过程中由水电离出来的
羟胺溶液,温度恒定为25℃时,滴定过程中由水电离出来的 浓度的负对数与盐酸体积的关系如图所示(已知:
浓度的负对数与盐酸体积的关系如图所示(已知: )。下列说法错误的是
)。下列说法错误的是
A.图中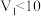 |
B.A点对应溶液的 |
| C.B、D两点对应的溶液的pH相等 |
D.C点对应溶液中存在: |
您最近一年使用:0次
多选题
|
较难
(0.4)
解题方法
【推荐1】在某温度时,将n mol·L-1氨水滴入10mL1.0mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法不正确的是
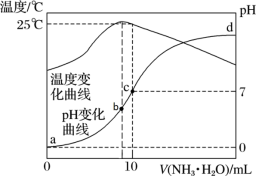

| A.当氨水滴加至c点时,两者恰好反应 |
B.c点的离子大小关系为:c(Cl-)=c(NH )>c(H+)=c(OH-) )>c(H+)=c(OH-) |
| C.水的电离程度:c>b>a |
D.25℃时,NH3•H2O的电离平衡常数为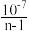 (用n表示) (用n表示) |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐2】常温下,一元酸HA的Ka(HA)=1.0×10-3。在某体系中, 与
与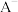 离子不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
离子不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
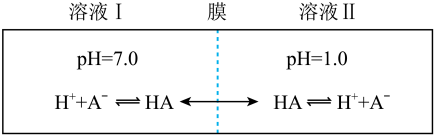
设溶液中 ,当达到平衡时,下列叙述正确的是
,当达到平衡时,下列叙述正确的是
 与
与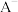 离子不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
离子不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
设溶液中
 ,当达到平衡时,下列叙述正确的是
,当达到平衡时,下列叙述正确的是A.溶液Ⅰ中 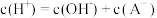 |
B.溶液Ⅱ中的HA的电离度 为 为 |
| C.溶液Ⅰ和Ⅱ中的c(HA)相等 |
D.溶液Ⅰ和Ⅱ中的 之比为10-4 之比为10-4 |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐3】H3AsO4是三元弱酸。室温下,向0.1mol∙L−1的H3AsO4溶液中滴加NaOH溶液调节pH。混合溶液中-lgX [表示-lg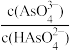 、-lg
、-lg 、-lg
、-lg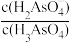 ]随溶液pH的变化如图所示。下列说法正确的是
]随溶液pH的变化如图所示。下列说法正确的是

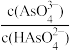 、-lg
、-lg 、-lg
、-lg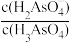 ]随溶液pH的变化如图所示。下列说法正确的是
]随溶液pH的变化如图所示。下列说法正确的是 
A.曲线a表示-lg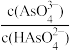 与溶液pH的关系 与溶液pH的关系 |
| B.常温下,H3AsO4的Ka3的数量级为10-11 |
C.随着pH的增大,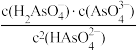 保持不变 保持不变 |
D.pH=7.00时,c(Na+)=3c(HAsO )+3c(AsO )+3c(AsO ) ) |
您最近一年使用:0次