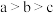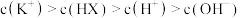羟胺的电离方程式: (25℃时,
(25℃时, )。用0.1mol/L的盐酸滴定
)。用0.1mol/L的盐酸滴定 羟胺溶液,温度恒定为25℃时,滴定过程中由水电离出来的
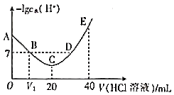
羟胺溶液,温度恒定为25℃时,滴定过程中由水电离出来的 浓度的负对数与盐酸体积的关系如图所示(已知:
浓度的负对数与盐酸体积的关系如图所示(已知: )。下列说法错误的是
)。下列说法错误的是
 (25℃时,
(25℃时, )。用0.1mol/L的盐酸滴定
)。用0.1mol/L的盐酸滴定 羟胺溶液,温度恒定为25℃时,滴定过程中由水电离出来的
羟胺溶液,温度恒定为25℃时,滴定过程中由水电离出来的 浓度的负对数与盐酸体积的关系如图所示(已知:
浓度的负对数与盐酸体积的关系如图所示(已知: )。下列说法错误的是
)。下列说法错误的是
A.图中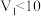 |
B.A点对应溶液的 |
| C.B、D两点对应的溶液的pH相等 |
D.C点对应溶液中存在: |
更新时间:2021-12-19 10:20:29
|
相似题推荐
多选题
|
较难
(0.4)
名校
解题方法
【推荐1】25℃时,用HCl气体调节 氨水的pH,体系中微粒浓度的对数值(lgc)与pH的关系如图1所示(a、b、c、d线分别对应体系中除
氨水的pH,体系中微粒浓度的对数值(lgc)与pH的关系如图1所示(a、b、c、d线分别对应体系中除 和
和 外的其它微粒),反应物的物质的量之比
外的其它微粒),反应物的物质的量之比 与pH的关系如图2所示(忽略通入气体后引起的溶液体积变化)。
与pH的关系如图2所示(忽略通入气体后引起的溶液体积变化)。

下列说法错误的是
 氨水的pH,体系中微粒浓度的对数值(lgc)与pH的关系如图1所示(a、b、c、d线分别对应体系中除
氨水的pH,体系中微粒浓度的对数值(lgc)与pH的关系如图1所示(a、b、c、d线分别对应体系中除 和
和 外的其它微粒),反应物的物质的量之比
外的其它微粒),反应物的物质的量之比 与pH的关系如图2所示(忽略通入气体后引起的溶液体积变化)。
与pH的关系如图2所示(忽略通入气体后引起的溶液体积变化)。
下列说法错误的是
A. 水解平衡常数的数量级为 水解平衡常数的数量级为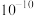 |
B.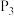 对应溶液; 对应溶液;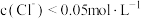 |
C.水的电离程度: |
D. 对应溶液: 对应溶液: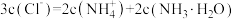 |
您最近一年使用:0次
多选题
|
较难
(0.4)
解题方法
【推荐2】已知草酸(H2C2O4)为二元弱酸,25℃时,Ka1(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5。用NaOH溶液滴定草酸氢钾(KHC2O4)溶液,混合溶液的相对导电能力随加入NaOH体积的变化如图所示(忽略混合时溶液温度的变化),其中N点为反应终点。下列有关描述中正确的是
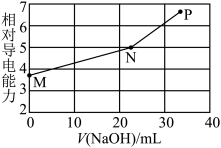

A.M点粒子浓度:c(K+)>c( )>c( )>c( )>c(H2C2O4) )>c(H2C2O4) |
B.N点时存在:c(Na+)+c(K+)<2c( )+2c( )+2c( ) ) |
C.从N点到P点的过程中溶液中一定存在:c(Na+)+c(H2C2O4)>c( ) ) |
| D.水的电离程度大小顺序:P>N>M |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐1】工业上常用 作沉淀剂除去废水中的
作沉淀剂除去废水中的 和
和 。通过调节溶液的pH可使
。通过调节溶液的pH可使 和
和 逐一沉降,处理过程中始终保持
逐一沉降,处理过程中始终保持 溶液为饱和状态即
溶液为饱和状态即 ,体系中
,体系中 、
、 、
、 、
、 浓度的负对数pM与pH的关系如图所示。
浓度的负对数pM与pH的关系如图所示。 (MnS)>
(MnS)> (ZnS),离子浓度
(ZnS),离子浓度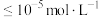 沉淀完全。下列说法错误的是
沉淀完全。下列说法错误的是
 作沉淀剂除去废水中的
作沉淀剂除去废水中的 和
和 。通过调节溶液的pH可使
。通过调节溶液的pH可使 和
和 逐一沉降,处理过程中始终保持
逐一沉降,处理过程中始终保持 溶液为饱和状态即
溶液为饱和状态即 ,体系中
,体系中 、
、 、
、 、
、 浓度的负对数pM与pH的关系如图所示。
浓度的负对数pM与pH的关系如图所示。
 (MnS)>
(MnS)> (ZnS),离子浓度
(ZnS),离子浓度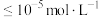 沉淀完全。下列说法错误的是
沉淀完全。下列说法错误的是A.III表示 与pH的关系曲线 与pH的关系曲线 |
B. |
C. |
D.溶液中 和 和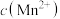 均为0.1 均为0.1 , , 完全沉淀时溶液的最小pH为7.6 完全沉淀时溶液的最小pH为7.6 |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
解题方法
【推荐2】常温常压下,有关下列各溶液的描述中正确的是
A.25℃时,若测得 溶液 溶液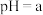 ,取该溶液10 ,取该溶液10 ,加入一定量水,测得混合溶液体积为100 ,加入一定量水,测得混合溶液体积为100 ,混合后溶液的 ,混合后溶液的 ,则 ,则 是弱酸 是弱酸 |
B.浓度均为0.1 的 的 、 、 混合溶液中: 混合溶液中: ,且 ,且 |
C.一定浓度的氨水加水稀释的过程中, 的比值和 的比值和 的比值均增大 的比值均增大 |
D. 的醋酸钠溶液与 的醋酸钠溶液与 盐酸溶液混合后溶液显酸性,则溶液中有关微粒的浓度关系为: 盐酸溶液混合后溶液显酸性,则溶液中有关微粒的浓度关系为: |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
解题方法
【推荐3】室温下,H2SeO3水溶液中含硒的各物种的分布系数δ(平衡时某物种的浓度占各物种浓度之和的分数)随pH变化如图所示,下列说法正确的是( )


| A.C点pH为5.47 |
B.0.1mol·L-1的H2SeO3溶液中:c(H+)=2[c( )+c( )+c(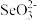 )+c(H2SeO3)] )+c(H2SeO3)] |
C.0.1mol·L-1的NaHSeO3溶液中(pH<7):c(Na+)>c( )>c( )>c(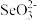 )>c(H2SeO3) )>c(H2SeO3) |
D.向1L含H2SeO3和NaHSeO3的浓度均为1mol·L-1的溶液中,加入1L2mol·L-1NaOH溶液,所得溶液中:c( )+3c(H2SeO3)>c( )+3c(H2SeO3)>c(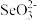 )+2c(OH-) )+2c(OH-) |
您最近一年使用:0次
多选题
|
较难
(0.4)
解题方法
【推荐1】室温下,向10mL浓度均为0.1mol/L的CuCl2、FeCl2和ZnCl2溶液中分别滴加等浓度的Na2S溶液,滴加过程中pc[pc=-lgc(M2+),M2+为Cu2+或Fe2+或Zn2+]与Na2S溶液体积的关系如图所示。已知:Ksp(CuS)<Ksp(ZnS),Ksp(FeS)=6.25×10-18,lg25=1.4。下列说法正确的是
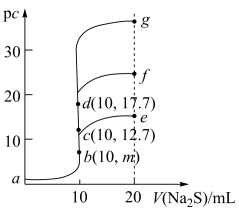

| A.m=8.6 |
| B.a点的CuCl2溶液中:2c(Cu2+)>c(Cl−)+c(OH−) |
| C.a→d→g的过程中,水的电离程度经历由大到小后又增大的过程 |
| D.将足量晶体ZnCl2加入0.1mol/L的Na2S溶液中,c(Zn2+)最大可达到10−24.4mol·L−1 |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐2】25℃时,向10 mL 0.1 mol·L-1 CH3COONa溶液中加入0.1 mol·L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示。下列说法正确的是


| A.点①所示溶液中:c(OH-)=c(H+)+c(CH3COOH) |
| B.点②所示溶液中:c(CH3COOH)+c(CH3COO-)=0.05 mol·L-1 |
| C.点③所示溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| D.点④所示溶液中:c(Na+)+c(H+)<c(CH3COO-)+c(Cl-) |
您最近一年使用:0次

 酸性强于HIO.向等浓度等体积的
酸性强于HIO.向等浓度等体积的 随
随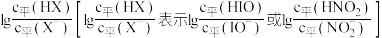 的变化情况如图所示,下列说法错误的是(
的变化情况如图所示,下列说法错误的是(
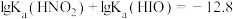

 的电离程度:
的电离程度: