山东省东营市2022-2023学年高二上学期期末考试化学试题
山东
高二
期末
2023-03-02
497次
整体难度:
适中
考查范围:
常见无机物及其应用、物质结构与性质、化学反应原理、认识化学科学、化学实验基础
山东省东营市2022-2023学年高二上学期期末考试化学试题
山东
高二
期末
2023-03-02
497次
整体难度:
适中
考查范围:
常见无机物及其应用、物质结构与性质、化学反应原理、认识化学科学、化学实验基础
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
1. 从科技前沿到日常生活,化学无处不在。下列说法错误的是
| A.我国首次在实验室实现了二氧化碳到淀粉的合成,生物酶催化剂的使用改变了反应历程 |
B.神舟十三号顺利升空时,火箭尾部喷射的气体呈红棕色是因为部分助燃剂 转化为 转化为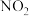 |
| C.水是21世纪最宝贵的资源之一,明矾与高铁酸钾均可作水处理剂,两者处理水的原理相同 |
D.2022年北京冬奥会将采用石墨烯材料制造户外保暖穿戴设备,石墨烯中碳原子为 杂化 杂化 |
您最近一年使用:0次
2022-01-17更新
|
570次组卷
|
4卷引用:山东省济南市2021-2022上学期高二上学期期末考试化学试题
单选题
|
适中(0.65)
解题方法
2. 已知 溶液呈碱性。向
溶液呈碱性。向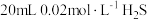 溶液中加入以下物质,下列说法正确的是
溶液中加入以下物质,下列说法正确的是
 溶液呈碱性。向
溶液呈碱性。向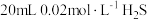 溶液中加入以下物质,下列说法正确的是
溶液中加入以下物质,下列说法正确的是A.加入水, 电离程度增大, 电离程度增大, 浓度增大 浓度增大 |
B.加入 固体,平衡右移, 固体,平衡右移, 浓度增大,K增大 浓度增大,K增大 |
C.向溶液中通入足量 气体, 气体, 电离平衡左移, 电离平衡左移, 先增大后减小 先增大后减小 |
D.加入等体积等物质的量浓度的 溶液,溶液中存在 溶液,溶液中存在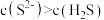 |
【知识点】 弱电解质电离平衡的影响因素 盐溶液中离子浓度大小的比较解读
您最近一年使用:0次
2022-02-03更新
|
255次组卷
|
3卷引用:山东省青岛市黄岛区2021-2022学年高二上学期期末考试化学试题
单选题
|
适中(0.65)
解题方法
3. 下列微粒表述正确,且对水的电离不能产生影响的是
A.氢氧化钠的电子式: | B.乙酸的结构式: |
C.甲烷分子的空间填充模型: | D.硫离子的结构示意图: |
您最近一年使用:0次
4. 关于如图所示各装置的叙述正确的是

A.图1是化学能转变为电能的装置,总反应为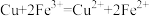 |
B.图2铁钉发生吸氧腐蚀,导管中水面上升,负极反应为 |
C.图3装置可在铁件表面镀铜, 溶液浓度不变 溶液浓度不变 |
| D.图4支撑海港码头基础的钢管桩与电源的负极相连,以防止被海水腐蚀 |
【知识点】 金属的电化学腐蚀与防护 电解原理的应用
您最近一年使用:0次
2022-02-03更新
|
892次组卷
|
13卷引用:山东省青岛市黄岛区2021-2022学年高二上学期期末考试化学试题
山东省青岛市黄岛区2021-2022学年高二上学期期末考试化学试题山东省青岛市4区县2021-2022学年高二上学期期末考试化学试题山东省临沂第一中学2021-2022学年高二上学期期末检测化学试题山东省临沂第一中学2022-2023学年高二上学期期末考试化学试题福建省莆田第一中学2022-2023学年高二上学期期末考试化学试题山东省东营市2022-2023学年高二上学期期末考试化学试题四川省仁寿第一中学校南校区2022—2023学年高二下学期3月月考化学试题江苏省徐州市铜山区2022-2023学年高二下学期期中考试化学试题浙江省宁波市奉化区2023-2024学年高二上学期期末检测化学试题湖南省 邵阳市第二中学2023-2024学年高二上学期1月期末化学试题河北省石家庄市辛集市2023-2024学年高二上学期2月期末考试化学试题山东省实验中学2023-2024学年高二上学期1月月考化学试题新疆维吾尔自治区喀什市第十四中学2023-2024学年高二上学期1月期末质量检测化学试题
单选题
|
适中(0.65)
5. 用纯碱溶液去除铝制容器表面的油污时,有少量气泡产生。为探究气泡产生的原因设计了如下实验:①将铝片置于盛有水的试管中,加热,无明显现象;②将铝片置于盛有浓 溶液的试管中,铝片表面产生细小气泡,加热,产生大量气泡(成分为
溶液的试管中,铝片表面产生细小气泡,加热,产生大量气泡(成分为 和
和 ),并观察到白色浑浊(能溶于
),并观察到白色浑浊(能溶于 溶液)。下列说法错误的是
溶液)。下列说法错误的是
 溶液的试管中,铝片表面产生细小气泡,加热,产生大量气泡(成分为
溶液的试管中,铝片表面产生细小气泡,加热,产生大量气泡(成分为 和
和 ),并观察到白色浑浊(能溶于
),并观察到白色浑浊(能溶于 溶液)。下列说法错误的是
溶液)。下列说法错误的是| A.纯碱去除油污利用了水解原理,加热可以提高油污去除效果 |
B.铝片与 水解产生的 水解产生的 反应生成了 反应生成了 |
C.浑浊产生的原理为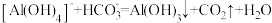 |
D.加热和 的产生对 的产生对 水解平衡移动方向的影响是相同的 水解平衡移动方向的影响是相同的 |
您最近一年使用:0次
2022-02-03更新
|
251次组卷
|
3卷引用:山东省青岛市黄岛区2021-2022学年高二上学期期末考试化学试题
单选题
|
适中(0.65)
名校
6. 锂电池的研究与开发已日臻成熟,某锂电池材料的组成与结构如图。M、W、X、Y、Z是原子序数依次增大的同周期主族元素,Y元素原子的价电子数是W的两倍。下列说法错误的是
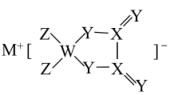
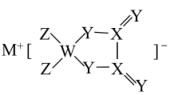
| A.该材料中元素原子均达到8电子稳定结构 | B.该材料中X的化合价为 |
| C.元素X与Y原子轨道中含有的未成对电子数相同 | D.简单离子半径为 |
【知识点】 元素周期律、元素周期表的推断 基态核外电子排布规律
您最近一年使用:0次
2022-02-03更新
|
711次组卷
|
4卷引用:山东省青岛市黄岛区2021-2022学年高二上学期期末考试化学试题
单选题
|
适中(0.65)
解题方法
7. 下列表示对应化学反应的离子方程式正确的是
A.用石墨电极电解饱和食盐水: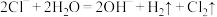 |
B.向稀 中加入过量 中加入过量 溶液: 溶液: |
C.用 溶液预处理水垢中的 溶液预处理水垢中的 : : |
D.向稀 中滴加 中滴加 溶液: 溶液: |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
8. 部分短周期元素电负性的相对大小、最高正价或最低负价随原子序数的变化关系如图所示。下列说法正确的是
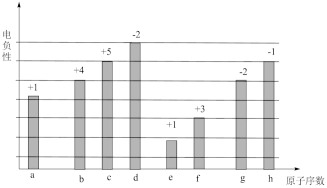
| A.上述8种元素均位于元素周期表p区 |
B.g、h的氧化物对应水化物的酸性: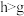 |
| C.b、c、d三种元素的简单气态氢化物热稳定性逐渐增强 |
| D.c的气态氢化物与其最高价含氧酸反应的产物为共价化合物 |
您最近一年使用:0次
2022-02-03更新
|
393次组卷
|
4卷引用:山东省青岛市黄岛区2021-2022学年高二上学期期末考试化学试题
单选题
|
较易(0.85)
解题方法
9. 下列说法错误的是
| A.基态原子的p能级上半充满的元素一定位于p区 |
| B.核外电子排布相同的两原子,一定属于同种元素 |
| C.基态原子的价电子排布为(n−1)dxnsy的元素,族序数一定为x+y |
| D.基态原子的N层上只有一个电子的元素,不一定是第ⅠA族元素 |
您最近一年使用:0次
2022-01-24更新
|
480次组卷
|
2卷引用:山东省烟台市2021-2022学年高二上学期期末考试化学试题
单选题
|
适中(0.65)
名校
解题方法
10. 纯碱在工业上主要用于玻璃制品和陶瓷釉的生产。以NaCl和NH4HCO3为原料制备纯碱的过程如下,下列说法错误的是
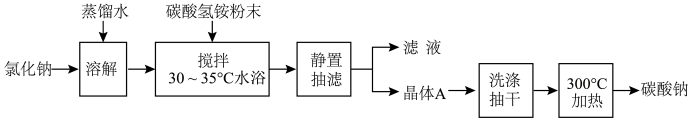

A.“搅拌”中主要发生的化学反应为 |
| B.若其它条件不变,使用饱和氯化钠溶液可以达到提高碳酸氢铵利用率的目的 |
C.搅拌时采用 水浴,以防止温度过高引起碳酸氢铵和碳酸氢钠的分解 水浴,以防止温度过高引起碳酸氢铵和碳酸氢钠的分解 |
D.静置抽滤所得滤液中离子浓度大小关系为 |
您最近一年使用:0次
2022-02-03更新
|
394次组卷
|
7卷引用:山东省青岛市黄岛区2021-2022学年高二上学期期末考试化学试题
单选题
|
适中(0.65)
解题方法
11. 下列实验内容的解释正确的是
| 实验内容 | 解释 | |
| A | 相同温度下,用pH传感器测定 和 和 饱和溶液的pH,后者pH大 饱和溶液的pH,后者pH大 | 酸性: |
| B | 向 溶液中加入过量的KI溶液,充分反应后,再滴入几滴KSCN溶液,溶液颜色变红 溶液中加入过量的KI溶液,充分反应后,再滴入几滴KSCN溶液,溶液颜色变红 | KI与的反应为可逆反应 |
| C | 向10mL 0.2  NaOH溶液中滴入2滴0.1 NaOH溶液中滴入2滴0.1  溶液,产生白色沉淀后,再滴加2滴0.1 溶液,产生白色沉淀后,再滴加2滴0.1  溶液,又生成红褐色沉淀 溶液,又生成红褐色沉淀 | 在相同温度下的 : : |
| D | 向含有酚酞的 溶液中滴入 溶液中滴入 溶液,观察溶液颜色的变化 溶液,观察溶液颜色的变化 | 证明 溶液中存在水解平衡 溶液中存在水解平衡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
二、多选题 添加题型下试题
多选题
|
适中(0.65)
解题方法
12. 化学家正在研究尿素燃料电池,尿素燃料电池结构如图所示,用这种电池直接去除城市废水中的尿素,下列有关描述正确的是


| A.甲电极为电池的正极 |
B.乙电极的电极反应式为: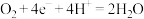 |
| C.电池工作时氢离子向甲电极移动 |
D.D.电池工作时,理论上净化1mol 消耗标准状况下33.6L 消耗标准状况下33.6L 浓度的废水 浓度的废水 |
您最近一年使用:0次
13. 甲醇是重要的化工原料。科技工作者利用CH4、O2按照一定体积比在催化剂表面合成甲醇的反应,部分历程如下图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态,H2O的作用是活化催化剂)。下列说法错误的是
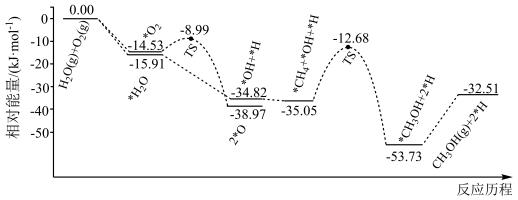

A.在催化剂表面上更容易被吸附的是 |
B. |
C.该反应过程的决速步为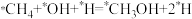 |
| D.适时将甲醇分离出来,以空出催化剂活性中心继续使用 |
您最近一年使用:0次
2022-02-03更新
|
533次组卷
|
5卷引用:山东省青岛市黄岛区2021-2022学年高二上学期期末考试化学试题
三、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
14. 氢气是合成氨的重要原料,合成氨反应的热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ· mol-1,当该反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率随时间的变化关系如图所示,下列说法正确的是
2NH3(g) ΔH=-92.4 kJ· mol-1,当该反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率随时间的变化关系如图所示,下列说法正确的是
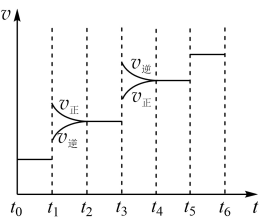
 2NH3(g) ΔH=-92.4 kJ· mol-1,当该反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率随时间的变化关系如图所示,下列说法正确的是
2NH3(g) ΔH=-92.4 kJ· mol-1,当该反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率随时间的变化关系如图所示,下列说法正确的是
| A.图中t1时刻引起平衡移动的条件可能是升高温度 |
| B.表示平衡混合物中NH3的含量最高的一段时间是t5~t6 |
C.温度为T℃时,将2a mol H2和a mol N2充入0.5 L密闭容器中,充分反应后N2的转化率为50%,则该温度时反应的平衡常数为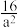 |
| D.在t2~t3时间段,保持容器容积不变,充入一定量的惰性气体,N2的浓度不变 |
您最近一年使用:0次
2021-07-28更新
|
588次组卷
|
4卷引用:广东省揭阳市揭西县河婆中学2020-2021学年高二下学期第一次月考化学试题
广东省揭阳市揭西县河婆中学2020-2021学年高二下学期第一次月考化学试题(已下线)2.2.2 影响化学平衡的因素-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)周末培优1 化学反应速率与化学平衡图像问题-2021-2022学年高二化学课后培优练(人教版选修4)山东省东营市2022-2023学年高二上学期期末考试化学试题
四、多选题 添加题型下试题
多选题
|
较难(0.4)
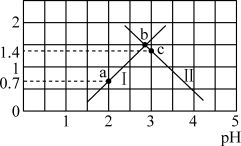
15. 草酸 是二元弱酸,常温下,用NaOH溶液滴定草酸溶液,溶液中
是二元弱酸,常温下,用NaOH溶液滴定草酸溶液,溶液中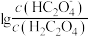 或
或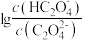 与混合溶液pH关系如图所示。下列说法错误的是
与混合溶液pH关系如图所示。下列说法错误的是
 是二元弱酸,常温下,用NaOH溶液滴定草酸溶液,溶液中
是二元弱酸,常温下,用NaOH溶液滴定草酸溶液,溶液中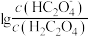 或
或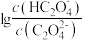 与混合溶液pH关系如图所示。下列说法错误的是
与混合溶液pH关系如图所示。下列说法错误的是
A.曲线Ⅰ为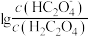 随溶液pH的变化曲线 随溶液pH的变化曲线 |
B.b点时,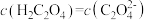 |
C.常温下,草酸的电离常数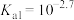 , ,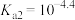 |
| D.a、b、c三点,水的电离程度先增大后减小 |
【知识点】 影响水电离的因素解读 弱电解质的电离平衡常数
您最近一年使用:0次
2022-01-21更新
|
460次组卷
|
3卷引用:山东省日照市2021-2022学年高二上学期期末考试化学试题
五、解答题 添加题型下试题
解答题-无机推断题
|
适中(0.65)
16. A、B、C、D、E、F为6种原子序数依次增大的前36号元素,其性质或结构信息如下表。
回答下列问题:
(1)A基态原子中能量最高的电子,其电子云在空间有_______ 个伸展方向,该原子轨道的形状为_______ 。
(2)A、B、C三种元素第一电离能由大到小的顺序为_______ 用元素符号表示)。
(3)D基态原子的电子排布式为_______ ,其电子的空间运动状态有_______ 种。
(4)E元素位于元素周期表中的_______ 区,其基态原子的成对电子数与未成对电子数之比为_______ 。
回答下列问题:
| 元素 | 性质或结构信息 |
| A | 该元素形成的化合物种类最多 |
| B | 原子核外p轨道电子为半满 |
| C | 地壳中元素含量最高的元素 |
| D | 前四周期中,轨道未成对电子数最多的元素 |
| E | 位于元素周期表第8列 |
(2)A、B、C三种元素第一电离能由大到小的顺序为
(3)D基态原子的电子排布式为
(4)E元素位于元素周期表中的
您最近一年使用:0次
六、填空题 添加题型下试题
填空题
|
适中(0.65)
17. 二氧化氯是一种安全稳定、高效低毒的消毒剂,工业上有多种制备方法。回答下列问题:
法一:亚氯酸钠与氯气反应 ,氯气可通过氯碱工业制得,装置如图1。
,氯气可通过氯碱工业制得,装置如图1。
(1)气体M是___________ ,P是___________ (填“阳”或“阴”)离子交换膜。
(2)写出图1总反应的化学方程式___________ 。

法二:惰性电极电解氯化铵和盐酸,原理如图2。
(3)b为电源的___________ 极,气体X是___________ 。
(4)c的电极反应式为___________ 。
(5)已知二氧化氯发生器内,氧化剂与还原剂的物质的量之比为1∶6,写出该反应离子方程式___________ 。
(6)当有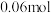 阴离子通过离子交换膜时,产生二氧化氯(
阴离子通过离子交换膜时,产生二氧化氯( )体积为
)体积为___________ L。
法一:亚氯酸钠与氯气反应
 ,氯气可通过氯碱工业制得,装置如图1。
,氯气可通过氯碱工业制得,装置如图1。(1)气体M是
(2)写出图1总反应的化学方程式

法二:惰性电极电解氯化铵和盐酸,原理如图2。
(3)b为电源的
(4)c的电极反应式为
(5)已知二氧化氯发生器内,氧化剂与还原剂的物质的量之比为1∶6,写出该反应离子方程式
(6)当有
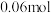 阴离子通过离子交换膜时,产生二氧化氯(
阴离子通过离子交换膜时,产生二氧化氯( )体积为
)体积为
您最近一年使用:0次
2022-02-15更新
|
582次组卷
|
3卷引用:山东省青岛市黄岛区2021-2022学年高二上学期期末考试化学试题
七、解答题 添加题型下试题
解答题-实验探究题
|
较难(0.4)
解题方法
18. 酸碱滴定法为重要的定量分析法,应用广泛。
回答下列问题:
选择酚酞作指示剂,用标准NaOH溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:
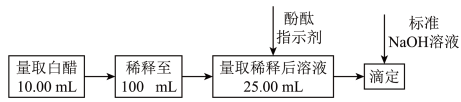
已知:国家标准规定酿造白醋中醋酸含量不得低于0.035 。
。
(1)①滴定达到终点时的现象是滴入半滴标准NaOH溶液后_______ 。
②某次实验滴定开始和结束时。碱式滴定管中的液面如图所示,则消耗NaOH溶液的体积为_______ mL。
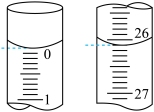
③已知实验所用标准NaOH溶液的浓度为0.0600 ,根据上述滴定结果可知该白醋
,根据上述滴定结果可知该白醋_______ (填“符合”或“不符合”)国家标准。
④下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是_______ (填编号)。
A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中摇动锥形瓶时有液滴溅出
D.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
E.碱式滴定管在滴定前有气泡,滴定后气泡消失
(2)若用0.1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1
NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 的盐酸和醋酸溶液,得到滴定过程中pH随加入NaOH溶液体积而变化的两条滴定曲线如图所示。
的盐酸和醋酸溶液,得到滴定过程中pH随加入NaOH溶液体积而变化的两条滴定曲线如图所示。
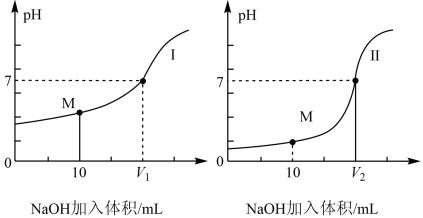
①滴定醋酸的曲线是_______ (填“Ⅰ”或“Ⅱ”)。
② 和
和 的关系:
的关系:
_______  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
③若25℃时,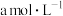 的醋酸与0.01
的醋酸与0.01  的氢氧化钠溶液等体积混合呈中性,则醋酸的电离常数为
的氢氧化钠溶液等体积混合呈中性,则醋酸的电离常数为_______ (用含a的代数式表示)。
回答下列问题:
选择酚酞作指示剂,用标准NaOH溶液测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。测定过程如图所示:

已知:国家标准规定酿造白醋中醋酸含量不得低于0.035
 。
。(1)①滴定达到终点时的现象是滴入半滴标准NaOH溶液后
②某次实验滴定开始和结束时。碱式滴定管中的液面如图所示,则消耗NaOH溶液的体积为

③已知实验所用标准NaOH溶液的浓度为0.0600
 ,根据上述滴定结果可知该白醋
,根据上述滴定结果可知该白醋④下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是
A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定过程中摇动锥形瓶时有液滴溅出
D.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
E.碱式滴定管在滴定前有气泡,滴定后气泡消失
(2)若用0.1
 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1
NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 的盐酸和醋酸溶液,得到滴定过程中pH随加入NaOH溶液体积而变化的两条滴定曲线如图所示。
的盐酸和醋酸溶液,得到滴定过程中pH随加入NaOH溶液体积而变化的两条滴定曲线如图所示。
①滴定醋酸的曲线是
②
 和
和 的关系:
的关系:
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。③若25℃时,
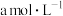 的醋酸与0.01
的醋酸与0.01  的氢氧化钠溶液等体积混合呈中性,则醋酸的电离常数为
的氢氧化钠溶液等体积混合呈中性,则醋酸的电离常数为
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
名校
19. 合理利用工厂烟灰,变废为宝,对保护环境具有重要意义。以某钢铁厂烟灰(主要成分为 ,并含少量的
,并含少量的 、
、 、
、 )为原料制备氧化锌的工艺流程如下:
)为原料制备氧化锌的工艺流程如下:

已知:①“浸取”时, 转化为可溶性
转化为可溶性 离子,
离子, 转化为可溶性
转化为可溶性 离子;②常温下,
离子;②常温下,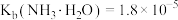 ,
,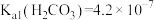 ,
,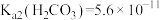 。
。
回答下列问题:
(1) 在周期表中的位置为
在周期表中的位置为_______ ,其基态原子价层电子轨道表示式为_______ 。
(2) 所含元素的电负性由大到小的顺序为
所含元素的电负性由大到小的顺序为_______ ,“浸取”时加入的 溶液显
溶液显_______ (填“酸性”、“碱性”或“中性”)。
(3)“除杂”加入过量锌粉发生的离子方程式为_______ ;“冷凝吸收”过程中通入过量 ,发生反应的离子方程式为:
,发生反应的离子方程式为:_______ 。
(4)常温下二价锌在水溶液中的存在形式与 的关系如图,横坐标为溶液的
的关系如图,横坐标为溶液的 ,纵坐标为
,纵坐标为 或
或 物质的量浓度的对数(假设
物质的量浓度的对数(假设 离子浓度
离子浓度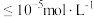 时,
时, 离子已沉淀完全)。从图中数据计算可得
离子已沉淀完全)。从图中数据计算可得 的溶度积
的溶度积
_______ ,某废液中含 离子,为沉淀
离子,为沉淀 离子可以控制溶液中
离子可以控制溶液中 值的范围是
值的范围是_______ 。

 ,并含少量的
,并含少量的 、
、 、
、 )为原料制备氧化锌的工艺流程如下:
)为原料制备氧化锌的工艺流程如下:
已知:①“浸取”时,
 转化为可溶性
转化为可溶性 离子,
离子, 转化为可溶性
转化为可溶性 离子;②常温下,
离子;②常温下,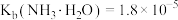 ,
,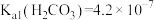 ,
,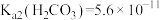 。
。回答下列问题:
(1)
 在周期表中的位置为
在周期表中的位置为(2)
 所含元素的电负性由大到小的顺序为
所含元素的电负性由大到小的顺序为 溶液显
溶液显(3)“除杂”加入过量锌粉发生的离子方程式为
 ,发生反应的离子方程式为:
,发生反应的离子方程式为:(4)常温下二价锌在水溶液中的存在形式与
 的关系如图,横坐标为溶液的
的关系如图,横坐标为溶液的 ,纵坐标为
,纵坐标为 或
或 物质的量浓度的对数(假设
物质的量浓度的对数(假设 离子浓度
离子浓度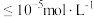 时,
时, 离子已沉淀完全)。从图中数据计算可得
离子已沉淀完全)。从图中数据计算可得 的溶度积
的溶度积
 离子,为沉淀
离子,为沉淀 离子可以控制溶液中
离子可以控制溶液中 值的范围是
值的范围是
您最近一年使用:0次
2022-01-27更新
|
443次组卷
|
3卷引用:山东省济宁市2021-2022学年高二上学期期末考试化学试题
20. 氮及其化合物与人们的生活息息相关。回答下列问题:
I.(1)已知:①CO 的燃烧热∆H1=-283 kJ·mol−1
②N2(g)+O2(g)=2NO(g) ∆H2=+183 kJ·mol−1
①写出 NO 和 CO 反应生成无污染性气体的热化学反应方程式_________________ 。
②一定条件下当 NO 与 CO 的反应达到平衡后,既能提高反应速率又能提高 NO 转化率的措施有______ (填 字母序号)。
a.压缩反应器体积 b.使用更高效催化剂 c.升高反反应温度 d.增大CO的浓度
(2)一定条件下在容积为8L的密闭容器中充入10molCO 和 8molNO,若反应进行到 20 min 时达到平衡状态,测得平衡体系压强为 8 MPaNO 的的体积分数为25%,则NO的转化率=________ ;用 CO2 浓度变化表示的平均反应速率 v(CO2)=_______ ;该温度下平衡常数 Kp=______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;保留两位有效数字)。
II.用电解法可除去硝酸工业产生的尾气NO,并得到 NH4NO3,工作原理如下图。
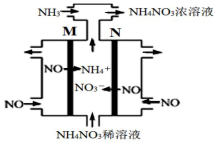
(1)N 极应连接电源的______ (填“正极”或“负极”);M 极的电极反应式为________ 。
(2)理论上通入NO与NH3 的最佳物质的量之比为________ 。
I.(1)已知:①CO 的燃烧热∆H1=-283 kJ·mol−1
②N2(g)+O2(g)=2NO(g) ∆H2=+183 kJ·mol−1
①写出 NO 和 CO 反应生成无污染性气体的热化学反应方程式
②一定条件下当 NO 与 CO 的反应达到平衡后,既能提高反应速率又能提高 NO 转化率的措施有
a.压缩反应器体积 b.使用更高效催化剂 c.升高反反应温度 d.增大CO的浓度
(2)一定条件下在容积为8L的密闭容器中充入10molCO 和 8molNO,若反应进行到 20 min 时达到平衡状态,测得平衡体系压强为 8 MPaNO 的的体积分数为25%,则NO的转化率=
II.用电解法可除去硝酸工业产生的尾气NO,并得到 NH4NO3,工作原理如下图。

(1)N 极应连接电源的
(2)理论上通入NO与NH3 的最佳物质的量之比为
您最近一年使用:0次
2018-12-07更新
|
296次组卷
|
4卷引用:【市级联考】湖南省怀化市2019届高三上学期期中新博览联考化学试题
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、物质结构与性质、化学反应原理、认识化学科学、化学实验基础
试卷题型(共 20题)
题型
数量
单选题
12
多选题
3
解答题
4
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 明矾的净水作用及原理 利用杂化轨道理论判断化学键杂化类型 | |
| 2 | 0.65 | 弱电解质电离平衡的影响因素 盐溶液中离子浓度大小的比较 | |
| 3 | 0.65 | 原子结构示意图、离子结构示意图 有机物的结构式、结构简式、比例模型、球棍模型、最简式 共价型分子结构式、电子式 影响水电离的因素 | |
| 4 | 0.85 | 金属的电化学腐蚀与防护 电解原理的应用 | |
| 5 | 0.65 | 铝与强碱溶液反应 盐类水解的应用 盐类双水解反应 | |
| 6 | 0.65 | 元素周期律、元素周期表的推断 基态核外电子排布规律 | |
| 7 | 0.65 | 离子方程式的书写 离子方程式的正误判断 沉淀转化 氯碱工业 | |
| 8 | 0.65 | 元素金属性与非金属性递变规律的理解及应用 元素非金属性强弱的比较方法 由元素性质的递变规律进行相关推断 元素性质与电负性的关系 | |
| 9 | 0.85 | 元素周期表结构 元素周期表结构分析 元素周期表提供的元素信息 核外电子排布的表示形式 | |
| 10 | 0.65 | 碳酸氢钠的不稳定性 盐溶液中离子浓度大小的比较 物质分离、提纯综合应用 常见无机物的制备 | |
| 11 | 0.65 | 可逆反应及反应限度 弱电解质的电离平衡 盐类水解规律理解及应用 盐溶液中离子浓度大小的比较 | |
| 14 | 0.65 | 外界条件对化学平衡影响的图像 化学反应速率与化学平衡的综合应用 | |
| 二、多选题 | |||
| 12 | 0.65 | 原电池电子流向判断及应用 原电池正负极判断 原电池电极反应式书写 原电池原理的综合应用 | |
| 13 | 0.65 | 碰撞理论及活化能 活化能及其对反应速率的影响 催化剂对化学反应速率的影响 | |
| 15 | 0.4 | 影响水电离的因素 弱电解质的电离平衡常数 | |
| 三、解答题 | |||
| 16 | 0.65 | 由元素性质的递变规律进行相关推断 根据原子结构进行元素种类推断 电子排布式 轨道表示式 | 无机推断题 |
| 18 | 0.4 | 酸碱中和滴定原理的应用 酸碱中和滴定的误差分析 酸碱中和滴定的综合考查 | 实验探究题 |
| 19 | 0.65 | 盐类水解规律理解及应用 溶度积常数相关计算 元素性质与电负性的关系 | 工业流程题 |
| 20 | 0.65 | 盖斯定律的应用 影响化学反应速率的外因 化学平衡常数的有关计算 电解原理的理解及判断 | 原理综合题 |
| 四、填空题 | |||
| 17 | 0.65 | 电解原理的应用 氯碱工业 电解池有关计算 | |



