某工厂利用制革工业污泥[含Cr(III)]制取CrOH(H2O)5SO4的工艺流程如下:
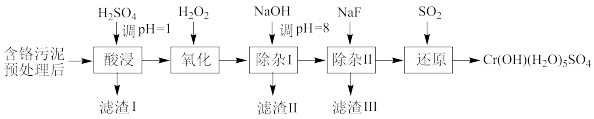
已知:酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+等。
(1)酸浸时,为了提高浸取率可采取的措施有_______ 。
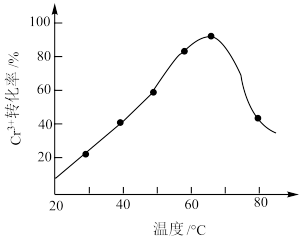
(2)H2O2的作用是将滤液中的Cr3+转化为Cr2O ,控制其他条件不变,在相同时间内,测得温度对Cr3+转化率的影响如图所示。请分析温度超过70°C时,Cr3+转化率下降的原因是
,控制其他条件不变,在相同时间内,测得温度对Cr3+转化率的影响如图所示。请分析温度超过70°C时,Cr3+转化率下降的原因是_______ 。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
①滤渣II的主要成分为_______ (填化学式)。
②用NaOH调节溶液的pH不能超过8,其理由是_______ 。
(4)在“除杂II”中,当溶液中镁离子和钙离子沉淀完全时,所得溶液中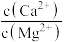 =
=_______ 。(已知:Ksp(CaF2)=1.48×10-10,Ksp(MgF2)=7.40×10-11)
(5)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O 气转化为CrO
气转化为CrO ,写出上述流程中的“还原”过程生成CrOH(H2O)5SO4沉淀的离子方程式
,写出上述流程中的“还原”过程生成CrOH(H2O)5SO4沉淀的离子方程式_______ 。

已知:酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+等。
(1)酸浸时,为了提高浸取率可采取的措施有
(2)H2O2的作用是将滤液中的Cr3+转化为Cr2O
 ,控制其他条件不变,在相同时间内,测得温度对Cr3+转化率的影响如图所示。请分析温度超过70°C时,Cr3+转化率下降的原因是
,控制其他条件不变,在相同时间内,测得温度对Cr3+转化率的影响如图所示。请分析温度超过70°C时,Cr3+转化率下降的原因是
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Al3+ | Mg2+ | Ca2+ |
| 开始沉淀时的pH | 1.5 | 3.4 | 8.9 | 11.9 |
| 沉淀完全时的pH | 2.8 | 4.7(>8溶解) | 10.9 | 14 |
②用NaOH调节溶液的pH不能超过8,其理由是
(4)在“除杂II”中,当溶液中镁离子和钙离子沉淀完全时,所得溶液中
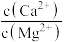 =
=(5)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O
 气转化为CrO
气转化为CrO ,写出上述流程中的“还原”过程生成CrOH(H2O)5SO4沉淀的离子方程式
,写出上述流程中的“还原”过程生成CrOH(H2O)5SO4沉淀的离子方程式
更新时间:2022-01-23 19:18:42
|
相似题推荐
【推荐1】工业废水中的氨氮(以 、
、 形式存在),可通过微生物法或氧化法处理为
形式存在),可通过微生物法或氧化法处理为 ,使水中氨氮达到国家规定的排放标准。
,使水中氨氮达到国家规定的排放标准。
(1)微生物法:酸性废水中的部分 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 ,
, 再与
再与 作用生成
作用生成 。
。
① 转化为
转化为 的离子方程式为
的离子方程式为_______ 。
②1mol 至多可处理
至多可处理 的物质的量为
的物质的量为_______ 。
(2)次氯酸钠氧化法:向氨氮废水中加入NaClO,氨氮转化为 而除去。
而除去。
①NaClO氧化 的离子方程式为
的离子方程式为_______ 。
②一定pH下,NaClO的投加量对污水中氨氮去除率的影响如图所示。当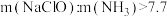 时,总氮的去除率随
时,总氮的去除率随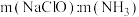 的增大不升反降的可能原因是
的增大不升反降的可能原因是_______ 。
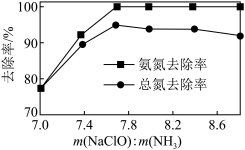
(3)活性炭-臭氧氧化法:碱性环境下活性炭-臭氧氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,·OH为羟基自由基,其氧化性比 更强。
更强。
①活性炭-臭氧氧化氨氮的机理可描述为_______ 。
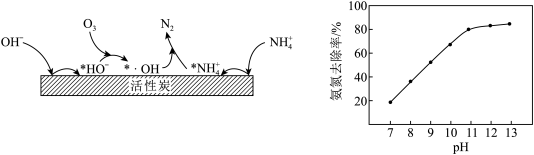
②其它条件不变调节废水的pH,废水中氨氮去除率随pH的变化如图所示。随pH增大氨氮去除率先明显增大,后变化较小,可能的原因是_______ 。
 、
、 形式存在),可通过微生物法或氧化法处理为
形式存在),可通过微生物法或氧化法处理为 ,使水中氨氮达到国家规定的排放标准。
,使水中氨氮达到国家规定的排放标准。(1)微生物法:酸性废水中的部分
 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 ,
, 再与
再与 作用生成
作用生成 。
。①
 转化为
转化为 的离子方程式为
的离子方程式为②1mol
 至多可处理
至多可处理 的物质的量为
的物质的量为(2)次氯酸钠氧化法:向氨氮废水中加入NaClO,氨氮转化为
 而除去。
而除去。①NaClO氧化
 的离子方程式为
的离子方程式为②一定pH下,NaClO的投加量对污水中氨氮去除率的影响如图所示。当
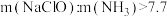 时,总氮的去除率随
时,总氮的去除率随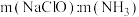 的增大不升反降的可能原因是
的增大不升反降的可能原因是
(3)活性炭-臭氧氧化法:碱性环境下活性炭-臭氧氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,·OH为羟基自由基,其氧化性比
 更强。
更强。
①活性炭-臭氧氧化氨氮的机理可描述为
②其它条件不变调节废水的pH,废水中氨氮去除率随pH的变化如图所示。随pH增大氨氮去除率先明显增大,后变化较小,可能的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】金属锂、钴是重要但又匮乏的战略资源。从度旧锂电池的电极材料(主要为附在铝箱上的LiCoO2,还有少量铁的氧化物)中回收锂(LiF)、钴(CoCO3)的一种工艺流程如下:

回答下列问题:
(1)“钴渣”中 LiCoO2溶解时的离子方程式为_______ 。
(2)如将硫酸改为盐酸浸取“钴渣”,也可得到Co2+,但工业生产中一般不用盐酸浸取“钴渣”,其原因是_______ 。
(3)在“滤液1”中加入20%Na2CO3溶液,目的是_______ 。
(4)“沉淀B”中含有少量Li2CO3。设计由“沉淀B”中提取Li2SO4晶体的实验方案:_______ ,余热蒸干多余水分,冷却,得Li2SO4晶体。(化学试剂可选用:冷水、热水、3.0mol/L硫酸)(已知:Li2CO3溶解度:0℃为1.54g,80℃为0.85g。)
(5)除锂电池外,锌-空气电池的发展和Co、Mn等金属催化剂的使用也是当前电池领域的重要课题。
①已知锌-空气碱性(KOH溶液)电池的总反应是:2Zn+O2=2ZnO,则电池负极电极反应是_______ 。
②MnOx催化电极反应时的机理如下图,请描述MnOx催化电极反应时的催化过程:
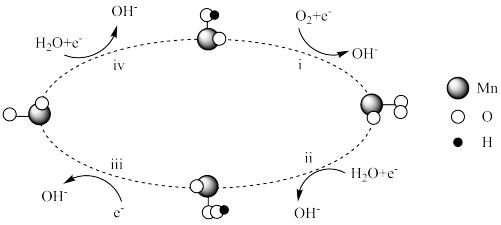
第i步:O2在Mn位点被吸附并得电子转化为 ,取代了位点上最初附着的OH-;
,取代了位点上最初附着的OH-;
第ⅱ步:_______ ;
第ⅲ步:_______ ;
第ⅳ步:O-再次得电子并结合水分子生成了OH-,部分OH-附着在Mn位点上。

回答下列问题:
(1)“钴渣”中 LiCoO2溶解时的离子方程式为
(2)如将硫酸改为盐酸浸取“钴渣”,也可得到Co2+,但工业生产中一般不用盐酸浸取“钴渣”,其原因是
(3)在“滤液1”中加入20%Na2CO3溶液,目的是
(4)“沉淀B”中含有少量Li2CO3。设计由“沉淀B”中提取Li2SO4晶体的实验方案:
(5)除锂电池外,锌-空气电池的发展和Co、Mn等金属催化剂的使用也是当前电池领域的重要课题。
①已知锌-空气碱性(KOH溶液)电池的总反应是:2Zn+O2=2ZnO,则电池负极电极反应是
②MnOx催化电极反应时的机理如下图,请描述MnOx催化电极反应时的催化过程:

第i步:O2在Mn位点被吸附并得电子转化为
 ,取代了位点上最初附着的OH-;
,取代了位点上最初附着的OH-;第ⅱ步:
第ⅲ步:
第ⅳ步:O-再次得电子并结合水分子生成了OH-,部分OH-附着在Mn位点上。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】碱式硫酸锌[ZnSO4•3Zn(OH)2•nH2O]在动物饲料中常用作微量元素锌的锌源添加剂。由锌冶炼中得到的白烟灰(主要成分为ZnO,还含有少量As2O3、PbO)制备碱式硫酸锌的一种工艺流程如图所示:

回答下列问题:
(1)“浸出”中所得浸渣的主要成分为_____ (填化学式),该工序中应不断搅拌,目的是____ 。
(2)As元素在周期表中的位置为_____ 。已知“浸出”后砷元素以H3AsO3形式存在,则“除砷”时生成FeAsO4•2H2O的化学方程式为_____ ,实际操作中消耗的H2O2的量远高于理论值,原因为____ 。
(3)“工序X”的名称为_____ ,在工农业生产中,请写出一条基于Fe2O3物理性质的用途:_____ 。
(4)“沉锌”时生成ZnSO4•3Zn(OH)2•nH2O的离子方程式为_____ 。

回答下列问题:
(1)“浸出”中所得浸渣的主要成分为
(2)As元素在周期表中的位置为
(3)“工序X”的名称为
(4)“沉锌”时生成ZnSO4•3Zn(OH)2•nH2O的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】胆矾(CuSO4·5H2O)是一种重要化工原料,某研究小组以生锈的铜屑为原料[主要成分是Cu,含有少量的油污、CuO、CuCO3、Cu(OH)2]制备胆矾。流程如下,

回答下列问题:
(1)铜屑可用 Na2CO3 溶液去除油污,原理是___________ 。
(2)步骤②中,若仅用浓 H2SO4 溶解固体 B,将生成___________ (填化学式)污染环境。
(3)步骤②中,在 H2O2 存在下 Cu 溶于稀 H2SO4,反应的化学方程式为___________ 。
(4)简述步骤③的结晶操作:将溶液C___________ 。
(5)实验证明溶液 D 能将 I-氧化为 I2。
ⅰ.甲同学认为不可能是步骤②中过量 H2O2 将 I-氧化为 I2,理由是___________ 。
ⅱ.乙同学通过实验证实,只能是 Cu2+将 I-氧化为 I2,乙同学的实验方案及结果为:___________ 。

回答下列问题:
(1)铜屑可用 Na2CO3 溶液去除油污,原理是
(2)步骤②中,若仅用浓 H2SO4 溶解固体 B,将生成
(3)步骤②中,在 H2O2 存在下 Cu 溶于稀 H2SO4,反应的化学方程式为
(4)简述步骤③的结晶操作:将溶液C
(5)实验证明溶液 D 能将 I-氧化为 I2。
ⅰ.甲同学认为不可能是步骤②中过量 H2O2 将 I-氧化为 I2,理由是
ⅱ.乙同学通过实验证实,只能是 Cu2+将 I-氧化为 I2,乙同学的实验方案及结果为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某化学兴趣小组利用下列装置制备亚硝酸钠( ),实验装置如图所示。
),实验装置如图所示。

已知:NO和 易被空气氧化,NO能被酸性高锰酸钾溶液氧化为
易被空气氧化,NO能被酸性高锰酸钾溶液氧化为 ;
;
回答下列问题:
(1)装置a的名称为_______ 。
(2)试配平装置A中反应的化学方程式:_______ 。
_______Cu+_______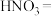 _______
_______ _______
_______ _______
_______
该反应中氧化剂与还原剂的个数比为_______ 。
(3)装置C中浓硫酸的作用是_______ 。
(4)反应开始前打开止水夹K,通入氮气的目的是_______ ;实验结束后,继续通入氮气的目的是_______ 。
(5)装置D中发生的反应为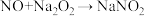 (未配平),每有1个NO参与反应时,转移
(未配平),每有1个NO参与反应时,转移_______ 个电子。
 ),实验装置如图所示。
),实验装置如图所示。
已知:NO和
 易被空气氧化,NO能被酸性高锰酸钾溶液氧化为
易被空气氧化,NO能被酸性高锰酸钾溶液氧化为 ;
;回答下列问题:
(1)装置a的名称为
(2)试配平装置A中反应的化学方程式:
_______Cu+_______
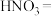 _______
_______ _______
_______ _______
_______该反应中氧化剂与还原剂的个数比为
(3)装置C中浓硫酸的作用是
(4)反应开始前打开止水夹K,通入氮气的目的是
(5)装置D中发生的反应为
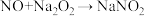 (未配平),每有1个NO参与反应时,转移
(未配平),每有1个NO参与反应时,转移
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】镍粉作为导电填料广泛应用于电路保护的热敏器件,其具有明显降低电阻率的优点。某工厂以氧化镍废渣(主要含有NiO、Fe3O4及少量SiO2)为主要原料制备镍粉,其工艺流程如图所示:

25℃时,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)“酸浸”时Fe3O4发生反应的离子方程式为____ ,“滤渣1”中主要成分的一种用途是____ 。
(2)“转化”时理论上消耗的氧化剂与还原剂物质的量之比为____ 。
(3)“调pH”时应控制的pH范围是____ ,表中a=_____ 。
(4)“沉镍”时不宜用草酸钠代替草酸铵,其原因是____ ,“滤液”中溶质的主要成分为____ (写化学式)。
(5)“还原”时NiC2O4与H2反应,气体产物为CO、CO2,且物质的量之比为1:1,该反应的化学方程式为_____ 。

25℃时,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Ni2+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01mol·L-1)的pH | 7.2 | 2.2 | 7.5 |
| 沉淀完全时((c=1.0×10-5mol·L-1)的pH | 8.7 | 3.2 | a |
(1)“酸浸”时Fe3O4发生反应的离子方程式为
(2)“转化”时理论上消耗的氧化剂与还原剂物质的量之比为
(3)“调pH”时应控制的pH范围是
(4)“沉镍”时不宜用草酸钠代替草酸铵,其原因是
(5)“还原”时NiC2O4与H2反应,气体产物为CO、CO2,且物质的量之比为1:1,该反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3,含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如下:

已知:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Al(OH)3]=1.3×10-33,Ksp[Ni(OH)2]=5.5×10-16。
(1)溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)=___________ mol·L-1;用石灰乳调节至pH≈7,除去的金属离子是___________ 。
(2)加入少量BaS溶液除去Ni2+,生成的沉淀有___________ 。

已知:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Al(OH)3]=1.3×10-33,Ksp[Ni(OH)2]=5.5×10-16。
(1)溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)=
(2)加入少量BaS溶液除去Ni2+,生成的沉淀有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】石棉尾矿主要含有Mg3(Si2O5)(OH)4和少量的Fe2O3、Al2O3。以石棉尾矿为镁源制备碳酸镁晶体(MgCO3·nH2O)的工艺如下:
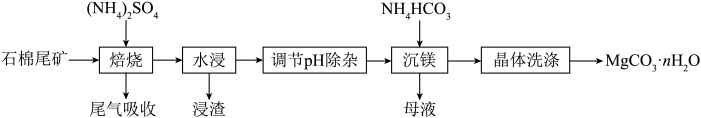
已知“焙烧”过程中的主反应为:
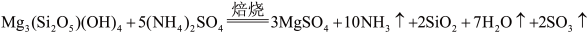
(1)写出焙烧产物NH3的电子式_____________________ 。
(2)为提高水浸速率,可采取的措施为_______________________ (任写一条),“浸渣”的主要成分为__________________ 。
(3)“调节pH除杂”时,需将pH调至5.0,则除去的杂质离子是______________ ,此时溶液中的c(Fe3+)=__________________ (已知Ksp[Fe(OH)3]=4.0×10-38)。
(4)“沉镁”过程中反应的离子方程式为_______________________________________ 。“沉镁”时若温度超过60℃,将产生较多的碱式碳酸镁杂质,原因是________________

已知“焙烧”过程中的主反应为:
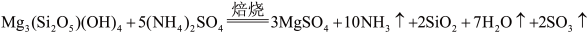
(1)写出焙烧产物NH3的电子式
(2)为提高水浸速率,可采取的措施为
(3)“调节pH除杂”时,需将pH调至5.0,则除去的杂质离子是
(4)“沉镁”过程中反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】软锰矿的主要成分为MnO2,含少量Al2O3和SiO2.闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下:
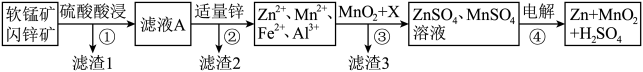
已知:Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.常温下各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)为了加快矿石的酸浸速率,通常采用的方法有___________ (写出两种)。
(2)滤渣2的成分有___________ (填化学式)。
(3)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写MnO2、FeS与硫酸共热发生反应的离子方程式:___________ 。
(4)步骤③中物质X用来调节溶液的pH,可以是下列的___________(填序号)。
(5)当金属离子物质的量浓度为1×10-5mol/L时认为离子完全沉淀,则Ksp[Al(OH)3]=___________ 。
(6)步骤④以锂离子电池作电源,用惰性电极进行电解,其阳极的电极反应式为___________ ;用MnO2可以制取锂离子电池的正极材料LiMnO2,该电池充电时的反应为:LiMnO2+6C=Li1-xMnO2+LixC6,写出充电时阳极的电极反应式___________ 。

已知:Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.常温下各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)为了加快矿石的酸浸速率,通常采用的方法有
(2)滤渣2的成分有
(3)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写MnO2、FeS与硫酸共热发生反应的离子方程式:
(4)步骤③中物质X用来调节溶液的pH,可以是下列的___________(填序号)。
| A.Mg(OH)2 | B.ZnO | C.Cu(OH)2 | D.MnCO3 |
(5)当金属离子物质的量浓度为1×10-5mol/L时认为离子完全沉淀,则Ksp[Al(OH)3]=
(6)步骤④以锂离子电池作电源,用惰性电极进行电解,其阳极的电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】用如图所示的实验装置制备少量乙酸乙酯。请回答有关问题:

(1)写出制取乙酸乙酯的化学反应方程式_____________________________ 。
(2)反应中浓硫酸的作用是①___________________ ;②__________________________ 。
(3)实验中应缓慢加热,理由是__________________________________________________ 。
(4)试管II中的导管口为什么要在液面之上?_________________________________________ 。
(5)饱和的Na2CO3溶液的主要作用是______________
(6)该实验使用的乙醇应不含水分,如何检验乙醇是否含有水分____________________ ,如果乙醇含有水分,如何将其转变为无水乙醇__________________________________ 。

(1)写出制取乙酸乙酯的化学反应方程式
(2)反应中浓硫酸的作用是①
(3)实验中应缓慢加热,理由是
(4)试管II中的导管口为什么要在液面之上?
(5)饱和的Na2CO3溶液的主要作用是
(6)该实验使用的乙醇应不含水分,如何检验乙醇是否含有水分
您最近一年使用:0次
【推荐2】从砷盐净化渣(成分为Cu、As、Zn、ZnO、Co和SiO2)中回收有利用价值的金属,解决了长期以来影响砷盐净化工艺推广的技术难题,具有较强的实践指导意义。其工艺流程如下:
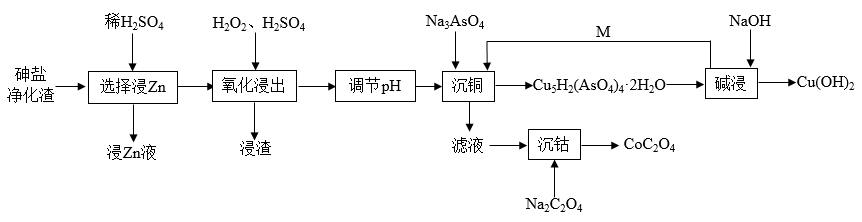
回答下列问题:
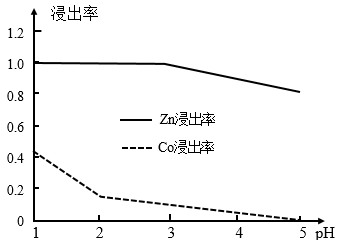
(1)在“选择浸Zn”之前,将砷盐净化渣进行研磨的目的是___________ 。其他条件不变时,Zn和Co的浸出率随pH变化如图所示,则“选择浸Zn”过程中,最好控制溶液的pH=___________ 。
(2)从“浸Zn液”中制备ZnSO4·7H2O时需要结晶、过滤、洗涤、烘干。烘干操作需在减压低温条件下进行,原因是___________ 。
(3)“氧化浸出”时,As被氧化为H3AsO4的化学方程式为___________ 。“浸渣”的主要成分为___________ (填化学式)。
(4)用NaOH溶液调节氧化浸出液至弱酸性,再加入Na3AsO4进行“沉铜”,得到难溶性的Cu5H2(AsO4)4·2H2O,则“沉铜”的离子方程式为___________ 。
(5)为测定草酸钴产品的纯度,现称取m g样品,先用适当试剂将其转化,得到纯净的草酸钴溶液,再用过量的稀硫酸酸化,用c mol·L-1高锰酸钾标准液滴定,达到滴定终点时的现象为___________ ,共用去V mL高锰酸钾标准液,则该草酸钴产品的纯度为___________ 。若酸化时用盐酸代替硫酸,测得的纯度将___________ 。(填“偏高”“偏低”或“无影响”)。

回答下列问题:
(1)在“选择浸Zn”之前,将砷盐净化渣进行研磨的目的是

(2)从“浸Zn液”中制备ZnSO4·7H2O时需要结晶、过滤、洗涤、烘干。烘干操作需在减压低温条件下进行,原因是
(3)“氧化浸出”时,As被氧化为H3AsO4的化学方程式为
(4)用NaOH溶液调节氧化浸出液至弱酸性,再加入Na3AsO4进行“沉铜”,得到难溶性的Cu5H2(AsO4)4·2H2O,则“沉铜”的离子方程式为
(5)为测定草酸钴产品的纯度,现称取m g样品,先用适当试剂将其转化,得到纯净的草酸钴溶液,再用过量的稀硫酸酸化,用c mol·L-1高锰酸钾标准液滴定,达到滴定终点时的现象为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】回答下列问题
(1)A、B、C、D为中学常见的混合物分离或提纯的基本装置,请回答:

①分离植物油和水,选择装置_______ (填序号),主要使用仪器名称_______ ;
②分离乙二醇和丙三醇的混合溶液,选择装置_______ (填序号)。
(2)实验室需配制250mL0.1mol·L-1的Na2CO3溶液,填空并回答下列问题:
①配制250mL0.1mol·L-1的Na2CO3溶液,实际应称取Na2CO3的质量是_______ g,实验过程中所需的玻璃仪器有玻璃棒、烧杯、胶头滴管和 _______ 。
②若在溶液配制过程中出现如下情况,对所配溶液浓度将有何影响(填“偏高”“偏低”或“无影响”),若容量瓶中有少量蒸馏水_______ ;若定容时俯视刻度线_______ 。
(3)Cl2通入一定浓度NaOH溶液后生成了三种含氯化合物,其中n(NaClO):n(NaClO3)=5:1,写出Cl2 与NaOH溶液反应的化学方程式:_______ 。
(1)A、B、C、D为中学常见的混合物分离或提纯的基本装置,请回答:

①分离植物油和水,选择装置
②分离乙二醇和丙三醇的混合溶液,选择装置
| 物质 | 熔点(℃) | 沸点(摄氏度) | 密度(g/cm-3) | 溶解性 |
| 乙二醇 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比例互溶 |
①配制250mL0.1mol·L-1的Na2CO3溶液,实际应称取Na2CO3的质量是
②若在溶液配制过程中出现如下情况,对所配溶液浓度将有何影响(填“偏高”“偏低”或“无影响”),若容量瓶中有少量蒸馏水
(3)Cl2通入一定浓度NaOH溶液后生成了三种含氯化合物,其中n(NaClO):n(NaClO3)=5:1,写出Cl2 与NaOH溶液反应的化学方程式:
您最近一年使用:0次



