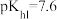铬酸银(Ag2CrO4)微溶于水,常用作分析试剂、有机合成催化剂、电镀、卤化物滴定终点指示剂等。在T℃时,Ag2CrO4在水溶液中的沉淀溶解平衡曲线如图所示。已知:T℃时,AgCl的Ksp=1.8×10-10。下列说法错误的是

| A.T℃时,Y点和Z点时Ag2CrO4的Ksp相等 |
| B.向T℃饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 |
| C.T℃时,Ag2CrO4的Ksp为1×10-6 |
| D.T℃时,将0.01molAgNO3溶液滴入20mL0.01mol·L-1KCl和0.01mol·L-1K2CrO4的混合溶液中,Cl-先沉淀 |
更新时间:2022-02-19 12:29:25
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
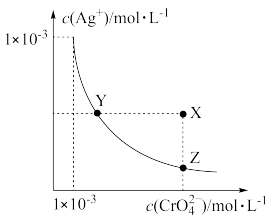
【推荐1】一定温度下,难溶电解质在水中存在沉淀溶解和生成的平衡,常用溶度积Ksp来表示溶解程度的大小,如Ksp(AgCl)=c(Ag+)·c(Cl—)。常温下用0.1000mol/L的AgNO3标准溶液(pH≈5)分别滴定20.00mL0.1000mol/L的NaCl溶液和NaBr溶液,混合溶液的pAg[定义为pAg=—lgc(Ag+)]与AgNO3溶液体积的变化关系如图所示。
下列说法不正确的是

下列说法不正确的是
| A.Ksp(AgCl)>Ksp(AgBr) |
| B.当V(AgNO3溶液)=20mL时,NaBr溶液中:c(Ag+)+c(H+)=c(Br—)+c(OH—) |
C.当V(AgNO3溶液)=30mL时,NaCl溶液中:c(NO )>c(Na+)>c(Ag+)>c(Cl—)>c(H+) )>c(Na+)>c(Ag+)>c(Cl—)>c(H+) |
| D.相同实验条件下,若改用10.00mL0.2000mol/LNaCl溶液,则滴定曲线(滴定终点前)可能变为a |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
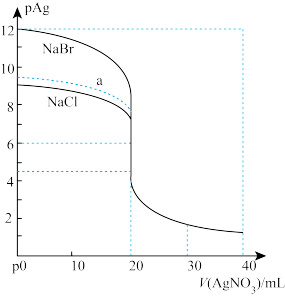
【推荐2】t℃时,AgCl(s)与AgI(s)分别在溶液中达到沉淀溶解平衡,其中AgI的溶解度更小,相关离子浓度的关系如图所示。下列说法正确的是

A.曲线Y表示-lg 与-lg 与-lg 的变化关系 的变化关系 |
| B.t℃时,向Z点对应的溶液中加入蒸馏水,可使溶液变为曲线X对应的饱和溶液 |
| C.t℃时,向浓度均为0.1mol/L的KI与KCl混合溶液中加入AgNO3溶液,当Cl-刚好完全沉淀时,此时c(I-)=1×10-11mol/L |
D.t℃时,AgCl(s)+I-(aq) AgI(s)+Cl-(aq)的平衡常数K=1×103 AgI(s)+Cl-(aq)的平衡常数K=1×103 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】由下列实验操作和现象所得到的结论正确的是
| 实验操作和现象 | 结论 | |
| A | 向等体积等浓度的稀硫酸中分别加入少量等物质的量的ZnS和CuS固体,ZnS溶解而CuS不溶解 | Ksp(ZnS)>Ksp(CuS) |
| B | 向滴有酚酞的Na2CO3溶液中,滴入溶液X,溶液红色逐渐褪去 | 溶液X呈酸性 |
| C | 向某溶液中加入少量BaCl2溶液,产生白色沉淀 | 溶液中含有SO |
| D | 向某溶液中滴加H2O2溶液后再加入KSCN,溶液呈红色 | 溶液中一定含有Fe2+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知: Ksp(BaCO3)=5.1 ×10-9,Ksp(BaSO4)=1.1×10-10,下列推断正确的是
| A.BaSO4和BaCO3均属于弱电解质 |
| B.抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替 |
| C.在BaSO4悬浊液中,加入少量BaCl2固体,得到的悬浊液中c(Ba2+)增大 |
| D.根据Ksp的大小,BaSO4不可能转化为BaCO3 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】磷精矿湿法制备磷酸的一种工艺流程如下:

已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有有机碳等。下列说法不正确的是
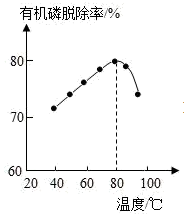

已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有有机碳等。下列说法不正确的是

| A.上述流程中的研磨和加热等措施可以加快反应速率 |
B.酸浸时主要反应:2Ca5(PO4)3(OH)+3H2O+10H2SO4 10CaSO4·0.5H2O+6H3PO4 10CaSO4·0.5H2O+6H3PO4 |
| C.H2O2不同温度下的有机碳脱除率如上图所示。80°C后脱除率变化的原因是:80°C后,H2O2分解速率大,浓度显著降低 |
| D.相同物质的量的BaCO3和CaCO3,CaCO3的脱硫效果更好 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】一定温度下,难溶电解质的饱和溶液中存在着沉淀溶解平衡,已知:

25℃时,对于含Fe2(SO4)3、FeSO4和CuSO4各0.5 mol的1L混合溶液,根据上表数据断,下列说法不正确的是

25℃时,对于含Fe2(SO4)3、FeSO4和CuSO4各0.5 mol的1L混合溶液,根据上表数据断,下列说法不正确的是
| A.在pH=5的溶液中.Fe3+不能大量存在 |
| B.混合溶液中c(SO42—):[c(Fe3+):c(Fe2+):c(Cu2+)]>5:4 |
| C.向混合溶液中逐滴加入0.1mol/LNaOH溶液,最先看到红褐色沉淀 |
| D.向混合溶液中加入适量氯水,并调节pH到3~4过滤,可获较纯净的CuSO4溶液 |
您最近一年使用:0次


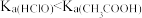 ,
, 的电离度一定比HClO的大
的电离度一定比HClO的大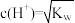 的溶液任何温度下均为中性
的溶液任何温度下均为中性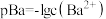 ,
,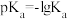 ,且常温下
,且常温下 :
: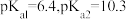 。则常温下向
。则常温下向
 溶液中滴加
溶液中滴加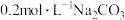 溶液的滴定曲线如图所示。下列说法正确的是
溶液的滴定曲线如图所示。下列说法正确的是
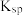 即从大到小的顺序为
即从大到小的顺序为
 溶液替代
溶液替代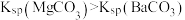 ]
] 为
为
 的
的