下列实验操作、实验现象、解释或结论都正确且有因果关系的是
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 向盛有 溶液的试管中滴加 溶液的试管中滴加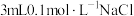 溶液,再向其中滴加一定量 溶液,再向其中滴加一定量 溶液 溶液 | 先有白色沉淀生成,后又产生黄色沉淀 | 常温下,溶度积: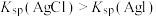 |
| B | 常温下,用 计分别测定 计分别测定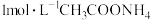 溶液和 溶液和 溶液的 溶液的 | 测得 都等于7 都等于7 | 同温下,不同浓度的 溶液中水的电离程度相同 溶液中水的电离程度相同 |
| C | 用 试纸测相同浓度的 试纸测相同浓度的 溶液、 溶液、 溶液的 溶液的 |  溶液的 溶液的 约为9, 约为9, 溶液的 溶液的 约为8 约为8 |  的酸性比 的酸性比 强 强 |
| D | 向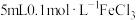 溶液中滴加 溶液中滴加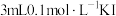 溶液,充分反应后,取少量反应后溶液于试管中,再滴入几滴 溶液,充分反应后,取少量反应后溶液于试管中,再滴入几滴 溶液 溶液 | 溶液变红 |  与 与 的反应为可逆反应 的反应为可逆反应 |
| A.A | B.B | C.C | D.D |
更新时间:2022-02-28 14:16:11
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】向某 、
、 的混合溶液中加入少量的
的混合溶液中加入少量的 ,测得溶液中离子浓度的关系如图所示,下列说法正确的是
,测得溶液中离子浓度的关系如图所示,下列说法正确的是


 、
、 的混合溶液中加入少量的
的混合溶液中加入少量的 ,测得溶液中离子浓度的关系如图所示,下列说法正确的是
,测得溶液中离子浓度的关系如图所示,下列说法正确的是


A.A,B,C三点对应溶液pH的大小顺序为: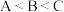 |
B.B点对应的溶液中存在: |
C.向C点溶液中通入 可使C点溶液向B点溶液转化 可使C点溶液向B点溶液转化 |
D.该溶液中存在: |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】25 ℃时,下列各溶液中有关微粒的物质的量浓度关系不正确的是( )
A.①0.2mol·L-1NH4Cl溶液,②0.1mol·L-1 (NH4)2Fe(SO4)2溶液,③0.2mol/LNH4HSO4溶液,④0.1mol·L-1 (NH4)2CO3溶液中,c(NH )大小:③>②>①>④ )大小:③>②>①>④ |
B.一定量的(NH4)2SO4与NH3·H2O混合所得的酸性溶液中:c(NH )<2c(SO )<2c(SO ) ) |
C.0.1 mol·L-1盐酸与0.1 mol·L-1K2CO3溶液等体积混合:c(K+)>c(Cl-)>c(OH-)>c(HCO )>c(H+) )>c(H+) |
| D.25 ℃时,pH=4.7浓度均为0.1 mol·L-1的CH3COOH、CH3COONa的混合溶液中:(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】 表示阿伏加德罗常数,下列说法正确的是
表示阿伏加德罗常数,下列说法正确的是
 表示阿伏加德罗常数,下列说法正确的是
表示阿伏加德罗常数,下列说法正确的是A.常温下, 的 的 溶液中水电离出 溶液中水电离出 数目为 数目为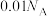 |
B.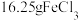 水解形成的 水解形成的 胶体粒子数为 胶体粒子数为 |
C.常温下,8.8g环氧乙烷(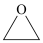 )中含有的共价键数目为 )中含有的共价键数目为 |
D.电解饱和食盐水时,若阴阳两极产生气体的总质量为7.3g,则转移电子数为 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列实验操作、实验现象与得出的结论均正确且相符的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向碳酸钠溶液中滴加几滴硼酸溶液 | 无气泡产生 | 硼酸的酸性弱于碳酸 |
| B | 将熟石灰与 晶体在小烧杯中混合,滴入几滴水,搅拌 晶体在小烧杯中混合,滴入几滴水,搅拌 | 烧杯壁变凉 | 该反应 |
| C | 常温下,向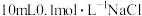 溶液中滴加5滴 溶液中滴加5滴 溶液,充分反应后,再滴加5滴 溶液,充分反应后,再滴加5滴 溶液,观察沉淀颜色变化 溶液,观察沉淀颜色变化 | 观察到先出现白色沉淀,然后出现黄色沉淀 | 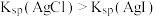 |
| D | 向两支盛有 酸性高锰酸钾溶液的试管中分别加入 酸性高锰酸钾溶液的试管中分别加入 草酸溶液和 草酸溶液和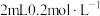 草酸溶液 草酸溶液 | 加入 草酸溶液的试管溶液紫色消失更快 草酸溶液的试管溶液紫色消失更快 | 其他条件相同,反应物浓度越大,反应速率越快 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】下列实验中,不能 达到实验目的的是
| 实验室制取氨气 | 检验产物乙炔 | 检验浓硫酸与铜反应产生的二氧化硫 | 证明溶解度:AgCl>AgI |
 |  |  |  |
| A | B | C | D |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列实验方案设计中,不能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 验证乙烯与溴发生加成反应 | 溴水中通足量乙烯,取反应后的溶液滴加硝酸酸化的AgNO3 |
| B | 检验氯气管道是否泄漏 | 将蘸有浓氨水的玻璃棒置于疑似泄漏的管道处 |
| C | 验证KSP(AgI)<KSP(AgCl) | 向含浓度均为0.1mol/L的NaCl、KI的混合液中滴加AgNO3溶液 |
| D | 检验乙酸中是否混有乙醇 | 取样于试管,加入绿豆粒大小的钠粒 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】下列化学事实对应的原理或解释正确的是
| 化学事实 | 原理或解释 | |
| A | 焦炭在高温下与石英砂反应制备粗硅 | 非金属性:C>Si |
| B | 向NaAlO2溶液中滴加NaHCO3溶液,有白色沉淀生成 |  与 与 均发生水解反应并相互促进 均发生水解反应并相互促进 |
| C | 将浓硫酸加入蔗糖中,蔗糖变黑,放出大量热,生成有刺激性气味的气体 | 浓硫酸具有脱水性、强氧化性 |
| D | 将1 mL0.1 mol/L KI溶液与5 mL0.1 mol/L FeCl3溶液混合,再滴加KSCN溶液,溶液变为红色 | FeCl3与KI的反应有一定的限度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次

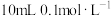 的
的 溶液中依次滴入几滴
溶液中依次滴入几滴 溶液和KI溶液
溶液和KI溶液 通入
通入 沉淀
沉淀 、
、 或
或
 溶液中通入
溶液中通入
 溶液
溶液 溶液
溶液 溶液
溶液

