以CO、CO2、CH4、CH3OH为原料的化学工艺,对控制环境污染有重要意义。
(1)治理汽车尾气的反应是2NO(g)+2CO(g) 2CO2(g)+N2(g),向体积为1L的密闭容器中充入2molNO和1molCO。
2CO2(g)+N2(g),向体积为1L的密闭容器中充入2molNO和1molCO。
①图中正确且能说明反应在进行到t1时刻一定达到平衡状态的是____ (选填字母)。
a.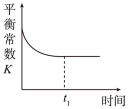 b.
b.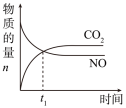 c.
c.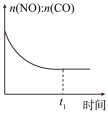 d.
d.
②平衡时,CO的转化率与温度、压强的关系如图所示。则p1___ p2(填“>”、“<”或“=”),100℃时,该反应的压强平衡常数Kp=___ (用含P1的计算式表示)。
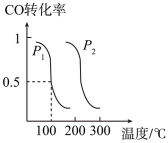
(2)一定温度下,在三个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-bkJ/mol。相关数据如表:
CH3OH(g)+H2O(g) ΔH=-bkJ/mol。相关数据如表:
请回答:①2c1____ c3(填“>”、“<”或“=”);b=____ ,a=___ 。
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是____ mol/(L·s)。
(1)治理汽车尾气的反应是2NO(g)+2CO(g)
 2CO2(g)+N2(g),向体积为1L的密闭容器中充入2molNO和1molCO。
2CO2(g)+N2(g),向体积为1L的密闭容器中充入2molNO和1molCO。①图中正确且能说明反应在进行到t1时刻一定达到平衡状态的是
a.
 b.
b. c.
c. d.
d.
②平衡时,CO的转化率与温度、压强的关系如图所示。则p1

(2)一定温度下,在三个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-bkJ/mol。相关数据如表:
CH3OH(g)+H2O(g) ΔH=-bkJ/mol。相关数据如表:| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) | 2molCO2(g)和6molH2(g) |
| 平衡时c(CH3OH) | c1 | c2 | c3 |
| 平衡时能量变化 | 放出29.4kJ | 吸收akJ |
| H—H | C—H | C—O | C=O | O—H | |
| 键能kJ/mol | 436 | 415 | 326 | 803 | 464 |
②若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是
更新时间:2022-03-23 15:34:51
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】氯胺是一种长效缓释水消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl,NHCl2和NCl3)。工业上可利用NH3(g)+Cl2(g)  NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
(1)氯胺作饮用水消毒剂是因为水解生成具有强烈杀菌作用的物质,该物质是___ ,二氯胺与水反应的化学方程式为___ 。
(2)已知部分化学键的键能和化学反应的能量变化如表和如图所示(忽略不同物质中同种化学键键能的细微差别)。

则ΔH2=___ kJ/mol,x=___ 。
(3)在密闭容器中反应NH3(g)+Cl2(g) NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随
NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随 (氨氯比)的变化曲线如图所示。
(氨氯比)的变化曲线如图所示。
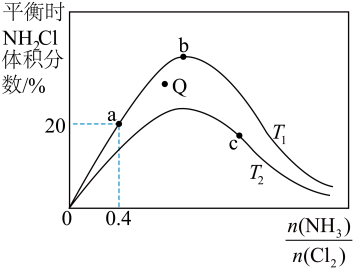
①a、b、c三点对应平衡常数的大小关系是___ 。T1温度下该反应的平衡常数为___ (列出算式即可)。
②在T2温度下,Q点对应的速率:v正___ v逆(填“大于”“小于”或“等于”)。
③在氨氯比一定时,提高NH3的转化率的方法是___ (任写1种)
④若产物都是气体,实验测得NH2Cl的体积分数始终比理论值低,原因可能是___ 。
 NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:(1)氯胺作饮用水消毒剂是因为水解生成具有强烈杀菌作用的物质,该物质是
(2)已知部分化学键的键能和化学反应的能量变化如表和如图所示(忽略不同物质中同种化学键键能的细微差别)。

| 化学键 | N-H | N-Cl | H-Cl |
| 键能(kJ/mol) | 391.3 | x | 431.8 |
则ΔH2=
(3)在密闭容器中反应NH3(g)+Cl2(g)
 NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随
NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随 (氨氯比)的变化曲线如图所示。
(氨氯比)的变化曲线如图所示。
①a、b、c三点对应平衡常数的大小关系是
②在T2温度下,Q点对应的速率:v正
③在氨氯比一定时,提高NH3的转化率的方法是
④若产物都是气体,实验测得NH2Cl的体积分数始终比理论值低,原因可能是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】根据原子结构,分子结构与性质相关知识,回答下列问题:
(1)基态硅原子的价电子轨道表示式是_________ ,核外有________ 种不同运动状态的电子。
(2)NH3分子的VSEPR模型为______________ ;SO3分子的立体构型为:_______________ ;
(3)根据等电子原理,写出CN-的电子式_______ ;SCN-中心原子的杂化方式为________ ;
(4)沸点比较:SiH4_______ CH4(填大于、小于、等于),原因是_____________
(5)在下列物质①P4②NH3③HCN④BF3⑤H2O⑥SO3⑦CH3Cl中⑧H2O2,属于含有极性键的极性分子的是(填序号)_______ 。
(6)碳可以形成多种有机化合物,下图所示是噻吩的结构,分子中所有原子都在一个平面上。
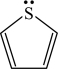
①噻吩中所有元素的电负性由大到小的顺序__________ 。
②噻吩结构中C原子的杂化方式为___________ 。
③分子中的大π键可以用符号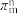 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。请问噻吩中的大π键表示为
)。请问噻吩中的大π键表示为__________ 。
(7)键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热,回答下列问题:
已知H—H键能为436kJ/mol,N-H键能为391kJ/mol,N N键能为946kJ/mol,合成氨反应中,反应前充入N2和H2各6mol,达平衡时,N2的转化率为15%,试计算这种情况下,反应
N键能为946kJ/mol,合成氨反应中,反应前充入N2和H2各6mol,达平衡时,N2的转化率为15%,试计算这种情况下,反应___________ 能量(填“吸收”或“放出”)___________ kJ
(1)基态硅原子的价电子轨道表示式是
(2)NH3分子的VSEPR模型为
(3)根据等电子原理,写出CN-的电子式
(4)沸点比较:SiH4
(5)在下列物质①P4②NH3③HCN④BF3⑤H2O⑥SO3⑦CH3Cl中⑧H2O2,属于含有极性键的极性分子的是(填序号)
(6)碳可以形成多种有机化合物,下图所示是噻吩的结构,分子中所有原子都在一个平面上。

①噻吩中所有元素的电负性由大到小的顺序
②噻吩结构中C原子的杂化方式为
③分子中的大π键可以用符号
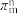 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。请问噻吩中的大π键表示为
)。请问噻吩中的大π键表示为(7)键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热,回答下列问题:
已知H—H键能为436kJ/mol,N-H键能为391kJ/mol,N
 N键能为946kJ/mol,合成氨反应中,反应前充入N2和H2各6mol,达平衡时,N2的转化率为15%,试计算这种情况下,反应
N键能为946kJ/mol,合成氨反应中,反应前充入N2和H2各6mol,达平衡时,N2的转化率为15%,试计算这种情况下,反应
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】CO2与CH4经催化重整,制得合成气: CH4(g)+ CO2(g) 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
(1)已知上述反应中相关的化学键键能数据如下:
则该反应的ΔH=___________ kJ·mol-1.
(2)在容积为V L的恒温恒容密闭容器中,加入CH4和CO2各1 mol的混合气体,在一定条件下发生反应。下列描述能说明反应达到平衡状态的是___________(填标号)。
(3)在容积为V L的恒温恒容密闭容器中,加入CH4和CO2各1 mol的混合气体,反应达到平衡时体系压强变为原来的1.8倍,则CH4的平衡转化率为___________ 。向上述达到平衡的恒容密闭容器中再充入CH4、CO2、CO、H2各0.1 mol,保持温度不变,则化学平衡___________ (填“正向”、“逆向”或“不”)移动。对于上述平衡体系,若只改变某一反应条件,下列措施能提高CH4的平衡转化率的是___________ (填序号)。
①增大CH4的物质的量 ②增大CO2的物质的量 ③增大压强 ④升高温度
(4)分别在V L恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是___________ (填“A” 或“B ”)
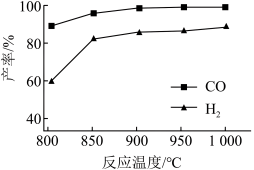
(5)按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如下图所示。此反应优选温度为900℃的原因___________ 。
 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)(1)已知上述反应中相关的化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | C O(CO) O(CO) |
| 键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
(2)在容积为V L的恒温恒容密闭容器中,加入CH4和CO2各1 mol的混合气体,在一定条件下发生反应。下列描述能说明反应达到平衡状态的是___________(填标号)。
| A.密闭容器中CH4的体积分数保持不变 |
| B.密闭容器中混合气体的密度保持不变 |
| C.CH4和CO2的转化率相等 |
| D.密闭容器中混合气体的平均相对分子质量保持不变 |
(3)在容积为V L的恒温恒容密闭容器中,加入CH4和CO2各1 mol的混合气体,反应达到平衡时体系压强变为原来的1.8倍,则CH4的平衡转化率为
①增大CH4的物质的量 ②增大CO2的物质的量 ③增大压强 ④升高温度
(4)分别在V L恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是
(5)按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如下图所示。此反应优选温度为900℃的原因

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】在2L密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
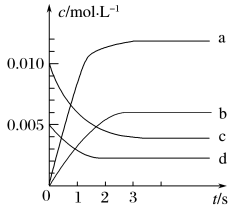
(1)如图表示NO2变化的曲线是___ 。用O2表示从0~2s内该反应的平均速率v=___ 。
(2)能说明该反应已达到平衡状态的是___ (填字母,下同)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(3)为使该反应的反应速率增大,下列措施正确的是___ 。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示NO2变化的曲线是

(2)能说明该反应已达到平衡状态的是
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(3)为使该反应的反应速率增大,下列措施正确的是
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①下表所列数据是反应I在不同温度下的化学平衡常数(K)。
由表中数据判断ΔH1______________ 0 (填“>”、“=”或“<”)。
②某温度下,将2molCO和6molH2充入2L的密闭容器中,5min后该反应达到平衡,测得c(CO)=0.2mol/L,则用H2表示的该反应的反应速率为:___________________ ,此时的温度为_______ (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1275.6kJ/mol
② 2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ/mol
③ H2O(g)=H2O(l) ΔH=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_________
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
①该电池正极的电极反应为____________________ 。
②用该电池电解200mL饱和食盐水(溶质足量),一段时间后,阴极得,电解后溶液的pH为______ (溶液体积变化忽略不计),要使电解后溶液复原,所加物质为_______ (填名称)。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)
 CH3OH(g) ΔH1
CH3OH(g) ΔH1反应II:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2①下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1
②某温度下,将2molCO和6molH2充入2L的密闭容器中,5min后该反应达到平衡,测得c(CO)=0.2mol/L,则用H2表示的该反应的反应速率为:
(2)已知在常温常压下:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1275.6kJ/mol
② 2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ/mol
③ H2O(g)=H2O(l) ΔH=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。

①该电池正极的电极反应为
②用该电池电解200mL饱和食盐水(溶质足量),一段时间后,阴极得,电解后溶液的pH为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
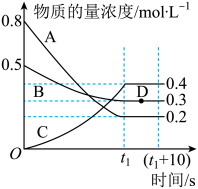
【推荐3】如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的情况。
(1)该反应的化学方程式为___________ 。
(2)0~t1s内气体B的平均反应速率为___________ 。
(3)(t1+10)s时,B的物质的量分数为___________ (结果保留一位小数)。
(4)能判断该反应在一定温度下达到化学平衡状态的依据是___________ (填字母)。
a.容器中压强不变 b.混合气体中 不变
不变
c.容器中气体密度不变 d.
(5)容器中(t1+10)s时的压强与起始时的压强之比为___________ 。
(1)该反应的化学方程式为
(2)0~t1s内气体B的平均反应速率为
(3)(t1+10)s时,B的物质的量分数为
(4)能判断该反应在一定温度下达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中
 不变
不变c.容器中气体密度不变 d.

(5)容器中(t1+10)s时的压强与起始时的压强之比为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】空间站利用“萨巴蒂尔反应”配合 生成系统可实现
生成系统可实现 的再生。回答下列问题:
的再生。回答下列问题:
Ⅰ.萨巴蒂尔反应为:

(1)萨巴蒂尔反应的前三步历程图如下。其中物质吸附在催化剂表面用“。”标注, 表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会
表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会___________ (填“放出热量”或“吸收热量”)。

(2)在恒容密闭容器中加入 和
和 ,其分压分别20kPa和40kPa,一定条件下发生萨巴蒂尔反应。某时刻测得
,其分压分别20kPa和40kPa,一定条件下发生萨巴蒂尔反应。某时刻测得 的分压15kPa,
的分压15kPa, 的反应速率
的反应速率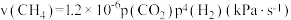 ,则该时刻
,则该时刻
___________  。
。
(3)航天器中可用
 ,然后电解水又得
,然后电解水又得 和
和 来处理
来处理 。现向一恒容密闭容器中通入
。现向一恒容密闭容器中通入 和
和 ,测得反应过程中压强随时间的变化如图中a所示,若其它条件不变,仅改变某一条件时,测得其压强随时间的变化如图中b所示。曲线a中,反应开始时,压强先变大的原因可能是
,测得反应过程中压强随时间的变化如图中a所示,若其它条件不变,仅改变某一条件时,测得其压强随时间的变化如图中b所示。曲线a中,反应开始时,压强先变大的原因可能是___________ ,曲线b改变的条件是___________ 。

Ⅱ.工业上利用甲酸的能量关系转换图如下:

(4)反应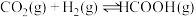 的焓变
的焓变
___________  。
。
(5)温度为 ℃时,将等物质的量的
℃时,将等物质的量的 和
和 充入体积为1L的密闭容器中发生反应:
充入体积为1L的密闭容器中发生反应: 。实验测得:
。实验测得: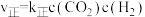 ,
, ,
, 、
、 为速率常数。则
为速率常数。则 ℃时,
℃时,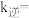
___________  ;温度为
;温度为 ℃时,
℃时,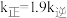 ,则
,则 ℃>
℃> ℃,理由是
℃,理由是___________ 。
 生成系统可实现
生成系统可实现 的再生。回答下列问题:
的再生。回答下列问题:Ⅰ.萨巴蒂尔反应为:


(1)萨巴蒂尔反应的前三步历程图如下。其中物质吸附在催化剂表面用“。”标注,
 表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会
表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会
(2)在恒容密闭容器中加入
 和
和 ,其分压分别20kPa和40kPa,一定条件下发生萨巴蒂尔反应。某时刻测得
,其分压分别20kPa和40kPa,一定条件下发生萨巴蒂尔反应。某时刻测得 的分压15kPa,
的分压15kPa, 的反应速率
的反应速率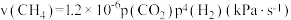 ,则该时刻
,则该时刻
 。
。(3)航天器中可用
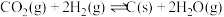
 ,然后电解水又得
,然后电解水又得 和
和 来处理
来处理 。现向一恒容密闭容器中通入
。现向一恒容密闭容器中通入 和
和 ,测得反应过程中压强随时间的变化如图中a所示,若其它条件不变,仅改变某一条件时,测得其压强随时间的变化如图中b所示。曲线a中,反应开始时,压强先变大的原因可能是
,测得反应过程中压强随时间的变化如图中a所示,若其它条件不变,仅改变某一条件时,测得其压强随时间的变化如图中b所示。曲线a中,反应开始时,压强先变大的原因可能是
Ⅱ.工业上利用甲酸的能量关系转换图如下:

(4)反应
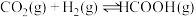 的焓变
的焓变
 。
。(5)温度为
 ℃时,将等物质的量的
℃时,将等物质的量的 和
和 充入体积为1L的密闭容器中发生反应:
充入体积为1L的密闭容器中发生反应: 。实验测得:
。实验测得: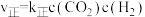 ,
, ,
, 、
、 为速率常数。则
为速率常数。则 ℃时,
℃时,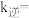
 ;温度为
;温度为 ℃时,
℃时,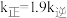 ,则
,则 ℃>
℃> ℃,理由是
℃,理由是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+ O2(g)=C3H3N(g)+3H2O(g) ΔH=-515 kJ/mol
O2(g)=C3H3N(g)+3H2O(g) ΔH=-515 kJ/mol
②C3H6(g)+O2(g)=C3H4O(g)+H2O(g) ΔH=-353 kJ/mol
有利于提高丙烯腈平衡产率的反应条件是___________ ;提高丙烯腈反应选择性的关键因素是___________ 。
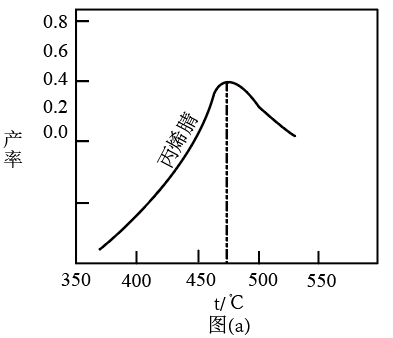
(2)图(a)为丙烯腈产率与温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率___________ (填“是”或者“不是”)对应温度下的平衡产率,判断理由是___________ ;高于460℃时,丙烯腈产率降低的可能原因是___________
A.催化剂活性降低 B.高于460℃,反应达到平衡,升温平衡逆向移动
C.副反应增多 D.反应活化能增大
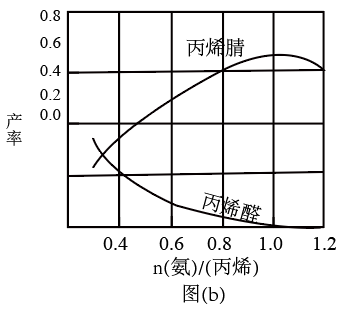
(3)丙烯腈和丙烯醛的产率与 的关系如图(b)所示。由图可知,最佳
的关系如图(b)所示。由图可知,最佳 约为
约为___________ ,理由是___________ 。
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+
 O2(g)=C3H3N(g)+3H2O(g) ΔH=-515 kJ/mol
O2(g)=C3H3N(g)+3H2O(g) ΔH=-515 kJ/mol②C3H6(g)+O2(g)=C3H4O(g)+H2O(g) ΔH=-353 kJ/mol
有利于提高丙烯腈平衡产率的反应条件是
(2)图(a)为丙烯腈产率与温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率

A.催化剂活性降低 B.高于460℃,反应达到平衡,升温平衡逆向移动
C.副反应增多 D.反应活化能增大
(3)丙烯腈和丙烯醛的产率与
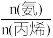 的关系如图(b)所示。由图可知,最佳
的关系如图(b)所示。由图可知,最佳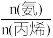 约为
约为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】中国空间站已实现有人长期驻留时代,空间站的水气整合系统利用“萨巴蒂尔反应”,将CO2转化为CH4和水蒸气,配合O2生成系统可实现O2的再生。回答下列问题:
Ⅰ.萨巴蒂尔反应为:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH1
CH4(g)+2H2O(g) ΔH1
(1)常温常压下,已知:①H2和CH4的燃烧热(ΔH)分别为-285.5kJ/mol和-890.0kJ/mol;
②H2O(l)=H2O(g) ΔH2=+44.0kJ/mol。
则ΔH1=___________ kJ/mol。
(2)在某一恒容密闭容器中加入CO2、H2,其分压分别为15kPa、30kPa,加入催化剂并加热使其发生萨巴蒂尔反应。研究表明CH4的反应速率v(CH4)=1.2×10-6p(CO2)p4(H2)(kPa﹒s-1),某时刻测得H2O(g)的分压为10kPa,则该时刻v(H2)=___________ kPa·s-1。
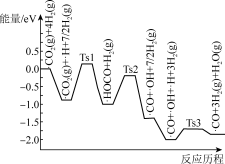
(3)研究发现萨巴蒂尔反应的历程,前三步历程如图所示。其中吸附在Pt/SiO2催化剂表面用“﹒”标注,Ts表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会___________ (填“放出热量”或“吸收热量”);反应历程中最小能垒(活化能)步骤的化学方程式为___________ 。
Ⅱ.某研究团队经实验证明,CO2在一定条件下与H2O发生氧再生反应:CO2(g)+2H2O(g) CH4(g)+2O2(g) ΔH1=+802.3kJ/mol
CH4(g)+2O2(g) ΔH1=+802.3kJ/mol
(4)恒压条件时,按c(CO2):c(H2O)=1:2投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图。
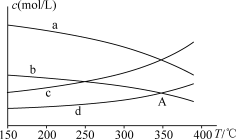
350℃时,A点的平衡常数为K=___________ (填计算结果)。为提高CO2的转化率,除改变温度外,还可采取的措施为___________ 。
(5)氧再生反应可以通过酸性条件下半导体光催化转化实现;反应机理如图所示:

催化剂的催化效率和CH4的生成速率随温度的变化关系如图所示。300℃到400℃之间,CH4生成速率加快的原因是___________ 。
Ⅰ.萨巴蒂尔反应为:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH1
CH4(g)+2H2O(g) ΔH1(1)常温常压下,已知:①H2和CH4的燃烧热(ΔH)分别为-285.5kJ/mol和-890.0kJ/mol;
②H2O(l)=H2O(g) ΔH2=+44.0kJ/mol。
则ΔH1=
(2)在某一恒容密闭容器中加入CO2、H2,其分压分别为15kPa、30kPa,加入催化剂并加热使其发生萨巴蒂尔反应。研究表明CH4的反应速率v(CH4)=1.2×10-6p(CO2)p4(H2)(kPa﹒s-1),某时刻测得H2O(g)的分压为10kPa,则该时刻v(H2)=
(3)研究发现萨巴蒂尔反应的历程,前三步历程如图所示。其中吸附在Pt/SiO2催化剂表面用“﹒”标注,Ts表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会

Ⅱ.某研究团队经实验证明,CO2在一定条件下与H2O发生氧再生反应:CO2(g)+2H2O(g)
 CH4(g)+2O2(g) ΔH1=+802.3kJ/mol
CH4(g)+2O2(g) ΔH1=+802.3kJ/mol(4)恒压条件时,按c(CO2):c(H2O)=1:2投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图。

350℃时,A点的平衡常数为K=
(5)氧再生反应可以通过酸性条件下半导体光催化转化实现;反应机理如图所示:

催化剂的催化效率和CH4的生成速率随温度的变化关系如图所示。300℃到400℃之间,CH4生成速率加快的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ、反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题.

(1)该反应是_________ 反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率_______ (填“增大”、“减小”、“不变”)。
(3)反应体系中加入催化剂对反应热是否有影响?_____ (填“有”、“无”),原因是____ 。
(4)在反应体系中加入催化剂,反应速率增大,E1的变化是:E1____ (填“增大”、“减小”、“不变”)。
Ⅱ、五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g) PCl5(g) △H=-0.930 kJ•mol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
PCl5(g) △H=-0.930 kJ•mol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
(1)50~150s内的平均反应速率v(PCl3)=___________ 。
(2)该温度下,此反应的化学平衡常数的数值为___________ (可用分数表示)。
(3)反应至250s时,该反应放出的热量为______________ kJ。
(4)下列关于上述反应的说法中,正确的是__________ (填字母序号)。
a.无论是否达平衡状态,混合气体的密度始终不变
b.300s时,升高温度,正、逆反应速率同时增大
c.350s时,向该密闭容器中充入氮气,平衡向正反应方向移动
d.相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.5molCl2,达到化学平衡状态时,n(PCl5)<0.20mol
(5)温度T1时,混合气体中PCl5的体积分数随时间t变化的示意图如下。其他条件相同,请在下图中画出温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线__________ 。

 C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
(1)该反应是
(2)当反应达到平衡时,升高温度,A的转化率
(3)反应体系中加入催化剂对反应热是否有影响?
(4)在反应体系中加入催化剂,反应速率增大,E1的变化是:E1
Ⅱ、五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g)
 PCl5(g) △H=-0.930 kJ•mol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
PCl5(g) △H=-0.930 kJ•mol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)50~150s内的平均反应速率v(PCl3)=
(2)该温度下,此反应的化学平衡常数的数值为
(3)反应至250s时,该反应放出的热量为
(4)下列关于上述反应的说法中,正确的是
a.无论是否达平衡状态,混合气体的密度始终不变
b.300s时,升高温度,正、逆反应速率同时增大
c.350s时,向该密闭容器中充入氮气,平衡向正反应方向移动
d.相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.5molCl2,达到化学平衡状态时,n(PCl5)<0.20mol
(5)温度T1时,混合气体中PCl5的体积分数随时间t变化的示意图如下。其他条件相同,请在下图中画出温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】乙醛是一种重要的脂肪族化合物,在工业、农业、医药、食品和饲料添加剂等领域具有非常广泛的应用。目前,常用乙醇脱氢来制备。
I(乙醇氧化脱氢):2CH3CH2OH(g)+O2(g) 2CH3CHO(g)+2H2O(g) ∆H1
2CH3CHO(g)+2H2O(g) ∆H1
II(乙醇直接脱氢):CH3CH2OH(g) CH3CHO(g)+H2(g) ∆H2
CH3CHO(g)+H2(g) ∆H2
(1)已知相关共价键的键能数据如表:
∆H1=___________ kJ·mol-1
(2)在恒温恒容下,如果从反应物出发建立平衡,不能说明反应I(乙醇氧化脱氢)达到平衡状态的是___________ 。(填选项字母)
A、体系压强不再变化 B、v正(CH3CH2OH)=2v逆(O2)
C、混合气体的密度保持不变 D、混合气体平均相对分子质量保持不变
(3)对于反应II(乙醇直接脱氢),T1℃,P1kPa条件下,向一容积可变的密闭容器中,充入2mol乙醇气体,达平衡后乙醇的转化率为50%,容器体积为2L。T1℃,P2 kPa条件下,充入2mol乙醇气体,平衡后乙醇的转化率为60%,此时容器的体积为___________ L。
(4)乙醇直接脱氢反应中Cu基催化剂是最常用的催化剂体系之一、研究者研究了用Cu35Zn25Al43作催化剂时不同温度对乙醇直接脱氢反应性能的影响,图象如图:
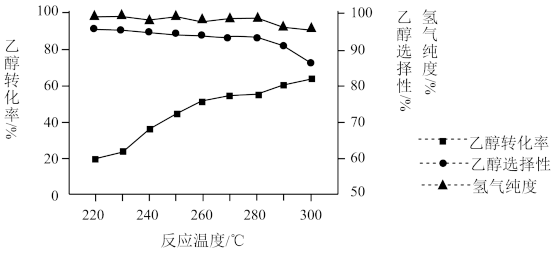
最适宜的温度为___________ ;结合图象说明选择该温度的理由___________ 。
(5)乙醇直接脱氢反应中铜基催化剂有失活的缺点。大连物化所的研究者设计了一种多级海胆状结构Cu-MFI-AE催化剂,在乙醇催化中展示了较高的乙醛选择性、稳定性。催化剂表面上反应历程如图所示,其中吸附在催化剂表面上的物质用*标注。

写出该历程中最大能垒对应步骤的化学方程式___________ 。
I(乙醇氧化脱氢):2CH3CH2OH(g)+O2(g)
 2CH3CHO(g)+2H2O(g) ∆H1
2CH3CHO(g)+2H2O(g) ∆H1II(乙醇直接脱氢):CH3CH2OH(g)
 CH3CHO(g)+H2(g) ∆H2
CH3CHO(g)+H2(g) ∆H2(1)已知相关共价键的键能数据如表:
| 共价键 | C-H | O-H | C-O | C=O | O=O | C-C |
| 键能(kJ·mol-1) | 413 | 462 | 351 | 745 | 497 | 348 |
∆H1=
(2)在恒温恒容下,如果从反应物出发建立平衡,不能说明反应I(乙醇氧化脱氢)达到平衡状态的是
A、体系压强不再变化 B、v正(CH3CH2OH)=2v逆(O2)
C、混合气体的密度保持不变 D、混合气体平均相对分子质量保持不变
(3)对于反应II(乙醇直接脱氢),T1℃,P1kPa条件下,向一容积可变的密闭容器中,充入2mol乙醇气体,达平衡后乙醇的转化率为50%,容器体积为2L。T1℃,P2 kPa条件下,充入2mol乙醇气体,平衡后乙醇的转化率为60%,此时容器的体积为
(4)乙醇直接脱氢反应中Cu基催化剂是最常用的催化剂体系之一、研究者研究了用Cu35Zn25Al43作催化剂时不同温度对乙醇直接脱氢反应性能的影响,图象如图:

最适宜的温度为
(5)乙醇直接脱氢反应中铜基催化剂有失活的缺点。大连物化所的研究者设计了一种多级海胆状结构Cu-MFI-AE催化剂,在乙醇催化中展示了较高的乙醛选择性、稳定性。催化剂表面上反应历程如图所示,其中吸附在催化剂表面上的物质用*标注。

写出该历程中最大能垒对应步骤的化学方程式
您最近一年使用:0次
【推荐3】丙烯腈(C3H3N)是一种重要的化工原料,以丙烯(C3H6)、NH3、O2为原料,选择合适的催化剂生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①主反应;C3H6(g)+NH3(g)+ O2(g)
O2(g) C3H3N(g)+3H2O(g) ΔH1
C3H3N(g)+3H2O(g) ΔH1
②副反应:C3H6(g)+O2(g) C3H4O(g)+H2O(g) ΔH2=-353kJ·mol-1
C3H4O(g)+H2O(g) ΔH2=-353kJ·mol-1
(1)T1时。若只发生反应①,向恒压容器中充入0.2molC3H6、0.2molNH3和0.3molO2达到平衡时,放出51.5kJ能量;若向相同容器中充入lmolC3H3N(g)和3molH2O(g),达平衡时吸收257.5kJ能量,则该反应ΔH1为___________ 。
(2)T1时,向恒压容器中投入2molC3H3N(g)、6molH2O(g)和不同物质的量的He(g),同时发生反应①和反应②,一段时间建立平衡,随着n(He)的值增大,C3H3N的物质的量___________ (填“增大”“减小”或“不变”),原因是___________ 。
(3)将一定量的丙烯(C3H6)、NH3、O2投入恒容密闭容器中,分别在不同的温度和催化剂下进行反应,保持其他初始实验条件不变,经10min测得C3H6气体转化率如图所示。T2温度下两曲线相交,下列说法正确的是___________ (填标号)。
b.在A点时,反应一定未达到平衡
c.增大压强对反应的速率无影响
(4)制丙烯腈的原料之一NH3的化学方程式:N2(g)+3H2(g) 2NH3(g)。
2NH3(g)。
①在恒定温度和恒定压强p(单位:Pa)下进行反应,若N2、H2起始物质的量之比为1∶3,NH3的平衡产率是ω(产率= ×100%),用分压代替物质的浓度,计算平衡常数Kp=
×100%),用分压代替物质的浓度,计算平衡常数Kp=___________ (用含ω、p的计算式表示)。
②反应N2(g)+3H2(g) 2NH3(g)达到平衡时,正、逆反应的速率方程分别为v正=k正p(N2)·p1.5(H2)·p-1(NH3),v逆=k逆pα(N2)·pβ(H2)·pγ(NH3),k正、k逆为速率常数,已知Kp=
2NH3(g)达到平衡时,正、逆反应的速率方程分别为v正=k正p(N2)·p1.5(H2)·p-1(NH3),v逆=k逆pα(N2)·pβ(H2)·pγ(NH3),k正、k逆为速率常数,已知Kp=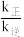 ,据此计算β=
,据此计算β=___________ ,γ=___________ 。
(5)电解丙烯腈(CH2=CHCN)合成已二腈[NC(CH2)4CN]的原理如图所示:___________ ;工作时乙室的pH___________ (填“增大”“减小”或“不变”)。
①主反应;C3H6(g)+NH3(g)+
 O2(g)
O2(g) C3H3N(g)+3H2O(g) ΔH1
C3H3N(g)+3H2O(g) ΔH1②副反应:C3H6(g)+O2(g)
 C3H4O(g)+H2O(g) ΔH2=-353kJ·mol-1
C3H4O(g)+H2O(g) ΔH2=-353kJ·mol-1(1)T1时。若只发生反应①,向恒压容器中充入0.2molC3H6、0.2molNH3和0.3molO2达到平衡时,放出51.5kJ能量;若向相同容器中充入lmolC3H3N(g)和3molH2O(g),达平衡时吸收257.5kJ能量,则该反应ΔH1为
(2)T1时,向恒压容器中投入2molC3H3N(g)、6molH2O(g)和不同物质的量的He(g),同时发生反应①和反应②,一段时间建立平衡,随着n(He)的值增大,C3H3N的物质的量
(3)将一定量的丙烯(C3H6)、NH3、O2投入恒容密闭容器中,分别在不同的温度和催化剂下进行反应,保持其他初始实验条件不变,经10min测得C3H6气体转化率如图所示。T2温度下两曲线相交,下列说法正确的是

b.在A点时,反应一定未达到平衡
c.增大压强对反应的速率无影响
(4)制丙烯腈的原料之一NH3的化学方程式:N2(g)+3H2(g)
 2NH3(g)。
2NH3(g)。①在恒定温度和恒定压强p(单位:Pa)下进行反应,若N2、H2起始物质的量之比为1∶3,NH3的平衡产率是ω(产率=
 ×100%),用分压代替物质的浓度,计算平衡常数Kp=
×100%),用分压代替物质的浓度,计算平衡常数Kp=②反应N2(g)+3H2(g)
 2NH3(g)达到平衡时,正、逆反应的速率方程分别为v正=k正p(N2)·p1.5(H2)·p-1(NH3),v逆=k逆pα(N2)·pβ(H2)·pγ(NH3),k正、k逆为速率常数,已知Kp=
2NH3(g)达到平衡时,正、逆反应的速率方程分别为v正=k正p(N2)·p1.5(H2)·p-1(NH3),v逆=k逆pα(N2)·pβ(H2)·pγ(NH3),k正、k逆为速率常数,已知Kp=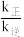 ,据此计算β=
,据此计算β=(5)电解丙烯腈(CH2=CHCN)合成已二腈[NC(CH2)4CN]的原理如图所示:

您最近一年使用:0次



