氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2(难溶于稀硫酸)、Al2O3等,用硫酸渣制备铁红(Fe2O3)的过程如图,回答下列问题: 还有
还有___________ (填离子符号),写出Fe2O3与稀硫酸反应的离子方程式:___________ 。
(2)“还原”过程中加入FeS2粉的目的是将溶液中的Fe3+还原为Fe2+,而FeS2自身被氧化为H2SO4,该反应中氧化剂和还原剂的物质的量之比为___________ 。
(3)“滤渣A”是SiO2,SiO2是一种常见的酸性氧化物,与CO2类似,都可与强碱反应,写出SiO2与NaOH溶液反应的化学方程式:___________ 。
(4)“氧化”时,可观察到的实验现象为___________ 。若加入的NaOH溶液过量,则“滤液B”中的溶质除了NaOH外,还含有___________ ;若加入的NaOH溶液不足,则制得的铁红中含有的杂质为___________ (填化学式)。

 还有
还有(2)“还原”过程中加入FeS2粉的目的是将溶液中的Fe3+还原为Fe2+,而FeS2自身被氧化为H2SO4,该反应中氧化剂和还原剂的物质的量之比为
(3)“滤渣A”是SiO2,SiO2是一种常见的酸性氧化物,与CO2类似,都可与强碱反应,写出SiO2与NaOH溶液反应的化学方程式:
(4)“氧化”时,可观察到的实验现象为
21-22高一上·山西吕梁·期末 查看更多[15]
广东省阳江市江城区部分学校2023-2024学年高一上学期期末联考化学试题河北省秦皇岛市青龙满族自治县实验中学2022-2023学年高一上学期期末考试化学试题湖南省长沙市实验中学2022-2023学年高一上学期期末考试化学试题湖南省株洲市九方中学2022-2023学年高三上学期第四次月考化学试题云南省楚雄州2021-2022学年高一上学期期末教育学业质量监测化学试题湖北省襄阳市第四中学2021-2022学年高一下学期2月考试化学试题安徽省滁州市定远县育才学校2021-2022学年高一下学期5月月考化学试题湖南省衡阳市祁东县2021-2022学年高一上学期期末考试化学试题湖南省长沙市实验中学2021-2022学年高一下学期入学考试化学试题(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)安徽省宣城中学2021-2022学年高一下学期期中考试化学试题湖南省怀化市沅陵县第一中学2021-2022学年高一下学期期中考试化学试题河北省廊坊市2021-2022学年高一上学期期末统一考试化学试题河北省秦皇岛市2021-2022学年高一上学期期末统一考试化学试题山西省吕梁市2021-2022学年高一上学期期末考试化学试题
更新时间:2022-05-06 22:09:52
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】现有无色透明溶液,只含有下列离子中的若干种,每种离的个数相等: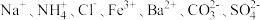 现取三份各100 mL溶液进行实验
现取三份各100 mL溶液进行实验
实验1:第一份加入足量AgNO3溶液有白色沉淀产生;
实验2:第二份加入足量NaOH溶液加热有气体放出;
实验3:第三份加入足量BaCl2溶液后,有沉淀生成,加入足量盐酸后沉淀全部溶解。
(1)由实验1能否确定Cl⁻存在?_________ (填“能”或“否”),理由_______________ 。
(2)由实验2可知该溶液中含有的离子是__________________ 。
(3)实验3中沉淀的化学式为____________ ,该沉淀溶于盐酸的离子方式为_______________ 。
(4)综合上述实验,能否确定有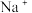 存在?为什么?
存在?为什么?___________ (填“能”或“否”)。
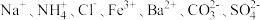 现取三份各100 mL溶液进行实验
现取三份各100 mL溶液进行实验实验1:第一份加入足量AgNO3溶液有白色沉淀产生;
实验2:第二份加入足量NaOH溶液加热有气体放出;
实验3:第三份加入足量BaCl2溶液后,有沉淀生成,加入足量盐酸后沉淀全部溶解。
(1)由实验1能否确定Cl⁻存在?
(2)由实验2可知该溶液中含有的离子是
(3)实验3中沉淀的化学式为
(4)综合上述实验,能否确定有
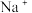 存在?为什么?
存在?为什么?
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】硫酸亚铁铵 的制备是化学、化工、材料专业需要完成的无机化学实验,步骤如下:
的制备是化学、化工、材料专业需要完成的无机化学实验,步骤如下:
Ⅰ.称取0.70 g铁屑放在烧杯中,加入足量3mol·L 的
的 溶液,再加入22mL蒸馏水,在70℃水浴锅中反应50~60 min;
溶液,再加入22mL蒸馏水,在70℃水浴锅中反应50~60 min;
Ⅱ.抽滤,在得到的滤液中添加足量 ,
, 溶解后,用3 mol⋅L
溶解后,用3 mol⋅L 的稀硫酸将溶液pH调至1~2;
的稀硫酸将溶液pH调至1~2;
Ⅲ.再将溶液转移至蒸发皿中,用酒精灯加热蒸发,冷却结晶,抽滤,用无水乙醇洗涤晶体1~2次,所得到的产物质量为3.92 g。
回答下列问题:
(1)“步骤Ⅰ”中铁屑发生反应的离子方程式为___________ ,该步骤要在通风橱中进行,其目的是___________ ;若铁屑中混有少量FeS,需将生成的气体通入 溶液,反应过程中该溶液的pH
溶液,反应过程中该溶液的pH___________ (填“升高”“降低”或“不变”)。
(2)“步骤Ⅱ”中用3 mol⋅L 的稀硫酸将溶液pH调至1~2,其目的是
的稀硫酸将溶液pH调至1~2,其目的是___________ , 时该溶液中
时该溶液中
___________ (实验条件下, 的电离常数
的电离常数 、
、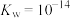 ,保留两位有效数字)。
,保留两位有效数字)。
(3)“步骤Ⅲ”中用酒精灯加热蒸发至___________ 时,停止加热;用无水乙醇洗涤晶体的目的是___________ 。
(4)该实验中硫酸亚铁铵的产率为___________ 。
 的制备是化学、化工、材料专业需要完成的无机化学实验,步骤如下:
的制备是化学、化工、材料专业需要完成的无机化学实验,步骤如下:Ⅰ.称取0.70 g铁屑放在烧杯中,加入足量3mol·L
 的
的 溶液,再加入22mL蒸馏水,在70℃水浴锅中反应50~60 min;
溶液,再加入22mL蒸馏水,在70℃水浴锅中反应50~60 min;Ⅱ.抽滤,在得到的滤液中添加足量
 ,
, 溶解后,用3 mol⋅L
溶解后,用3 mol⋅L 的稀硫酸将溶液pH调至1~2;
的稀硫酸将溶液pH调至1~2;Ⅲ.再将溶液转移至蒸发皿中,用酒精灯加热蒸发,冷却结晶,抽滤,用无水乙醇洗涤晶体1~2次,所得到的产物质量为3.92 g。
回答下列问题:
(1)“步骤Ⅰ”中铁屑发生反应的离子方程式为
 溶液,反应过程中该溶液的pH
溶液,反应过程中该溶液的pH(2)“步骤Ⅱ”中用3 mol⋅L
 的稀硫酸将溶液pH调至1~2,其目的是
的稀硫酸将溶液pH调至1~2,其目的是 时该溶液中
时该溶液中
 的电离常数
的电离常数 、
、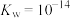 ,保留两位有效数字)。
,保留两位有效数字)。(3)“步骤Ⅲ”中用酒精灯加热蒸发至
(4)该实验中硫酸亚铁铵的产率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】青铜是我国使用最早的合金,其中所含的铬元素能够提高其强度、硬度及耐磨度。使用硫酸亚铁铵滴定法可以测定青铜中铬元素的含量。回答下列问题:
I.配制500mL0.02mol/L的(NH4)2Fe(SO4)2溶液
(1)配制(NH4)2Fe(SO4)2溶液需要的玻璃仪器除烧杯、量筒、玻璃棒外,还有___________ (填仪器名称)。
(2)将3.92g(NH4)2Fe(SO4)2∙6H2O{已知M[(NH4)2Fe(SO4)2∙6H2O]=392 g∙mol-1}固体溶于稀硫酸,再加水稀释。溶于稀硫酸的目的是___________ 。
II.青铜中铬元素含量的测定:
i.称取1.00g青铜样品于250mL锥形瓶中,加入适量稀硝酸使其完全溶解,再加入适量过硫酸铵溶液,加热煮沸,使样品中的铬元素完全被氧化为H2CrO4,加蒸馏水至250mL,摇匀,冷却至室温。
ii.取25mL上述溶液置于锥形瓶中,滴入4滴N-苯代邻氨基苯甲酸指示剂,用0.02mol/L(NH4)2Fe(SO4)2溶液滴定(加入硫酸酸化),当H2CrO4 (弱酸)转化为Cr3+时,溶液由紫红色变为黄绿色,达到滴定终点。
(3)滴定时将(NH4)2Fe(SO4)2溶液加入___________ (填“酸式”或“碱式”)滴定管中,重复四次的实验数据如下表所示,其中第三次读数时滴定管中起始和终点的液面位置如图所示,则
___________ 。

(4)过程ii中发生反应的离子方程式为___________ 。
(5)样品中所含铬元素的质量分数为___________ 。
(6)上述实验过程中,若有部分(NH4)2Fe(SO4)2溶液被空气氧化,则测定结果将___________ (填“偏高”“偏低”或“不变”)。
I.配制500mL0.02mol/L的(NH4)2Fe(SO4)2溶液
(1)配制(NH4)2Fe(SO4)2溶液需要的玻璃仪器除烧杯、量筒、玻璃棒外,还有
(2)将3.92g(NH4)2Fe(SO4)2∙6H2O{已知M[(NH4)2Fe(SO4)2∙6H2O]=392 g∙mol-1}固体溶于稀硫酸,再加水稀释。溶于稀硫酸的目的是
II.青铜中铬元素含量的测定:
i.称取1.00g青铜样品于250mL锥形瓶中,加入适量稀硝酸使其完全溶解,再加入适量过硫酸铵溶液,加热煮沸,使样品中的铬元素完全被氧化为H2CrO4,加蒸馏水至250mL,摇匀,冷却至室温。
ii.取25mL上述溶液置于锥形瓶中,滴入4滴N-苯代邻氨基苯甲酸指示剂,用0.02mol/L(NH4)2Fe(SO4)2溶液滴定(加入硫酸酸化),当H2CrO4 (弱酸)转化为Cr3+时,溶液由紫红色变为黄绿色,达到滴定终点。
(3)滴定时将(NH4)2Fe(SO4)2溶液加入


| 实验序号 | 消耗(NH4)2Fe(SO4)2溶液的体积/mL |
| 1 | 19.98 |
| 2 | 17.97 |
| 3 | x |
| 4 | 18.03 |
(5)样品中所含铬元素的质量分数为
(6)上述实验过程中,若有部分(NH4)2Fe(SO4)2溶液被空气氧化,则测定结果将
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】实验室制备并收集干燥、纯净氯气的装置如图所示。
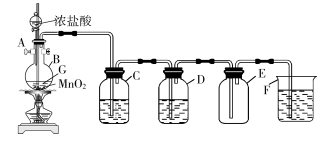
请回答下列问题:
(1)写出实验室制备Cl2的化学方程式:_______ 。
(2)写出指定试剂的名称:C_______ ,D_______ 。
(3)C的作用是_______ ,D的作用是_______ ,F的作用是_______ 。
(4)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用高锰酸钾和浓盐酸反应制备氯气的化学方程式可表示为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,若反应产生0.5 mol Cl2,则消耗的氧化剂的物质的量为_______ mol,反应转移的电子数是_______ 。

请回答下列问题:
(1)写出实验室制备Cl2的化学方程式:
(2)写出指定试剂的名称:C
(3)C的作用是
(4)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用高锰酸钾和浓盐酸反应制备氯气的化学方程式可表示为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,若反应产生0.5 mol Cl2,则消耗的氧化剂的物质的量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】综合利用粉煤灰既有利于环境保护,又有利于资源节约。某种粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)的铝、铁分离工艺流程如下:

(1)“酸浸”时Fe2O3发生反应的离子方程式为___________ 。
(2)当硫酸浓度大于9.2molL1时,铝、铁的浸出率下降。可能原因是___________ 。
(3)有关金属离子以氢氧化物沉淀时离子浓度随pH变化如图所示。“还原”操作加入的试剂为___________ 。“沉铝”过程中加入氨水调pH的范围是___________ ,“沉铝”反应的方程式为___________ 。

(4)“再生”过程中,[Fe(NO)2]2在微生物的作用下与C6H12O6发生反应,生成N2与CO2的物质的量之比为___________ 。

(1)“酸浸”时Fe2O3发生反应的离子方程式为
(2)当硫酸浓度大于9.2molL1时,铝、铁的浸出率下降。可能原因是
(3)有关金属离子以氢氧化物沉淀时离子浓度随pH变化如图所示。“还原”操作加入的试剂为

(4)“再生”过程中,[Fe(NO)2]2在微生物的作用下与C6H12O6发生反应,生成N2与CO2的物质的量之比为
您最近一年使用:0次
【推荐3】NaClO2是一种重要的杀菌消毒剂,其一种生产工艺如图:
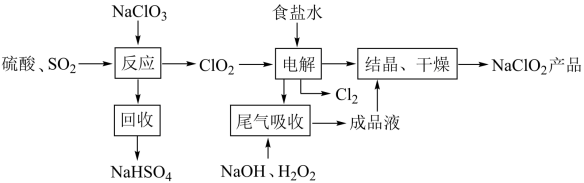
(1)写出“反应”步骤中生成ClO2的化学方程式。___________ 。
(2)“尾气吸收”是吸收“电解”过程排出的少量C1O2,发生如下反应:NaOH+H2O2+ClO2-NaClO2+O2+H2O
①配平化学方程式,并用单线桥表示电子转移方向和数目___________ 。
②此吸收反应中氧化剂与还原剂的质量之比为___________ 。
③比较氧化性: ClO2___________ O2(填 “>”、“<” 或“=”)。
(3)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为___________ g. (计算结果保留两位小数)

(1)写出“反应”步骤中生成ClO2的化学方程式。
(2)“尾气吸收”是吸收“电解”过程排出的少量C1O2,发生如下反应:NaOH+H2O2+ClO2-NaClO2+O2+H2O
①配平化学方程式,并用单线桥表示电子转移方向和数目
②此吸收反应中氧化剂与还原剂的质量之比为
③比较氧化性: ClO2
(3)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
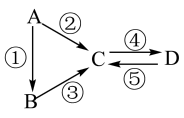
(1)若A是当前最常用的太阳能转换为电能的材料。
(2)C的水溶液俗称水玻璃,D为硅酸。则:写出反应②的化学方程式 。写出反应③的离子方程式 。
(2)若A是应用最广泛的金属。反应①、⑤均用盐酸,D物质是红褐色。则:
写出反应③的化学方程式 。B溶液中加入NaOH溶液的现象是 ,沉淀颜色发生变化对应的化学方程式是 。
C的溶液用于蚀刻印刷铜电路板(铜质),写该反应的离子方程式 。
(3)若D物质是常见的两性氢氧化物,反应②③⑤均要用强碱溶液,反应④是通入过量的CO2。则:反应②的离子方程式为 。反应④的离子方程式为 。

(1)若A是当前最常用的太阳能转换为电能的材料。
(2)C的水溶液俗称水玻璃,D为硅酸。则:写出反应②的化学方程式 。写出反应③的离子方程式 。
(2)若A是应用最广泛的金属。反应①、⑤均用盐酸,D物质是红褐色。则:
写出反应③的化学方程式 。B溶液中加入NaOH溶液的现象是 ,沉淀颜色发生变化对应的化学方程式是 。
C的溶液用于蚀刻印刷铜电路板(铜质),写该反应的离子方程式 。
(3)若D物质是常见的两性氢氧化物,反应②③⑤均要用强碱溶液,反应④是通入过量的CO2。则:反应②的离子方程式为 。反应④的离子方程式为 。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:

请回答下列问题:
(1)玻璃中含有B,刻蚀玻璃的化学方程式为___ 。
(2)沉淀C的成分是___ ,溶液D中存在较多的阴离子是___ 。
(3)步骤③所加入的试剂是___ ,生成沉淀F的离子方程式是___ 。

请回答下列问题:
(1)玻璃中含有B,刻蚀玻璃的化学方程式为
(2)沉淀C的成分是
(3)步骤③所加入的试剂是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】氟碳铈矿(主要成分为 )是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。回答下列问题:
)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。回答下列问题:

(1) 中F的化合价为
中F的化合价为_______ 。操作Ⅰ的名称为_______ 。
(2)氧化焙烧操作不能使用陶瓷容器。原因是_______ (用化学方程式解释)。
(3)焙烧后的产物之一为 ,则酸浸时主要反应的离子方程式为
,则酸浸时主要反应的离子方程式为_______ 。
(4)酸浸时不能用浓盐酸,原因是_______ (结合化学方程式解释)。
(5)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是_______ 。
(6)有机物 能将
能将 从水溶液中提取出来,该过程可表示为
从水溶液中提取出来,该过程可表示为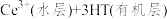
 。试解释向
。试解释向 中加入稀硫酸的作用及其原理:
中加入稀硫酸的作用及其原理:_______ 。
(7)写出向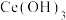 悬浊液中通入氧气得到产品
悬浊液中通入氧气得到产品 的化学方程式:
的化学方程式: _______ 。
 )是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。回答下列问题:
)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。回答下列问题:
(1)
 中F的化合价为
中F的化合价为(2)氧化焙烧操作不能使用陶瓷容器。原因是
(3)焙烧后的产物之一为
 ,则酸浸时主要反应的离子方程式为
,则酸浸时主要反应的离子方程式为(4)酸浸时不能用浓盐酸,原因是
(5)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是
(6)有机物
 能将
能将 从水溶液中提取出来,该过程可表示为
从水溶液中提取出来,该过程可表示为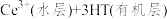
 。试解释向
。试解释向 中加入稀硫酸的作用及其原理:
中加入稀硫酸的作用及其原理:(7)写出向
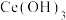 悬浊液中通入氧气得到产品
悬浊液中通入氧气得到产品 的化学方程式:
的化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】普通立德粉(BaSO4·ZnS)常用作颜料。以粗氧化锌(主要成分为ZnO,还含少量CuO、Fe3O4等杂质)和BaS为原料制备立德粉的流程如下:
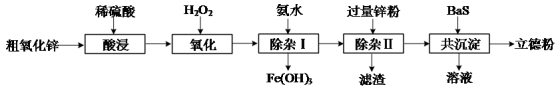
(1)“酸浸”过程中Fe3O4发生反应的离子方程式为______ 。
(2)“氧化”时加入H2O2是为了将Fe2+氧化为Fe3+。检验Fe2+被氧化完全的方法是:取氧化后的溶液少许,加热除去过量的H2O2,______ 。
(3)“除杂Ⅰ”中控制氨水加入量,可使Fe3+沉淀完全,而其他金属离子不沉淀。“除杂Ⅰ”反应的离子方程式为______ 。
(4)“滤渣”的成分是______ 。
(5)“共沉淀”时,ZnSO4与BaS恰好转化为BaSO4·ZnS沉淀。所得溶液中除少量H+外,还含有一种阳离子,检验该阳离子的方法是______ 。
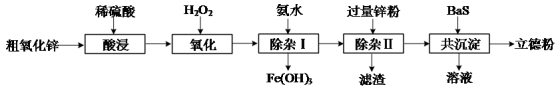
(1)“酸浸”过程中Fe3O4发生反应的离子方程式为
(2)“氧化”时加入H2O2是为了将Fe2+氧化为Fe3+。检验Fe2+被氧化完全的方法是:取氧化后的溶液少许,加热除去过量的H2O2,
(3)“除杂Ⅰ”中控制氨水加入量,可使Fe3+沉淀完全,而其他金属离子不沉淀。“除杂Ⅰ”反应的离子方程式为
(4)“滤渣”的成分是
(5)“共沉淀”时,ZnSO4与BaS恰好转化为BaSO4·ZnS沉淀。所得溶液中除少量H+外,还含有一种阳离子,检验该阳离子的方法是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】资源的回收利用,对可持续发展有着重要意义。某工业废料中主要含 、
、 等,现欲利用如图工业流程回收某些金属资源。
等,现欲利用如图工业流程回收某些金属资源。
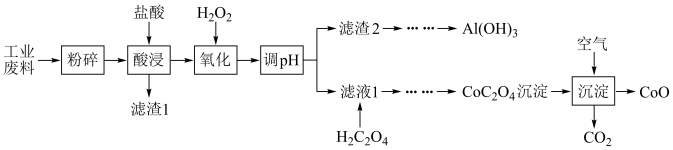
已知:①空气中氧气的体积分数约为20%。回答下列问题:
(1)“粉碎”的目的为___________ ,调节pH后的实验操作是___________ ;
(2)“氧化”的目的是将 氧化为
氧化为 ,其反应的离子方程式为
,其反应的离子方程式为___________ ;“氧化”过程中温度控制在 ,避免温度过高的原因为
,避免温度过高的原因为___________ ;
(3) 的化合物一般都容易被氧化,比如氢氧化亚铁在潮湿的空气中被氧化而发生变色,最终变为
的化合物一般都容易被氧化,比如氢氧化亚铁在潮湿的空气中被氧化而发生变色,最终变为___________ 色,写出其化学方程式___________ ;
(4)新型富钴电池常用到 的化合物
的化合物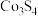 ,其化学性质与
,其化学性质与 相似,则
相似,则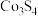 中Co的化合价为
中Co的化合价为___________ ;
(5)“煅烧”反应的化学方程式为___________ ,每制备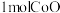 ,至少需要标准状况下的空气体积为
,至少需要标准状况下的空气体积为___________ L。
 、
、 等,现欲利用如图工业流程回收某些金属资源。
等,现欲利用如图工业流程回收某些金属资源。
已知:①空气中氧气的体积分数约为20%。回答下列问题:
(1)“粉碎”的目的为
(2)“氧化”的目的是将
 氧化为
氧化为 ,其反应的离子方程式为
,其反应的离子方程式为 ,避免温度过高的原因为
,避免温度过高的原因为(3)
 的化合物一般都容易被氧化,比如氢氧化亚铁在潮湿的空气中被氧化而发生变色,最终变为
的化合物一般都容易被氧化,比如氢氧化亚铁在潮湿的空气中被氧化而发生变色,最终变为(4)新型富钴电池常用到
 的化合物
的化合物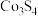 ,其化学性质与
,其化学性质与 相似,则
相似,则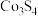 中Co的化合价为
中Co的化合价为(5)“煅烧”反应的化学方程式为
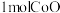 ,至少需要标准状况下的空气体积为
,至少需要标准状况下的空气体积为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】Ⅰ.莫尔盐 是一种常用原料。在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体,为了测定产品纯度,称取a g产品溶于水,配制成500 mL溶液,用浓度为c mol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00 mL,实验结果记录如下
是一种常用原料。在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体,为了测定产品纯度,称取a g产品溶于水,配制成500 mL溶液,用浓度为c mol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00 mL,实验结果记录如下
已知:①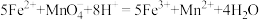
② 的摩尔质量为392 g/mol
的摩尔质量为392 g/mol
(1)滴定终点的现象是_______ ,通过实验数据,计算该产品的纯度为_______ (用含字母a、c的式子表示)。上表中第一次实验的记录数据明显大于后两次,其原因可能是_______ (填字母)。
A.锥形瓶用待装液润洗
B.滴定达到终点时,俯视刻度线读数
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
Ⅱ.实验室由炼钢污泥(简称铁泥,主要成份为铁的氧化物)制备软磁性材料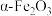 。其主要实验流程如下:
。其主要实验流程如下:

(2)酸浸:用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有_______ (填序号)。
A.适当升高酸浸温度 B.适当加快搅拌速度 C.适当缩短酸浸时间
(3)还原:向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成_______ (填化学式)。
(4)除杂:向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低将会导致CaF2沉淀不完全,其原因是_______ 【 ,
, 】。
】。
(5)沉铁:将提纯后的FeSO4溶液与氨水-NH4HCO3混合溶液反应,生成FeCO3沉淀。
①生成FeCO3沉淀的离子方程式为_______ 。
②设计以FeSO4溶液、氨水-NH4HCO3混合溶液为原料,制备FeCO3的实验方案:_______ 。【FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5】。
 是一种常用原料。在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体,为了测定产品纯度,称取a g产品溶于水,配制成500 mL溶液,用浓度为c mol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00 mL,实验结果记录如下
是一种常用原料。在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体,为了测定产品纯度,称取a g产品溶于水,配制成500 mL溶液,用浓度为c mol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00 mL,实验结果记录如下| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
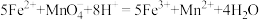
②
 的摩尔质量为392 g/mol
的摩尔质量为392 g/mol(1)滴定终点的现象是
A.锥形瓶用待装液润洗
B.滴定达到终点时,俯视刻度线读数
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
Ⅱ.实验室由炼钢污泥(简称铁泥,主要成份为铁的氧化物)制备软磁性材料
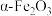 。其主要实验流程如下:
。其主要实验流程如下:
(2)酸浸:用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有
A.适当升高酸浸温度 B.适当加快搅拌速度 C.适当缩短酸浸时间
(3)还原:向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成
(4)除杂:向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低将会导致CaF2沉淀不完全,其原因是
 ,
, 】。
】。(5)沉铁:将提纯后的FeSO4溶液与氨水-NH4HCO3混合溶液反应,生成FeCO3沉淀。
①生成FeCO3沉淀的离子方程式为
②设计以FeSO4溶液、氨水-NH4HCO3混合溶液为原料,制备FeCO3的实验方案:
您最近一年使用:0次



