下列操作或事实不能用勒夏特列原理解释的是
A.2NO2(g) N2O4(g) △H<0,把NO2球浸泡在冰水中,气体颜色变浅 N2O4(g) △H<0,把NO2球浸泡在冰水中,气体颜色变浅 |
| B.用饱和食盐水除去Cl2中的HCl,可减少Cl2的损失 |
C.对CO(g)+NO2(g) CO2(g)+NO(g),平衡体系增大压强可使颜色变深 CO2(g)+NO(g),平衡体系增大压强可使颜色变深 |
| D.向含有Fe(SCN)3的红色溶液中加入铁粉,振荡,溶液颜色变浅或褪去 |
更新时间:2022-11-10 14:59:16
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)  CO(g)+3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压条件下,平衡时CH4的体积分数φ(CH4)与Z和温度T的关系如图所示,下列说法正确的是
CO(g)+3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压条件下,平衡时CH4的体积分数φ(CH4)与Z和温度T的关系如图所示,下列说法正确的是

 CO(g)+3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压条件下,平衡时CH4的体积分数φ(CH4)与Z和温度T的关系如图所示,下列说法正确的是
CO(g)+3H2(g),设起始n(H2O)/n(CH4)=Z,在恒压条件下,平衡时CH4的体积分数φ(CH4)与Z和温度T的关系如图所示,下列说法正确的是
| A.图中X点对应的平衡混合物中n(H2O)/n(CH4)=3 |
| B.图中Z的大小关系为a>3>b |
| C.该反应的焓变ΔH>0 |
| D.温度不变时,增大X点对应的平衡体系的压强后,φ(CH4)减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列实验中“实验内容”与对应“实验现象和结论”的关系都正确的是( )
| 选项 | 实验内容 | 实验现象和结论 |
| A | 向FeCl3+3KSCN Fe(SCN)3+3KCl的溶液平衡体系中加入少量KCl固体 Fe(SCN)3+3KCl的溶液平衡体系中加入少量KCl固体 | 溶液的血红色变浅,说明增加生成物浓度,平衡逆移 |
| B | 分别往甲:4mL0.1mol·L-1、乙:4mL0.2mol·L-1的酸性KMnO4溶液中加入2mL0.1mol·L-1H2C2O4溶液,记录褪色时间 | 乙先褪色,说明反应物浓度越大,反应速率越快,越先褪色 |
| C | 室温下,5mL0.1mol·L-1Na2S2O3溶液中加入5mL0.1mol·L-1稀H2SO4溶液,观察现象 | 溶液立即出现浑浊,说明不可逆反应是瞬间完成的 |
| D | 向饱和硼酸溶液中滴加0.1mol·L-1的Na2CO3溶液 | 无明显现象酸性:H3BO3<H2CO3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】气态醋酸中存在平衡:
 。实验测得压强分别
。实验测得压强分别 和
和 时,上述平衡体系中气体的平均摩尔质量(
时,上述平衡体系中气体的平均摩尔质量(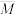 )随温度(T)的变化如下图所示。[已知:(
)随温度(T)的变化如下图所示。[已知:(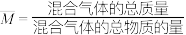 );
); ]
]
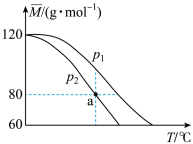
下列说法不正确 的是

 。实验测得压强分别
。实验测得压强分别 和
和 时,上述平衡体系中气体的平均摩尔质量(
时,上述平衡体系中气体的平均摩尔质量(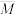 )随温度(T)的变化如下图所示。[已知:(
)随温度(T)的变化如下图所示。[已知:(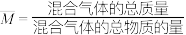 );
); ]
]
下列说法
A. |
B. |
C.a点时,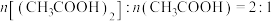 |
D.为了使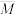 的值接近60,可采取高温、低压的实验条件 的值接近60,可采取高温、低压的实验条件 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】环己烷(C6H12)有椅型、半椅型、船型、扭船型等多种结构,不同结构的势能不同,它们的相对势能如图所示。下列说法不正确的是


| A.上述四种结构中,半椅型结构最不稳定 |
| B.C6H12)(船型)→C6H12)(椅型) △H=-28.9kJ·mol-1 |
| C.相同条件下,椅型转化成扭船型的速率比逆向转化的慢 |
| D.升温不利于椅型转化成扭船型 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】6–羟基己酸( )可通过环已酮、过氧化氢绿色氧化合成,反应历程如图所示,该反应可得到副产物7–氧杂二环[4.1.O]庚烷–2–酮(
)可通过环已酮、过氧化氢绿色氧化合成,反应历程如图所示,该反应可得到副产物7–氧杂二环[4.1.O]庚烷–2–酮( )。下列说法正确的是
)。下列说法正确的是

 )可通过环已酮、过氧化氢绿色氧化合成,反应历程如图所示,该反应可得到副产物7–氧杂二环[4.1.O]庚烷–2–酮(
)可通过环已酮、过氧化氢绿色氧化合成,反应历程如图所示,该反应可得到副产物7–氧杂二环[4.1.O]庚烷–2–酮( )。下列说法正确的是
)。下列说法正确的是
| A.升高温度可提高6–羟基己酸的平衡产率 |
B.决定主产物反应速率的步骤为   |
C. 与 与 互为同分异构体 互为同分异构体 |
| D.升高温度,主反应的反应速率增大的程度更大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】某温度下,密闭容器中发生反应aX(g) bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积扩大到原来容积的两倍,当达到新平衡时,物质Y和Z的浓度均是原来的0.6倍。则下列叙述正确的是
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积扩大到原来容积的两倍,当达到新平衡时,物质Y和Z的浓度均是原来的0.6倍。则下列叙述正确的是
 bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积扩大到原来容积的两倍,当达到新平衡时,物质Y和Z的浓度均是原来的0.6倍。则下列叙述正确的是
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积扩大到原来容积的两倍,当达到新平衡时,物质Y和Z的浓度均是原来的0.6倍。则下列叙述正确的是| A.可逆反应的化学方程式的化学计量数:a<b+c |
| B.扩大容器的容积时,v正增大,v逆减小 |
| C.达到新平衡时,物质X的转化率减小 |
| D.达到新平衡时,混合物中Z的质量分数减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】在一定温度下发生可逆反应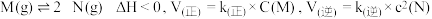 ,若该温度下的平衡常数
,若该温度下的平衡常数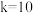 ,下列说法正确的是
,下列说法正确的是
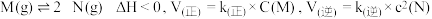 ,若该温度下的平衡常数
,若该温度下的平衡常数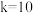 ,下列说法正确的是
,下列说法正确的是A.该温度下 |
| B.升高温度,k(正)增大的倍数大于k(逆)增大的倍数 |
| C.有利于测定N的相对分子质量的条件为高温低压 |
D.恒压条件下,向平衡体系中充入惰性气体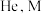 的转化率增大 的转化率增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入AgNO3溶液后溶液颜色变浅 HBr+HBrO,当加入AgNO3溶液后溶液颜色变浅 |
B.对2HI(g) H2(g)+I2(g),增大压强可使平衡体系颜色变深 H2(g)+I2(g),增大压强可使平衡体系颜色变深 |
C.反应CO+NO2 CO2+NO ΔH<0,升高温度可使平衡向逆反应方向移动 CO2+NO ΔH<0,升高温度可使平衡向逆反应方向移动 |
| D.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列说法不正确的是( )
| A.MnO2能加速H2O2的分解,是因为MnO2可以降低反应所需的活化能 |
| B.向橙色的K2Cr2O7溶液中滴加NaOH溶液,溶液颜色变黄,说明化学平衡发生了移动 |
| C.将NO2和N2O4混合气体的平衡体系加压,容器内气体颜色变深,这一事实不能用勒夏特列原理解释 |
D.在密闭容器中,对于反应2A(g)+B(g) 2C(g),增大压强后,平衡混合气的平均相对分子质量减小 2C(g),增大压强后,平衡混合气的平均相对分子质量减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】排水法收集气体实验中,用饱和食盐水代替水收集氯气,可降低氯气 的溶解损失。下列说法不正确的是
| A.Cl2(g)⇌Cl2(aq),增大溶液中 Cl2(aq)浓度可抑制氯气的溶解 |
| B.增大溶液中的 Cl−(aq)浓度,有利于增大 Cl2(aq)浓度,从而抑制氯气的溶解 |
| C.Cl2(aq)+H2O(l)⇌H+(aq)+Cl-(aq)+HClO(aq),饱和食盐水可抑制反应进行 |
| D.若实验中改用碳酸钠溶液代替水收集氯气,亦可减少氯气的损失 |
您最近一年使用:0次




