在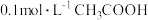 溶液中存在电离平衡:
溶液中存在电离平衡: ,关于该电离平衡的叙述正确的是
,关于该电离平衡的叙述正确的是
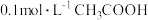 溶液中存在电离平衡:
溶液中存在电离平衡: ,关于该电离平衡的叙述正确的是
,关于该电离平衡的叙述正确的是A.加入少量纯 ,平衡正向移动,醋酸的电离程度增大 ,平衡正向移动,醋酸的电离程度增大 |
B.加入少量 溶液,平衡正向移动,电离平衡常数增大 溶液,平衡正向移动,电离平衡常数增大 |
C.加入少量 盐酸,平衡逆向移动,溶液中 盐酸,平衡逆向移动,溶液中 减小 减小 |
D.加热时,平衡正向移动,溶液 减小,电离平衡常数增大 减小,电离平衡常数增大 |
更新时间:2022-11-12 09:23:23
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】已知联氨(N2H4)为二元弱碱,常温下联氨的水溶液中的电离有:
N2H4+H2O N2H
N2H +OH- K1
+OH- K1
N2H +H2O
+H2O N2H
N2H +OH- K2
+OH- K2
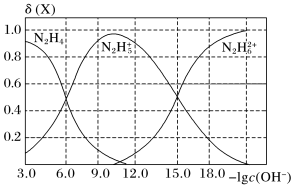
常温下将盐酸滴加到联氨(N2H4)的水溶液中,混合溶液中微粒的物质的量分数δ(X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是
N2H4+H2O
 N2H
N2H +OH- K1
+OH- K1N2H
 +H2O
+H2O N2H
N2H +OH- K2
+OH- K2常温下将盐酸滴加到联氨(N2H4)的水溶液中,混合溶液中微粒的物质的量分数δ(X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是

A.反应N2H4+H+ N2H N2H 的K≈108 的K≈108 |
B.N2H 的电离程度小于N2H 的电离程度小于N2H 的水解程度 的水解程度 |
C.N2H6Cl2溶液中存在:2c(Cl-)=c(N2H )+c(N2H )+c(N2H )+c(N2H4) )+c(N2H4) |
D.N2H5Cl溶液中,存在:c(Cl-)>c(N2H )+2c(N2H )+2c(N2H ) ) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】常温下,下列有关电解质溶液的叙述正确的是
| A.向0.1mol·L-1的HF溶液中演加NaOH溶液至中性:c(Na+)=c(F-)=c(H+)=c(OH-) |
B.0.1mol·L-1的H2C2O4溶液中:c(HC2O )>c(H2C2O4)>c(C2O )>c(H2C2O4)>c(C2O ) ) |
| C.0.1mol·L-1的NaHS溶液中:c(HS-)+c(S2-)=0.1mol·L-1 |
D.0.1mol·L-1的NH4H2PO4溶液中:c(H+)+c(H3PO4)>c(NH3·H2O)+c(HPO )+c(PO )+c(PO ) ) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】醋酸的电离方程式为
 。25 ℃时,
。25 ℃时, 醋酸溶液中存在下述关系:
醋酸溶液中存在下述关系: ,其数值是该温度下醋酸的电离平衡常数(Ka)。下列说法不正确的是
,其数值是该温度下醋酸的电离平衡常数(Ka)。下列说法不正确的是

 。25 ℃时,
。25 ℃时, 醋酸溶液中存在下述关系:
醋酸溶液中存在下述关系: ,其数值是该温度下醋酸的电离平衡常数(Ka)。下列说法不正确的是
,其数值是该温度下醋酸的电离平衡常数(Ka)。下列说法不正确的是A. 的 的 溶液中的 溶液中的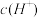 约为 约为 |
B.等物质的量浓度的 溶液与 溶液与 溶液(25 ℃时, 溶液(25 ℃时,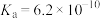 ),则 ),则 |
C.该温度下 醋酸溶液 醋酸溶液 |
D.升高温度, 增大, 增大, 变大 变大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下,pH=11的X、Y两种碱溶液各5 mL,分别加水稀释至500 mL,其pH与溶液的体积(V)的关系如图所示。下列说法正确的是


| A.Y溶液的导电性比X溶液的导电性强 |
| B.稀释后,X溶液中水的电离程度比Y溶液中水的电离程度小 |
| C.若X、Y都是弱碱,则a的值一定小于9 |
| D.完全中和X、Y两溶液时,消耗同浓度稀硫酸的体积:V(X)>V(Y) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列说法正确的是
| A.向氨水中加水稀释后,溶液中除了H2O以外其他粒子浓度都下降 |
B.若NaHC2O4溶液的pH=5,则溶液中c( )<c(H2C2O4) )<c(H2C2O4) |
| C.pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原溶液体积的m倍和n倍,若稀释后两溶液的pH仍相同,则m<n |
| D.pH=4的氯化铵溶液与pH=4的稀盐酸中,由水电离出的c(H+)之比为106∶1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】已知物质的相关数据如下表,下列说法正确的是
| 物质 |  |  |  |  |
| 相关数据 | 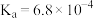 |  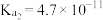 |  |  |
A. 不与盐酸溶液反应 不与盐酸溶液反应 |
B. 溶液中存在的所有微粒有: 溶液中存在的所有微粒有: |
C. 与碳酸钠溶液反应,可能产生气体 与碳酸钠溶液反应,可能产生气体 |
D.向石灰水悬浊液中加入 溶液,溶液可能变澄清 溶液,溶液可能变澄清 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】25℃时,将浓度均为 的
的 溶液和
溶液和 溶液按体积分别为Va和Vb混合,保持
溶液按体积分别为Va和Vb混合,保持 ,且生成的
,且生成的 可溶于水。已知
可溶于水。已知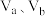 与混合液pH关系如图。下列说法错误的是( )
与混合液pH关系如图。下列说法错误的是( )

 的
的 溶液和
溶液和 溶液按体积分别为Va和Vb混合,保持
溶液按体积分别为Va和Vb混合,保持 ,且生成的
,且生成的 可溶于水。已知
可溶于水。已知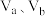 与混合液pH关系如图。下列说法错误的是( )
与混合液pH关系如图。下列说法错误的是( )
A.曲线Ⅰ表示 溶液体积 溶液体积 | B. 点存在 点存在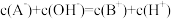 |
C.电离平衡常数 | D.向 点溶液加入 点溶液加入 ,水的电离程度减小 ,水的电离程度减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】室温下,下列实验探究方案能达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 向盛有KBr溶液的试管中滴加几滴新制氯水,再加入CCl4溶液,振荡、静置,观察CCl4层颜色 | Cl2的氧化性比Br2的强 |
| B | 向盛有SO2水溶液的试管中滴加几滴酸性KMnO4溶液,观察溶液颜色变化 | SO2具有漂白性 |
| C | 向久置的FeSO4溶液中滴加几滴KSCN溶液,振荡,观察溶液颜色变化 | FeSO4已全部变质 |
| D | 用pH试纸测得:CH3COONa溶液的pH约为9,NaNO2溶液的pH约为8 | HNO2电离出H+的能力比CH3COOH的强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】某浓度的氨水中存在下列平衡:NH3•H2O
 +OH-,若想增大
+OH-,若想增大 的浓度,而不增加OH-的浓度,应采取的措施是
的浓度,而不增加OH-的浓度,应采取的措施是
①适当升高温度②加入NH4Cl固体③通入NH3 ④通入少量氯化氢气体

 +OH-,若想增大
+OH-,若想增大 的浓度,而不增加OH-的浓度,应采取的措施是
的浓度,而不增加OH-的浓度,应采取的措施是①适当升高温度②加入NH4Cl固体③通入NH3 ④通入少量氯化氢气体
| A.①② | B.②④ | C.③④ | D.②③ |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】常温下,若要使0.01mol/L的H2S溶液pH值减小的同时c(S2﹣)也减小,可采取的措施是( )
| A.加入少量的NaOH固体 | B.通入少量的Cl2 |
| C.通入少量的SO2 | D.通入少量的O2 |
您最近一年使用:0次

 H++A-,下列叙述不正确的是:
H++A-,下列叙述不正确的是:

