土壤的酸碱性对农作物的生长十分重要,但各种自然或人为因素可能导致土壤的酸碱失衡。
(1)①矿石暴露在空气中缓慢氧化并产生无机酸是土壤酸化的原因之一,例如黄铁矿 在空气中会缓慢生成氧化铁和一种强酸,写出该过程的化学方程式:
在空气中会缓慢生成氧化铁和一种强酸,写出该过程的化学方程式:_______ 。
②微生物和细菌,在通风良好的情况下,可以把土壤中的 氧化为
氧化为 (一种弱酸)写出反应的离子方程式:
(一种弱酸)写出反应的离子方程式:_______ 。
③酸雨是加重土壤酸化的人为原因,下面哪些做法能减少酸雨的发生_______ ?
A.燃煤进行脱硫处理
B.通过植树造林,节能减排等形式,推行碳中和理念
C.推行新能源汽车,减少燃油车比例
D.减少含磷洗涤剂的使用
(2)过多的 会导致土壤呈碱性,是盐碱地形成的原因之一、
会导致土壤呈碱性,是盐碱地形成的原因之一、
①可以用 改良盐碱地(用化学方程式表示):
改良盐碱地(用化学方程式表示):_______ 。
②农业上还可以用 进行化学改良,反应得到
进行化学改良,反应得到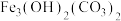 ,写出该过程的离子方程式:
,写出该过程的离子方程式:_______ 。
(1)①矿石暴露在空气中缓慢氧化并产生无机酸是土壤酸化的原因之一,例如黄铁矿
 在空气中会缓慢生成氧化铁和一种强酸,写出该过程的化学方程式:
在空气中会缓慢生成氧化铁和一种强酸,写出该过程的化学方程式:②微生物和细菌,在通风良好的情况下,可以把土壤中的
 氧化为
氧化为 (一种弱酸)写出反应的离子方程式:
(一种弱酸)写出反应的离子方程式:③酸雨是加重土壤酸化的人为原因,下面哪些做法能减少酸雨的发生
A.燃煤进行脱硫处理
B.通过植树造林,节能减排等形式,推行碳中和理念
C.推行新能源汽车,减少燃油车比例
D.减少含磷洗涤剂的使用
(2)过多的
 会导致土壤呈碱性,是盐碱地形成的原因之一、
会导致土壤呈碱性,是盐碱地形成的原因之一、①可以用
 改良盐碱地(用化学方程式表示):
改良盐碱地(用化学方程式表示):②农业上还可以用
 进行化学改良,反应得到
进行化学改良,反应得到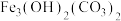 ,写出该过程的离子方程式:
,写出该过程的离子方程式:
更新时间:2022/11/11 22:25:12
|
相似题推荐
【推荐1】Ⅰ.已知某反应中反应物和生成物有:KMnO4、H2SO4、MnSO4、H2C2O4、K2SO4、H2O和一种未知物X。
(1)已知0.5 molH2C2O4在反应中失去1 mol电子生成X,则X的化学式为______________ 。
(2)将氧化剂和还原剂及配平的系数填入下列方框中,并用单线桥标出电子转移的方向和数目。___________________________
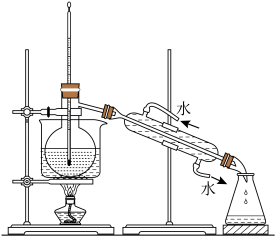
Ⅱ.工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。从工业废水中回收硫酸亚铁和金属铜的工艺流程如图所示。______________ ;操作③为_______________________________ 。
(2)试剂X为______ (填化学式),操作②涉及的离子反应方程式为___________________ 。
(1)已知0.5 molH2C2O4在反应中失去1 mol电子生成X,则X的化学式为
(2)将氧化剂和还原剂及配平的系数填入下列方框中,并用单线桥标出电子转移的方向和数目。
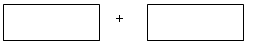
Ⅱ.工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。从工业废水中回收硫酸亚铁和金属铜的工艺流程如图所示。
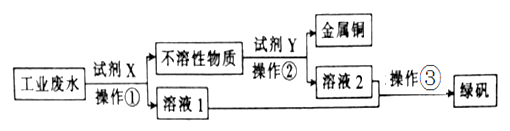
(2)试剂X为
您最近一年使用:0次
填空题
|
适中
(0.65)
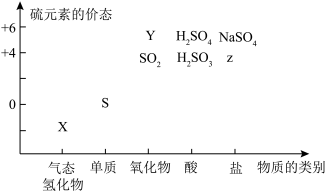
【推荐2】物质的类别和核心元素的化合价是研究物质性质的两个基本视角。______ 。
(2)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体.则治理烟道气反应的化学方程式为____________________________ 。
(3)实验室中X气体由不溶性的硫化亚铁(FeS)固体和稀硫酸混合反应制得,该反应的离子方程式为:_____________________________________________ 。
(4)Na2S2O3(硫代硫酸钠)是一种用途广泛的钠盐。
①下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是___ 。
a.Na2S+S b.Z+S c.Na2SO3+Y d.NaHS+NaHSO3
②Na2S2O3具有较强还原性,能作为织锦物漂白后的脱氯剂,脱氯后S2O32-转变为SO42-。 现需处理含标准状况下Cl2 2.24L的织锦物,理论上需要0.00100mol/L Na2S2O3溶液的体积为_______ L。
(2)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体.则治理烟道气反应的化学方程式为
(3)实验室中X气体由不溶性的硫化亚铁(FeS)固体和稀硫酸混合反应制得,该反应的离子方程式为:
(4)Na2S2O3(硫代硫酸钠)是一种用途广泛的钠盐。
①下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是
a.Na2S+S b.Z+S c.Na2SO3+Y d.NaHS+NaHSO3
②Na2S2O3具有较强还原性,能作为织锦物漂白后的脱氯剂,脱氯后S2O32-转变为SO42-。 现需处理含标准状况下Cl2 2.24L的织锦物,理论上需要0.00100mol/L Na2S2O3溶液的体积为
您最近一年使用:0次
【推荐3】氧化还原反应在物质制备、能量转化方面有重要的应用。
⑴反应I2+2Na2S2O3=Na2S4O6+2NaI常用于测定溶液中I2的含量。反应的氧化剂是________ ,每生成1molNa2S4O6,反应转移电子为________ mol。
⑵ClO2是一种新型净水剂,一种制取ClO2的反应如下:
KClO3+HCl(浓)-KCl+Cl2↑+ClO2↑+H2O(未配平)
写出配平后的方程式:________ 。
⑶某氧化还原反应中共包含下列物质:Fe2(SO4)3、H2SO4、CrO3、FeSO4、Cr2(SO4)3和H2O。已知CrO3为反应物之一。写出配平后的方程式:________ 。
⑴反应I2+2Na2S2O3=Na2S4O6+2NaI常用于测定溶液中I2的含量。反应的氧化剂是
⑵ClO2是一种新型净水剂,一种制取ClO2的反应如下:
KClO3+HCl(浓)-KCl+Cl2↑+ClO2↑+H2O(未配平)
写出配平后的方程式:
⑶某氧化还原反应中共包含下列物质:Fe2(SO4)3、H2SO4、CrO3、FeSO4、Cr2(SO4)3和H2O。已知CrO3为反应物之一。写出配平后的方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】硫是生命的必须元素,在自然界的循环中具有重要意义

(1)火山口附近 和
和 反应会产生硫单质,其中
反应会产生硫单质,其中 体现
体现___________ 性(填“氧化”或“还原”)。
(2)大气中的 会形成酸雨,相关的化学方程式为
会形成酸雨,相关的化学方程式为___________ 。
(3)大气中的水蒸气在紫外线作用下会转化成活泼的 (羟基自由基,“·”表示1个电子)。
(羟基自由基,“·”表示1个电子)。 可以看成催化剂,将
可以看成催化剂,将 转化为
转化为 ,过程如下:
,过程如下:
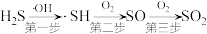
则第一步反应和第二步反应的方程式为___________ 、___________ 。
(4)土壤中的黄铁矿(主要成分是 )在细菌的作用下发生转化。请将该反应的方程式补充完整。
)在细菌的作用下发生转化。请将该反应的方程式补充完整。___________
 。
。
(5)结合溶解平衡理论解释图中ZnS转化为铜蓝色的原因___________ 。

(1)火山口附近
 和
和 反应会产生硫单质,其中
反应会产生硫单质,其中 体现
体现(2)大气中的
 会形成酸雨,相关的化学方程式为
会形成酸雨,相关的化学方程式为(3)大气中的水蒸气在紫外线作用下会转化成活泼的
 (羟基自由基,“·”表示1个电子)。
(羟基自由基,“·”表示1个电子)。 可以看成催化剂,将
可以看成催化剂,将 转化为
转化为 ,过程如下:
,过程如下: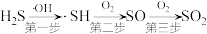
则第一步反应和第二步反应的方程式为
(4)土壤中的黄铁矿(主要成分是
 )在细菌的作用下发生转化。请将该反应的方程式补充完整。
)在细菌的作用下发生转化。请将该反应的方程式补充完整。 。
。(5)结合溶解平衡理论解释图中ZnS转化为铜蓝色的原因
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】酸雨形成的原理之一如下:
含硫燃料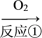 A
A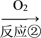 B
B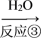 硫酸
硫酸
请回答下列问题:
(1)A物质的化学式为________ ,B物质的化学式为________ 。
(2)三个反应中,不属于氧化还原反应的是________ (填序号)。
(3)SO2中硫元素显+4价,它可以降低到0价,利用这一性质可在工厂的烟道气中通入合适的________ (填“氧化剂”或“还原剂”)除去SO2,达到减少污染的目的。
(4)火力发电厂燃烧的煤中含有大量的硫,其排出的废气中往往含有SO2、O2、N2、CO2等。为了除去有害的SO2气体,在英国已进行了一个研究,结果表明:高烟囱可以有效降低地面SO2的浓度。在20世纪60年代到70年代的10年间,由发电厂排放的SO2增加了35%,但由于高烟囱的建造,地面SO2浓度降低了30%之多。
①你认为减少酸雨产生的途径可采取的措施是________ 。
A.少用煤作燃料 B.把工厂的烟囱造高
C.燃料脱硫 D.把工厂迁移到农村
E.开发新能源
②请从全球环境保护的角度,分析这种建高烟囱的方法是否可取?________ ,理由是______________________________ 。
含硫燃料
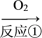 A
A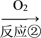 B
B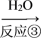 硫酸
硫酸请回答下列问题:
(1)A物质的化学式为
(2)三个反应中,不属于氧化还原反应的是
(3)SO2中硫元素显+4价,它可以降低到0价,利用这一性质可在工厂的烟道气中通入合适的
(4)火力发电厂燃烧的煤中含有大量的硫,其排出的废气中往往含有SO2、O2、N2、CO2等。为了除去有害的SO2气体,在英国已进行了一个研究,结果表明:高烟囱可以有效降低地面SO2的浓度。在20世纪60年代到70年代的10年间,由发电厂排放的SO2增加了35%,但由于高烟囱的建造,地面SO2浓度降低了30%之多。
①你认为减少酸雨产生的途径可采取的措施是
A.少用煤作燃料 B.把工厂的烟囱造高
C.燃料脱硫 D.把工厂迁移到农村
E.开发新能源
②请从全球环境保护的角度,分析这种建高烟囱的方法是否可取?
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】化学与我们的生活、生产、环境、资源利用等息息相关。回答下列问题:
(1)大气中下列气体含量的升高会对环境产生一定的影响,用物质的序号填空,过量会导致温室效应加剧的主要物质是_______ ,会造成酸雨的物质是_______ ,会导致光化学烟雾的物质是_______ 。
①二氧化碳 ②二氧化硫 ③氮氧化物NOx
(2)电子工业常用质量分数为30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。写出FeCl3溶液与铜反应的离子方程式_______ 。
(3)饮用水消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂白粉是常用的消 毒剂,其有效成分是_______ (填化学式)。Cl2是传统的自来水消毒剂,而ClO2是新型的自来水消毒剂,这两种消毒剂消毒完成后,氯元素均以Cl—形式存在。现要消毒1.00 m3生活污水,分别用Cl2和ClO2来消毒处理,所耗Cl2与ClO2的质量比值为 _______ (保留小数点后2位)。
(1)大气中下列气体含量的升高会对环境产生一定的影响,用物质的序号填空,过量会导致温室效应加剧的主要物质是
①二氧化碳 ②二氧化硫 ③氮氧化物NOx
(2)电子工业常用质量分数为30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。写出FeCl3溶液与铜反应的离子方程式
(3)饮用水消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂白粉是常用的消 毒剂,其有效成分是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】1.(1)泡沫灭火器的灭火原理是(用离子方程式表示)_____________________ 。
(2)①已知T℃时,Kw=1×10-12,在该温度时,将pH=9的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a:b=____ 。
②某二元酸(用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA- ⇌H++A2-,则NaHA溶液中,写出符合原子(物料)守恒的各粒子浓度关系的等式_____________
(3)pH=2的两种一元酸HA和HB,体积均为100 mL,稀释过程中pH与溶液体积的关系如图。
①则NaB水溶液是否呈中性?原因?______________ (用离子方程式表示)。
②用NaOH溶液滴定HB溶液,指示剂宜选择_________ ,滴定终点现象为____________ 。
A.甲基橙 B.酚酞 C.石蕊
(4)NaHSO3溶液呈酸性,则溶液中,各离子浓度由大到小的顺序为____________ 。
(2)①已知T℃时,Kw=1×10-12,在该温度时,将pH=9的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a:b=
②某二元酸(用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA- ⇌H++A2-,则NaHA溶液中,写出符合原子(物料)守恒的各粒子浓度关系的等式
(3)pH=2的两种一元酸HA和HB,体积均为100 mL,稀释过程中pH与溶液体积的关系如图。
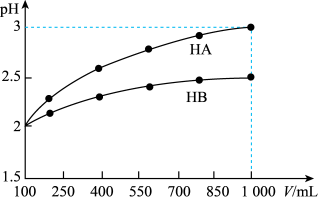
①则NaB水溶液是否呈中性?原因?
②用NaOH溶液滴定HB溶液,指示剂宜选择
A.甲基橙 B.酚酞 C.石蕊
(4)NaHSO3溶液呈酸性,则溶液中,各离子浓度由大到小的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】肼(N2H4),又称为联氨,溶于水呈碱性,类似于氨气,已知N2H4在水溶液中的电离方程式:N2H4+H2O⇌ +OH-,
+OH-, +H2O⇌
+H2O⇌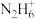 +OH-。常温下,将盐酸滴加到联氨(N2H4)的水溶液中,混合溶液中pOH[pOH=-lgc(OH-) ]随离子浓度变化的关系如图所示。
+OH-。常温下,将盐酸滴加到联氨(N2H4)的水溶液中,混合溶液中pOH[pOH=-lgc(OH-) ]随离子浓度变化的关系如图所示。
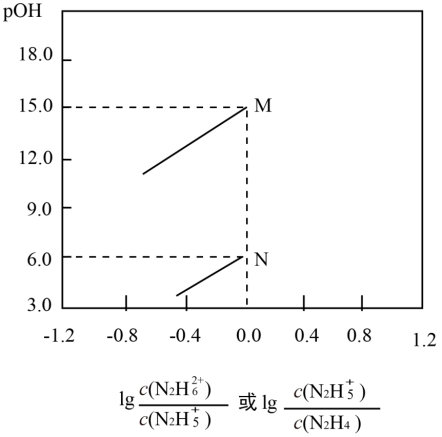
(1)表示pH与 的变化关系
的变化关系____ (M 或N)。
(2) 水解方程式为
水解方程式为__________________ 。
(3) N2H5Cl的水溶液呈_________ (“酸性”、“碱性”、“中性”)。
(4)反应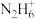 + N2H4⇌2
+ N2H4⇌2 的平衡常数K=
的平衡常数K=___________ 。
 +OH-,
+OH-, +H2O⇌
+H2O⇌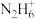 +OH-。常温下,将盐酸滴加到联氨(N2H4)的水溶液中,混合溶液中pOH[pOH=-lgc(OH-) ]随离子浓度变化的关系如图所示。
+OH-。常温下,将盐酸滴加到联氨(N2H4)的水溶液中,混合溶液中pOH[pOH=-lgc(OH-) ]随离子浓度变化的关系如图所示。
(1)表示pH与
 的变化关系
的变化关系(2)
 水解方程式为
水解方程式为(3) N2H5Cl的水溶液呈
(4)反应
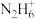 + N2H4⇌2
+ N2H4⇌2 的平衡常数K=
的平衡常数K=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题:
(1)正交硫和单斜硫是硫常见的两种单质,它们互为_______ 。已知: (正交)
(正交) (单斜)
(单斜)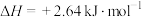 。正交硫与单斜硫相比,相对比较稳定的是
。正交硫与单斜硫相比,相对比较稳定的是_______ 。
(2)通常状况下4 g硫粉完全燃烧放出37 kJ的热量,写出反应的热化学方程式_______ 。
(3)同温同浓度的 、
、 、
、 三种溶液,
三种溶液, 最大的是
最大的是_______ ;经测定 溶液中
溶液中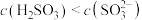 ,则
,则 溶液呈
溶液呈_______ (填“酸”或“碱”)性;
(4)等物质的量浓度的下列3种溶液:① ②
②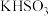 ③
③ ,溶液中水的电离程度由大到小排列顺序为
,溶液中水的电离程度由大到小排列顺序为_______ 。
(1)正交硫和单斜硫是硫常见的两种单质,它们互为
 (正交)
(正交) (单斜)
(单斜)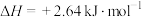 。正交硫与单斜硫相比,相对比较稳定的是
。正交硫与单斜硫相比,相对比较稳定的是(2)通常状况下4 g硫粉完全燃烧放出37 kJ的热量,写出反应的热化学方程式
(3)同温同浓度的
 、
、 、
、 三种溶液,
三种溶液, 最大的是
最大的是 溶液中
溶液中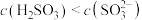 ,则
,则 溶液呈
溶液呈(4)等物质的量浓度的下列3种溶液:①
 ②
②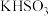 ③
③ ,溶液中水的电离程度由大到小排列顺序为
,溶液中水的电离程度由大到小排列顺序为
您最近一年使用:0次



