碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:

回答下列问题:
(1)金刚石、石墨、C60.、碳纳米管等都是碳元素的单质形式,它们互为_______ 。
(2)石墨烯(指单层石墨)中碳原子的杂化形式_______ 。
(3)C60属于_______ 晶体。
(4)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C-C间的σ键,而石墨层内的C-C间不仅存在σ键,还有_______ 键。
(5)若金刚石晶胞的晶胞参数a=365.6 pm,其密度为_______ g·cm-3(列出计算式即可)。
(6)Ge与C是同族元素,比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_______ 。
(7)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。

①关于这两种晶体的说法,正确的是_______ (填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键 d.两种晶体均为分子晶体
② NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一、1molNH4BF4含有_______ mol配位键。

回答下列问题:
(1)金刚石、石墨、C60.、碳纳米管等都是碳元素的单质形式,它们互为
(2)石墨烯(指单层石墨)中碳原子的杂化形式
(3)C60属于
(4)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C-C间的σ键,而石墨层内的C-C间不仅存在σ键,还有
(5)若金刚石晶胞的晶胞参数a=365.6 pm,其密度为
(6)Ge与C是同族元素,比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(7)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。

①关于这两种晶体的说法,正确的是
a.立方相氮化硼含有σ键和π键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键 d.两种晶体均为分子晶体
② NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一、1molNH4BF4含有
更新时间:2022-10-24 19:39:58
|
相似题推荐
【推荐1】已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数比为1∶1的化合物N是常见的有机溶剂。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的基态原子的外围电子排布式为___ 。
(2)由A、B、C形成的ABC分子中,含有___ 个σ键,___ 个π键。
(3)B、C、D三种元素的第一电离能由小到大的顺序为___ 。
(4)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为ECl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1∶5,则该配离子的化学式为___ 。
(1)E的基态原子的外围电子排布式为
(2)由A、B、C形成的ABC分子中,含有
(3)B、C、D三种元素的第一电离能由小到大的顺序为
(4)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为ECl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1∶5,则该配离子的化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题
(1)“棕色环”现象是检验溶液中 的一种方法。向含有
的一种方法。向含有 溶液的试管中加入
溶液的试管中加入 ,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为
,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为 。
。
① 中N元素采取
中N元素采取________ 杂化,其立体构型为________ (填名称);
② 中一种配体实际上是
中一种配体实际上是 ,则其中Fe元素的化合价为
,则其中Fe元素的化合价为________ ;写出 的一种等电子体的化学式
的一种等电子体的化学式________ ;
③ 中微粒间不存在的作用力有
中微粒间不存在的作用力有________ ;
a.极性键 b.非极性键 c.σ键 d.π键 c.配位键 f.离子键
④ 与
与 等金属离子形成的配合物中配位原子一般是S而不是N,其原因是
等金属离子形成的配合物中配位原子一般是S而不是N,其原因是________ 。
(2)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子轨道表示式为________ ; 可发生水解反应,机理如下。含s、p、d轨道的杂化类型有A.
可发生水解反应,机理如下。含s、p、d轨道的杂化类型有A. 、B.
、B. 、C.
、C. ,中间体
,中间体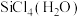 中Si采取的杂化类型为
中Si采取的杂化类型为________ (填字母)。________ ;
②分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。请问噻吩中的大π键表示为
)。请问噻吩中的大π键表示为________ 。
(4)最简单的硼烷是 ,其分子结构如下左图,B原子的杂化方式为
,其分子结构如下左图,B原子的杂化方式为________ 。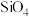 ]四面体(如右上图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,其钠盐的化学式为
]四面体(如右上图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,其钠盐的化学式为________ 。 熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。则
熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。则 熔融的电离方程式为
熔融的电离方程式为________ 。
(1)“棕色环”现象是检验溶液中
 的一种方法。向含有
的一种方法。向含有 溶液的试管中加入
溶液的试管中加入 ,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为
,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为 。
。①
 中N元素采取
中N元素采取②
 中一种配体实际上是
中一种配体实际上是 ,则其中Fe元素的化合价为
,则其中Fe元素的化合价为 的一种等电子体的化学式
的一种等电子体的化学式③
 中微粒间不存在的作用力有
中微粒间不存在的作用力有a.极性键 b.非极性键 c.σ键 d.π键 c.配位键 f.离子键
④
 与
与 等金属离子形成的配合物中配位原子一般是S而不是N,其原因是
等金属离子形成的配合物中配位原子一般是S而不是N,其原因是(2)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子轨道表示式为
 可发生水解反应,机理如下。含s、p、d轨道的杂化类型有A.
可发生水解反应,机理如下。含s、p、d轨道的杂化类型有A. 、B.
、B. 、C.
、C. ,中间体
,中间体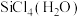 中Si采取的杂化类型为
中Si采取的杂化类型为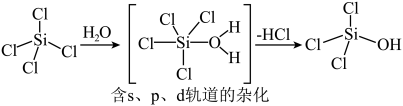
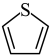
②分子中的大π键可以用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。请问噻吩中的大π键表示为
)。请问噻吩中的大π键表示为(4)最简单的硼烷是
 ,其分子结构如下左图,B原子的杂化方式为
,其分子结构如下左图,B原子的杂化方式为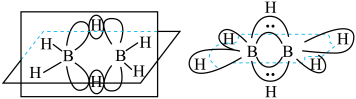
 ]四面体(如右上图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,其钠盐的化学式为
]四面体(如右上图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,其钠盐的化学式为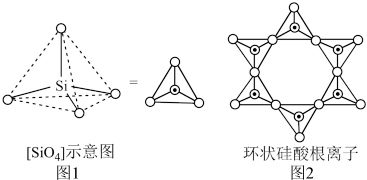
 熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。则
熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。则 熔融的电离方程式为
熔融的电离方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】a、b、c、d为四种由短周期元素构成的中性粒子,它们都有14个电子,且除a外都是共价型分子。回答下列问题:
(1)a是单核粒子,a单质可用作半导体材料,a所形成的晶体类型为___________ 晶体。
(2)b是双核化合物,常温下为无色无味气体,则b的化学式为___________ 。
(3)c是双核单质,写出其电子式:___________ 。c分子中所含共价键的类型为___________ (填“极性键”或“非极性键”)。物质c与氢气反应所生成的氢化物易溶于水的原因是___________ (写一条即可)。
(4)d是四核化合物,其结构式为___________ ;d分子内所含共价键 键与
键与 键个数比为
键个数比为___________ ;d分子的空间结构为___________ 。
(1)a是单核粒子,a单质可用作半导体材料,a所形成的晶体类型为
(2)b是双核化合物,常温下为无色无味气体,则b的化学式为
(3)c是双核单质,写出其电子式:
(4)d是四核化合物,其结构式为
 键与
键与 键个数比为
键个数比为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】X、Y、Z、M、R是原子序数依次增大的短周期主族元素,X在周期表中原子半径最小,Y与Z相邻,Z、R在地壳中的含量位列前两位,M为短周期中电负性最小的元素。请回答:
(1)基态Z原子的外围电子排布图为____________ 。
(2)X与Y能形成多种化合物,其中Y2X2分子中σ键、π键的数目之比为_______ 。
(3)在R3Y4晶体中键角:Y-R-Y____ R-Y-R(填“>”“<”或“=”),原因为________ 。
(4)钨(W)元素可以和Z、M形成多种化合物,其中一种化合物的晶体结构如图:
已知:相邻Z原子的核间距为apm,钨原子位于Z原子形成的正八面体的体心,M离子位于钨原子形成的立方体的体心。
①与M原子距离最近且相等的Z原子的数目为_________ 。
②晶体的化学式为__________ 。
③设NA为阿伏伽德罗常数的值,则晶体的密度为______ g/cm3(列出表达式)。
(1)基态Z原子的外围电子排布图为
(2)X与Y能形成多种化合物,其中Y2X2分子中σ键、π键的数目之比为
(3)在R3Y4晶体中键角:Y-R-Y
(4)钨(W)元素可以和Z、M形成多种化合物,其中一种化合物的晶体结构如图:

已知:相邻Z原子的核间距为apm,钨原子位于Z原子形成的正八面体的体心,M离子位于钨原子形成的立方体的体心。
①与M原子距离最近且相等的Z原子的数目为
②晶体的化学式为
③设NA为阿伏伽德罗常数的值,则晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】X、Y、Z、M、Q、R是元素周期表前四周期的元素,且原子序数依次增大,其相关信息如表所示:
(1)写出元素Q的基态原子的外围电子轨道表示式是 _______ 。
(2)X、Y、Z三种元素的电负性小到大的顺序是_______ (用元素符号表示)。
(3)M元素基态原子中能量最高的电子的电子云在空间有_______ 个伸展方向,原子轨道呈_______ 形。
(4)小范同学写了某基态原子的两个价电子的表达式,分析其分别违背了什么原理:
① :
:_______ ;
②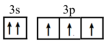 :
:_______ 。
(5)在XH3及ZH3两种分子中,键角XH3_______ MH3(添“>”或“<”) 原因是_______ 。
| 元素 | 相关信息 |
| X | 原子核外有7种不同运动状态的电子 |
| Y | 基态原子中最高能级上有两个未成对电子 |
| Z | 形成的气态氢化物空间构型为三角锥形 |
| M | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
| Q | 前4周期元素原子核外电子排布中未成对电子数最多的元素 |
| R | 基态原子核外有7个能级上有电子且能量最高的能级上有6个电子 |
(2)X、Y、Z三种元素的电负性小到大的顺序是
(3)M元素基态原子中能量最高的电子的电子云在空间有
(4)小范同学写了某基态原子的两个价电子的表达式,分析其分别违背了什么原理:
①
 :
:②
 :
:(5)在XH3及ZH3两种分子中,键角XH3
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】按要求回答下列问题:
(1)根据价层电子对互斥模型,H2S 、SO2 、SO3 的气态分子中,中心原子价层电子对数不同于其他分子的是___________ 。
(2)晶体中H2O 和 中心原子的杂化轨道类型分别为
中心原子的杂化轨道类型分别为___________ ,试判断 H2O 和  的键角大小关系并说明原因:
的键角大小关系并说明原因:___________ 。
(3)成语“信口雌黄 ”中的雌黄分子式为 As2S3,分子结构如图,As 原子的杂化方式为___________ , 雌黄和 SnCl2 在盐酸中反应转化为雄黄(As4S4)和 SnCl4 并放出 H2S 气体。___________ 。
(5)Zn2+的核外电子排布式为___________ ,在元素周期表中,该元素在___________ (填“s”“p”“d”“f”或“ds”)区。。
(6)S8与热的浓NaOH 溶液反应的产物之一为Na2S3,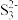 的空间结构为
的空间结构为___________ 。
(7)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,则[H2F]+ 的空间结构为___________ 。
(8)Na3AsO4 中含有的化学键类型包括___________ ; 的空间结构为
的空间结构为 ___________ 。
(1)根据价层电子对互斥模型,H2S 、SO2 、SO3 的气态分子中,中心原子价层电子对数不同于其他分子的是
(2)晶体中H2O 和
 中心原子的杂化轨道类型分别为
中心原子的杂化轨道类型分别为 的键角大小关系并说明原因:
的键角大小关系并说明原因:(3)成语“信口雌黄 ”中的雌黄分子式为 As2S3,分子结构如图,As 原子的杂化方式为

(5)Zn2+的核外电子排布式为
(6)S8与热的浓NaOH 溶液反应的产物之一为Na2S3,
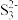 的空间结构为
的空间结构为(7)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,则[H2F]+ 的空间结构为
(8)Na3AsO4 中含有的化学键类型包括
 的空间结构为
的空间结构为
您最近一年使用:0次
【推荐1】钛由于其稳定的化学性质,良好的耐高温、耐低温、抗强酸、抗强碱以及高强度、低密度,被美誉为“未来钢铁”、“战略金属”。
(1)基态钛原子核外共有_______ 种运动状态不相同的电子,价电子排布式_______ ;与钛同周期的元素中,基态原子的未成对电子数与钛相同的有________ 种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是_________ 。
(3)TiCl4是氧化法制取钛的中间产物。TiCl4分子结构与CCl4相同,在常温下都是液体。TiCl4分子的空间构型是_______ ;TiCl4稳定性比CCl4差,试从结构分析其原因:_______ 。
(4)钙钛矿材料是一类有着与钛酸钙相同晶体结构的材料,这种奇特的晶体结构让它具备了很多独特的理化性质,比如吸光性、电催化性等。钛酸钙晶体结构如图所示。其中,A代表Ca2+,Ti原子位于由O原子构成的正八面体的中心,则钛酸钙的化学式为______ ,Ca2+的配位数是________ 。
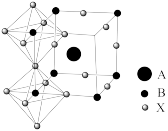
(1)基态钛原子核外共有
(2)钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是
(3)TiCl4是氧化法制取钛的中间产物。TiCl4分子结构与CCl4相同,在常温下都是液体。TiCl4分子的空间构型是
(4)钙钛矿材料是一类有着与钛酸钙相同晶体结构的材料,这种奇特的晶体结构让它具备了很多独特的理化性质,比如吸光性、电催化性等。钛酸钙晶体结构如图所示。其中,A代表Ca2+,Ti原子位于由O原子构成的正八面体的中心,则钛酸钙的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】新型半导体材料如碳化硅(SiC)、氮化镓(GaN)等在国防技术、航空航天及5G技术等领域扮演着重要的角色。
(1)基态Si原子中,核外电子占据的最高能层的符号为______ ,占据最高能级的电子的电子云轮廓图形状为______ 。
(2)基态Ga原子的核外电子排布为[Ar]3d104s2p1,其转化为下列激发态时,吸收能量最少的是______(填选项字母)。
(3)硼(B)与Ga是同主族元素,硼氢化钠(NaBH4)是有机合成中重要的还原剂,基态B原子核外电子有______ 种不同的空间运动状态,其负离子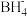 的空间结构为
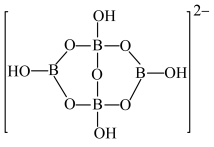
的空间结构为______ ;另一种含硼负离子的结构如下图所示,其中B原子的杂化轨道类型为______ 。
(4)NH4H2PO4中,除磷元素外,其余三种元素电负性由大到小的顺序是______ (填元素符号),N、P和S第一电离能由大到小的顺序是______ (填元素符号)。
(1)基态Si原子中,核外电子占据的最高能层的符号为
(2)基态Ga原子的核外电子排布为[Ar]3d104s2p1,其转化为下列激发态时,吸收能量最少的是______(填选项字母)。
A.[Ar]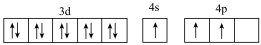 |
B.[Ar]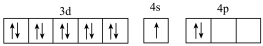 |
C.[Ar]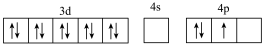 |
D.[Ar]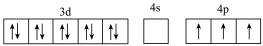 |
(3)硼(B)与Ga是同主族元素,硼氢化钠(NaBH4)是有机合成中重要的还原剂,基态B原子核外电子有
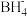 的空间结构为
的空间结构为
(4)NH4H2PO4中,除磷元素外,其余三种元素电负性由大到小的顺序是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】A、B、C、D、E、F是前四周期原子序数依次增大的六种元素。A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,具有良好的生物亲和性,还可用于制造飞机、火箭、人造卫星、宇宙飞船等领域,F4+和氩原子的核外电子排布相同。请回答下列各题(涉及元素请用相应化学符号表示):
(1)B、C、D中电负性最大的元素其基态原子有________ 种不同能量的电子。
(2)G分子中D原子的杂化方式为_____________ ,F2+的基态价电子排布式为____________ 。
(3)BA3- 离子的空间构型为________ ,与其互为等电子体的一种阳离子的电子式为____________ 。
(4)某化合物晶胞结构如右图所示,E2+的最近且等距的D2-有_________ 个。KIO3晶体是一种性能良好的非线性光学材料,具有与右图相似的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与O间的最短距离为______ nm。

(5)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子。释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因________________ 。且由H分子释放出电子时产生的该种阳离子具有较强的氧化性,试写出该阳离子与S02的水溶液反应离子方程式______________________________ ;
(1)B、C、D中电负性最大的元素其基态原子有
(2)G分子中D原子的杂化方式为
(3)BA3- 离子的空间构型为
(4)某化合物晶胞结构如右图所示,E2+的最近且等距的D2-有

(5)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子。释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】下图为元素周期表的部分,元素①~⑥在表中的位置如图所示。

用化学用语 回答下列问题:
(1)⑥的元素符号为_______ ,元素⑤的基态原子核外共有_______ 个单电子。
(2)元素③、④的简单氢化物中,稳定性较高的是_______ ,原因是_______ 。
(3)元素①与元素②、③均能形成 分子,其中与②形成的
分子,其中与②形成的 分子的结构式为
分子的结构式为_______ ,一定条件下两种 分子能发生反应,产物无污染,写出该反应的化学方程式
分子能发生反应,产物无污染,写出该反应的化学方程式_______ 。
(4)单质⑤的晶胞结构如图所示,平均一个晶胞中含有_______ 个⑤原子,若⑤原子的原子半径为r,则该晶体的空间利用率为_______ 。(用含r的代数式表示,不必化简)


用
(1)⑥的元素符号为
(2)元素③、④的简单氢化物中,稳定性较高的是
(3)元素①与元素②、③均能形成
 分子,其中与②形成的
分子,其中与②形成的 分子的结构式为
分子的结构式为 分子能发生反应,产物无污染,写出该反应的化学方程式
分子能发生反应,产物无污染,写出该反应的化学方程式(4)单质⑤的晶胞结构如图所示,平均一个晶胞中含有

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】铁(Fe)、钴(Co)、镍(Ni)是第四周期第Ⅷ族的元素,其化合物在生产生活中应用广泛。
(1)富马酸亚铁(FeC4H2O4)是一种补铁剂。富马酸分子的结构模型如图所示。
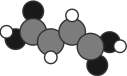
①富马酸亚铁中各元素的电负性由大到小的顺序为_______ 。
②富马酸分子中σ键与π键的数目比为_______ 。
③基态Fe的价层电子中,两种自旋状态的电子数之比为_______ 。
(2)以甲醇为溶剂,Co2+可与色胺酮分子配位结合,形成对DNA具有切割作用的色胺酮钴配合物(合成过程如下所示)。

①色胺酮分子中N原子的杂化类型为_______ 。
②X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过_______ 作用与色胺酮钴配合物相结合。
(3)超导材料在电力、交通、医学等方面有着广泛的应用,某含Ni、Mg和C三种元素的晶体具有超导性,该晶体的晶胞结构如图所示:

①距离Mg原子最近的Ni原子有_______ 个。
②已知该晶体的边长为anm,阿伏加德罗常数的值为NA,该晶体的密度为_______ g·cm-3。
(1)富马酸亚铁(FeC4H2O4)是一种补铁剂。富马酸分子的结构模型如图所示。

①富马酸亚铁中各元素的电负性由大到小的顺序为
②富马酸分子中σ键与π键的数目比为
③基态Fe的价层电子中,两种自旋状态的电子数之比为
(2)以甲醇为溶剂,Co2+可与色胺酮分子配位结合,形成对DNA具有切割作用的色胺酮钴配合物(合成过程如下所示)。

①色胺酮分子中N原子的杂化类型为
②X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过
(3)超导材料在电力、交通、医学等方面有着广泛的应用,某含Ni、Mg和C三种元素的晶体具有超导性,该晶体的晶胞结构如图所示:

①距离Mg原子最近的Ni原子有
②已知该晶体的边长为anm,阿伏加德罗常数的值为NA,该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】电能是一种无污染、可再生的二级能源。储电材料种类繁多。如图是两种储电材料,请阅读试题,观察图片,回答问题。
Ⅰ.新型碳氮材料的储电能力应用前景广阔。其基本构成单元如图所示。
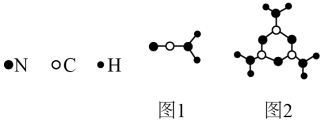
(1)图1中化学键σ键与π键之比为________ ;图2中碳原子的杂化方式为________ 。
(2)在基态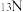 原子中,核外存在
原子中,核外存在_____ 对自旋相反的电子,核外电子占据的最高能级的电子云轮廓图为____ 形。
(3)碳的最高价含氧酸根的空间构型是__________ ;硝酸的酸性强于亚硝酸的原因是__________ 。
Ⅱ.传统锂电池的主要成分是 ,其晶胞结构如图所示;因结构中存在笼状空隙,可以与
,其晶胞结构如图所示;因结构中存在笼状空隙,可以与 和
和 发生位置替换,形成储电性能更加优良的化合物
发生位置替换,形成储电性能更加优良的化合物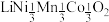 。
。
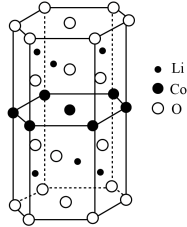
(4)基态 原子的价电子排布式为
原子的价电子排布式为_____________ ;化合物 中O元素在晶胞中的位置,除了位于正六棱柱的顶点外,其他具体位置是
中O元素在晶胞中的位置,除了位于正六棱柱的顶点外,其他具体位置是__________ 。
(5)已知化合物中各原子半径依次为: ,晶胞的棱长为m,底边边长为n,该晶体的空间利用率的计算表达式为
,晶胞的棱长为m,底边边长为n,该晶体的空间利用率的计算表达式为__________ (用含有a、b、c、d、e、m、n的式子表示)。
Ⅰ.新型碳氮材料的储电能力应用前景广阔。其基本构成单元如图所示。

(1)图1中化学键σ键与π键之比为
(2)在基态
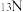 原子中,核外存在
原子中,核外存在(3)碳的最高价含氧酸根的空间构型是
Ⅱ.传统锂电池的主要成分是
 ,其晶胞结构如图所示;因结构中存在笼状空隙,可以与
,其晶胞结构如图所示;因结构中存在笼状空隙,可以与 和
和 发生位置替换,形成储电性能更加优良的化合物
发生位置替换,形成储电性能更加优良的化合物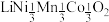 。
。
(4)基态
 原子的价电子排布式为
原子的价电子排布式为 中O元素在晶胞中的位置,除了位于正六棱柱的顶点外,其他具体位置是
中O元素在晶胞中的位置,除了位于正六棱柱的顶点外,其他具体位置是(5)已知化合物中各原子半径依次为:
 ,晶胞的棱长为m,底边边长为n,该晶体的空间利用率的计算表达式为
,晶胞的棱长为m,底边边长为n,该晶体的空间利用率的计算表达式为
您最近一年使用:0次



