化学反应与能量变化是化学家研究的永恒话题。
(1)据报道,有科学家提出硅是“21世纪的能源”、“未来石油”的观点。
①硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,硅光电池是一种把_______ 能转化为_______ 能的装置。
② 工业制备纯硅的反应: ,生成的
,生成的 通入
通入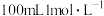 的
的 溶液恰好反应,则制备纯硅的过程中
溶液恰好反应,则制备纯硅的过程中_______ (填“吸收或“释放”)的热量为_______  。
。
(2)氢气是一种理想的绿色能源。在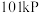 下,
下, 氢气完全燃烧生成液态水放出
氢气完全燃烧生成液态水放出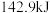 的热量。写出表示氢气燃烧热的热化学方程式
的热量。写出表示氢气燃烧热的热化学方程式_______ 。
(3)化学能与电能的相互转换有着重要的用途。如图是一个化学过程的示意图。

①乙池是_______ 装置(填“原电池”或“电解池”),A电极的名称是_______ ;B(石墨)电极的电极反应式为:_______ 。
②甲池中通入 一极的电极反应式为:
一极的电极反应式为:_______ 。
③反应一段时间后,要使乙池反应后的溶液恢复到原来的状态,则需加入_______ (填化学式)。
④研究证实,甲醇可由 在酸性水溶液中通过电解生成,则生成甲醇的电极反应式是:
在酸性水溶液中通过电解生成,则生成甲醇的电极反应式是:_______ 。
(1)据报道,有科学家提出硅是“21世纪的能源”、“未来石油”的观点。
①硅光电池作为电源已广泛应用于人造卫星、灯塔和无人气象站等,硅光电池是一种把
② 工业制备纯硅的反应:
 ,生成的
,生成的 通入
通入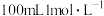 的
的 溶液恰好反应,则制备纯硅的过程中
溶液恰好反应,则制备纯硅的过程中 。
。(2)氢气是一种理想的绿色能源。在
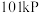 下,
下, 氢气完全燃烧生成液态水放出
氢气完全燃烧生成液态水放出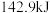 的热量。写出表示氢气燃烧热的热化学方程式
的热量。写出表示氢气燃烧热的热化学方程式(3)化学能与电能的相互转换有着重要的用途。如图是一个化学过程的示意图。

①乙池是
②甲池中通入
 一极的电极反应式为:
一极的电极反应式为:③反应一段时间后,要使乙池反应后的溶液恢复到原来的状态,则需加入
④研究证实,甲醇可由
 在酸性水溶液中通过电解生成,则生成甲醇的电极反应式是:
在酸性水溶液中通过电解生成,则生成甲醇的电极反应式是:
更新时间:2022-11-01 15:11:12
|
相似题推荐
【推荐1】工业上用CO和H2反应制备二甲醚(CH3OCH3)的条件是压力2.0~10.0MPa,温度300℃。设备中进行下列反应,请回答下列问题:
①CO(g)+2H2(B) CH3OH(g)△H=-90.7 kJ/mol
CH3OH(g)△H=-90.7 kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g)△H=-23.5 kJ/mol
CH3OCH3(g)+H2O(g)△H=-23.5 kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g)△H=-41.2 kJ/mol
CO2(g)+H2(g)△H=-41.2 kJ/mol
(1)总反应3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g)的△H=_____________ 。据此可判断该反应_________________ 条件下自发。
(2)在温度和容积不变的条件下发生反应①,能说明该反应达到平衡状态的依据是_____
a.容器中压强保持不变b.混合气体中c(CO)不变
c.v正(CO)=v逆(H2) d.c(CH3OH)=c(CO)
(3)在2L的容器中加入a mol CH3OH(g)发生反应②,达到平衡后若再加入a mol CH3OH(g)重新达到平衡时,CH3OH的转化率____________ (填“增大”、“减小”或“不变”)。
(4)850℃时在一体积为10 L的容器中通入一定量的CO和H2O(g)发生反应③,CO和H2O(g)浓度变化如图所示。

①0~4 min的平均反应速率,v(CO)=________________ 。
②若温度不变,向该容器中加入4 molCO(g)、2 molH2O(g)、3 mol CO2(g)和3 mol H2(g),起始时v正(CO)______ v逆(H2)(填“<”、“>”或“=”),请结合必要的计算说明理由。________ 。
①CO(g)+2H2(B)
 CH3OH(g)△H=-90.7 kJ/mol
CH3OH(g)△H=-90.7 kJ/mol②2CH3OH(g)
 CH3OCH3(g)+H2O(g)△H=-23.5 kJ/mol
CH3OCH3(g)+H2O(g)△H=-23.5 kJ/mol③CO(g)+H2O(g)
 CO2(g)+H2(g)△H=-41.2 kJ/mol
CO2(g)+H2(g)△H=-41.2 kJ/mol(1)总反应3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g)的△H=
(2)在温度和容积不变的条件下发生反应①,能说明该反应达到平衡状态的依据是
a.容器中压强保持不变b.混合气体中c(CO)不变
c.v正(CO)=v逆(H2) d.c(CH3OH)=c(CO)
(3)在2L的容器中加入a mol CH3OH(g)发生反应②,达到平衡后若再加入a mol CH3OH(g)重新达到平衡时,CH3OH的转化率
(4)850℃时在一体积为10 L的容器中通入一定量的CO和H2O(g)发生反应③,CO和H2O(g)浓度变化如图所示。

①0~4 min的平均反应速率,v(CO)=
②若温度不变,向该容器中加入4 molCO(g)、2 molH2O(g)、3 mol CO2(g)和3 mol H2(g),起始时v正(CO)
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】甲醇是一种可再生能源,又是一种重要的化工原料.具有广阔的开发和应用前景。工业上可用如下方法合成甲醇:CO(g)+2H2(g) CH3OH(g).
CH3OH(g).
(1)已知:①2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(g) △H=-1275.6kJ·mol-1;
2CO2(g)+4H2O(g) △H=-1275.6kJ·mol-1;
②2CO(g)+O2(g) 2CO2(g) △H=-566.0kJ·mol-1;
2CO2(g) △H=-566.0kJ·mol-1;
③H2O(l)=H2O(g) △H=+44.0kJ·mol-1.
则甲醇液体不完全燃烧生成CO和液态水的热化学方程式为__________ 。
(2)在一定温度下,向2L密闭容器中充人1mol CO和2mol H2,发生反应CO(g)+2H2(g)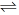 CH3OH(g),5min反应达到平衡,此时CO的转化率为80%。
CH3OH(g),5min反应达到平衡,此时CO的转化率为80%。
①前5min内甲醇的平均反应速率为__________ ;已知该反应在低温下能自发进行,则反应的△H_______ 0(填“>”“<”或“=”)。
②在该温度下反应的平衡常数K=__________ 。
③某时刻向该平衡体系中加入CO、H2、CH3OH各0.2mol后,则v正__________ v逆(填“>”“=”或“<”)。
④当反应达到平衡时,__________ (填字母)。
a.混合气体的压强不再发生变化b.反应物不再转化为生成物
c.v正(CO)=2v逆(H2) d.v(H2)=2v(CH3OH)
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(3) "甲醇---过氧化氢燃料电池"的结构主要包括燃料腔、氧化剂腔和质子交换膜三部分.放电过程中其中一个腔中生成了CO2。
①放电过程中生成H+的反应,发生在__________ 腔中,该腔中的电极反应式为__________ .
②该电池工作过程中,当消耗甲醇4.8g时.电路中通过的电量为__________ (法拉第常数F=9.65×104C·mol-1)
 CH3OH(g).
CH3OH(g).(1)已知:①2CH3OH(l)+3O2(g)
 2CO2(g)+4H2O(g) △H=-1275.6kJ·mol-1;
2CO2(g)+4H2O(g) △H=-1275.6kJ·mol-1;②2CO(g)+O2(g)
 2CO2(g) △H=-566.0kJ·mol-1;
2CO2(g) △H=-566.0kJ·mol-1;③H2O(l)=H2O(g) △H=+44.0kJ·mol-1.
则甲醇液体不完全燃烧生成CO和液态水的热化学方程式为
(2)在一定温度下,向2L密闭容器中充人1mol CO和2mol H2,发生反应CO(g)+2H2(g)
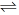 CH3OH(g),5min反应达到平衡,此时CO的转化率为80%。
CH3OH(g),5min反应达到平衡,此时CO的转化率为80%。①前5min内甲醇的平均反应速率为
②在该温度下反应的平衡常数K=
③某时刻向该平衡体系中加入CO、H2、CH3OH各0.2mol后,则v正
④当反应达到平衡时,
a.混合气体的压强不再发生变化b.反应物不再转化为生成物
c.v正(CO)=2v逆(H2) d.v(H2)=2v(CH3OH)
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(3) "甲醇---过氧化氢燃料电池"的结构主要包括燃料腔、氧化剂腔和质子交换膜三部分.放电过程中其中一个腔中生成了CO2。
①放电过程中生成H+的反应,发生在
②该电池工作过程中,当消耗甲醇4.8g时.电路中通过的电量为
您最近半年使用:0次
【推荐3】回答下列问题:
(1)氢气是一种清洁能源,氢气的制取。与储存是氢能源利用领域的研究热点。
已知:



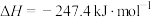


以甲烷为原料制取氢气是工业上常用的制氢方法。 (g)与
(g)与 (g)反应生成
(g)反应生成 (g)和
(g)和 (g)的热化学方程式为
(g)的热化学方程式为___________ 。
(2)用 催化还原
催化还原 可以消除氮氧化物的污染。例如:
可以消除氮氧化物的污染。例如:

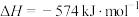


若用标准状况下4.48L 还原
还原 至
至 整个过程中转移的电子总数为
整个过程中转移的电子总数为___________ (阿伏加德罗常数的值用 表示),放出的热量为
表示),放出的热量为___________ 。
(3) 反应过程的能量变化如图所示。
反应过程的能量变化如图所示。
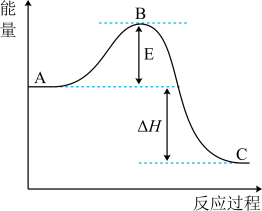
已知1mol (g)氧化为1mol
(g)氧化为1mol  的
的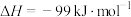 。请回答下列问题:
。请回答下列问题:
①图中ΔH=___________  。
。
②将2mol 和1mol
和1mol  充入体积不变的密闭容器中,在一定条件下达平衡时,
充入体积不变的密闭容器中,在一定条件下达平衡时, 为0.6mol,如果此时移走1mol
为0.6mol,如果此时移走1mol  和0.5mol
和0.5mol  在相同温度下再达平衡时
在相同温度下再达平衡时 的物质的量
的物质的量___________ (填选项)。
A.0.3mol B.0.6mol C.小于0.3mol D.大于0.3mol小于0.6mol
(1)氢气是一种清洁能源,氢气的制取。与储存是氢能源利用领域的研究热点。
已知:



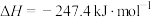


以甲烷为原料制取氢气是工业上常用的制氢方法。
 (g)与
(g)与 (g)反应生成
(g)反应生成 (g)和
(g)和 (g)的热化学方程式为
(g)的热化学方程式为(2)用
 催化还原
催化还原 可以消除氮氧化物的污染。例如:
可以消除氮氧化物的污染。例如:
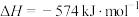


若用标准状况下4.48L
 还原
还原 至
至 整个过程中转移的电子总数为
整个过程中转移的电子总数为 表示),放出的热量为
表示),放出的热量为(3)
 反应过程的能量变化如图所示。
反应过程的能量变化如图所示。
已知1mol
 (g)氧化为1mol
(g)氧化为1mol  的
的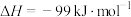 。请回答下列问题:
。请回答下列问题:①图中ΔH=
 。
。②将2mol
 和1mol
和1mol  充入体积不变的密闭容器中,在一定条件下达平衡时,
充入体积不变的密闭容器中,在一定条件下达平衡时, 为0.6mol,如果此时移走1mol
为0.6mol,如果此时移走1mol  和0.5mol
和0.5mol  在相同温度下再达平衡时
在相同温度下再达平衡时 的物质的量
的物质的量A.0.3mol B.0.6mol C.小于0.3mol D.大于0.3mol小于0.6mol
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)三室式电渗析法处理含Na2SO4的废水原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO 可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
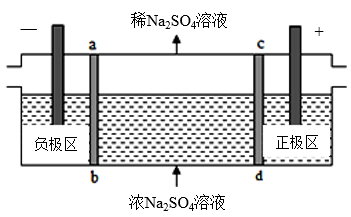
则通电后中间隔室的SO 离子向
离子向_______ 极迁移,正极区溶液pH_______ (填“增大”或“减小”),当电路中通过1 电子的电量时,会有
电子的电量时,会有_________  的O2生成。
的O2生成。
(2)现有可逆反应A(气)+B(气) 3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
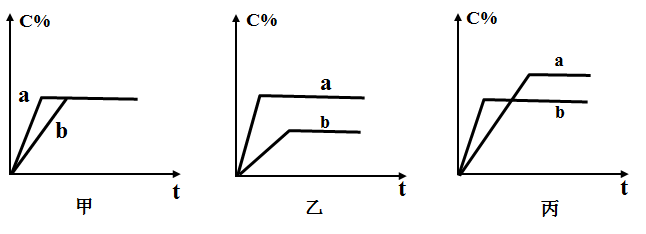
Ⅰ 若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则______ 曲线是表示有催化剂时的情况。
Ⅱ 若乙图中的a曲线表示200℃和b曲线表示100℃时的情况,则此可逆反应的正反应是_________ 热反应。
Ⅲ 若丙图中两条曲线分别表示不同压强下的情况,则________ 曲线是表示压强较大的情况。
 可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
则通电后中间隔室的SO
 离子向
离子向 电子的电量时,会有
电子的电量时,会有 的O2生成。
的O2生成。(2)现有可逆反应A(气)+B(气)
 3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
Ⅰ 若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则
Ⅱ 若乙图中的a曲线表示200℃和b曲线表示100℃时的情况,则此可逆反应的正反应是
Ⅲ 若丙图中两条曲线分别表示不同压强下的情况,则
您最近半年使用:0次
【推荐2】锰及其化合物是目前前沿科学研究的热点。按要求回答下列问题。
(1)锰的冶炼有多种方法,其中以某锰矿(主要成分为 ,主要杂质有
,主要杂质有 、MnS、CuS、FeS)为原料,设计如下流程可制得金属Mn。
、MnS、CuS、FeS)为原料,设计如下流程可制得金属Mn。
①脱硫步骤:硫化物均转化为单质S,其反应中的氧化剂为_____ ; 能被部分反应而得到的产物为
能被部分反应而得到的产物为______ 。
②酸浸步骤:ⅰ反应后的溶液中含 ,写出ⅱ反应的离子方程式:
,写出ⅱ反应的离子方程式:_______ ;若未经脱硫直接酸浸,不利的方面是______ 。
③调pH的目的为去除铁元素,则产生滤渣2的离子方程式:_______ 。
④除杂步骤:滤渣3中主要有______ 。
⑤电解步骤:金属锰应在电解池的______ (填“阳极”或“阴极”)析出。
(2)某晶体锰的面心立方晶胞如图所示。____ 。
②设该晶胞参数为cpm,则晶体锰的密度为_____  (填计算式)
(填计算式)
(1)锰的冶炼有多种方法,其中以某锰矿(主要成分为
 ,主要杂质有
,主要杂质有 、MnS、CuS、FeS)为原料,设计如下流程可制得金属Mn。
、MnS、CuS、FeS)为原料,设计如下流程可制得金属Mn。
| 物质 | CuS | MnS | FeS |
 |  | 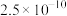 |  |
 能被部分反应而得到的产物为
能被部分反应而得到的产物为②酸浸步骤:ⅰ反应后的溶液中含
 ,写出ⅱ反应的离子方程式:
,写出ⅱ反应的离子方程式:③调pH的目的为去除铁元素,则产生滤渣2的离子方程式:
④除杂步骤:滤渣3中主要有
⑤电解步骤:金属锰应在电解池的
(2)某晶体锰的面心立方晶胞如图所示。

②设该晶胞参数为cpm,则晶体锰的密度为
 (填计算式)
(填计算式)
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】FeO(OH)在高档涂料、油墨等领域有着广泛的应用。以铁泥(主要含Fe2O3,以及少量的 、
、 、SiO2)为原料制备FeO(OH)的流程如图所示。
、SiO2)为原料制备FeO(OH)的流程如图所示。

已知: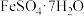 溶于水,不溶于乙醇。回答下列问题:
溶于水,不溶于乙醇。回答下列问题:
(1)滤液①的溶质为H2SO4和_______ 、_______ (填化学式)。
(2)“提纯”步骤中所有可能的反应的离子方程式为_______ ;提纯后的滤渣是_______
(3)加入乙醇的目的是_______ 。
(4)“氧化”步骤中主要反应的化学方程式为_______ 。
(5)按照以上流程回收处理1 kg铁泥(含Fe元素的质量分数为56%),得到890 g纯度为95%的产品,Fe元素的回收率为_______ 。
(6)镍铁电池放电时也可产生FeO(OH),其工作原理如图所示。

 放电生成FeO(OH)2后,继续放电时,电极上的FeO(OH)2可转化为FeO(OH),写出该过程的电极反应式
放电生成FeO(OH)2后,继续放电时,电极上的FeO(OH)2可转化为FeO(OH),写出该过程的电极反应式_______
 、
、 、SiO2)为原料制备FeO(OH)的流程如图所示。
、SiO2)为原料制备FeO(OH)的流程如图所示。
已知:
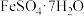 溶于水,不溶于乙醇。回答下列问题:
溶于水,不溶于乙醇。回答下列问题:(1)滤液①的溶质为H2SO4和
(2)“提纯”步骤中所有可能的反应的离子方程式为
(3)加入乙醇的目的是
(4)“氧化”步骤中主要反应的化学方程式为
(5)按照以上流程回收处理1 kg铁泥(含Fe元素的质量分数为56%),得到890 g纯度为95%的产品,Fe元素的回收率为
(6)镍铁电池放电时也可产生FeO(OH),其工作原理如图所示。

 放电生成FeO(OH)2后,继续放电时,电极上的FeO(OH)2可转化为FeO(OH),写出该过程的电极反应式
放电生成FeO(OH)2后,继续放电时,电极上的FeO(OH)2可转化为FeO(OH),写出该过程的电极反应式
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如图所示(电极未标出)。回答下列有关问题:

(1)电解池的阴极反应式为_____________ 。
(2)通入空气一极的电极反应式为_____________ 。燃料电池中阳离子的移动方向是_____________ (“从左向右”或“从右向左”)。
(3)电解池中产生 2molCl2,理论上燃料电池中消耗标准状况下_____________ LO2。
(4) a、b、c 由大到小的顺序为:_____________ 。
(5)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,可由 KClO3在H2SO4存在下与 Na2SO3反应制得。请写出反应的离子方程式_____________

(1)电解池的阴极反应式为
(2)通入空气一极的电极反应式为
(3)电解池中产生 2molCl2,理论上燃料电池中消耗标准状况下
(4) a、b、c 由大到小的顺序为:
(5)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,可由 KClO3在H2SO4存在下与 Na2SO3反应制得。请写出反应的离子方程式
您最近半年使用:0次
【推荐2】某课外小组利用甲烷燃料电池为电源在铁螺母表面上镀铜,装置如图所示:
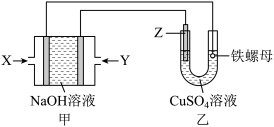
回答下列问题:
(1)X是气体___________ (填化学式),判断理由是___________ ,X所在电极的电极反应式是___________ 。
(2)Z是___________ (填化学式)。铁螺母表面镀铜完成后,理论上 溶液的浓度
溶液的浓度___________ (填“增大”“减小”或“不变”)。
(3)铁螺母表面镀铜完成后,称重,质量增加3.2g,则理论上消耗甲烷___________ L(标准状况)。实际上消耗甲烷的体积比理论值大,其原因可能是___________ 。

回答下列问题:
(1)X是气体
(2)Z是
 溶液的浓度
溶液的浓度(3)铁螺母表面镀铜完成后,称重,质量增加3.2g,则理论上消耗甲烷
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】能源是人类生存和发展的重要支柱,化学在能源的开发与利用方面起着十分重要的作用。某学习小组按如下图所示装置探究化学能与电能的相互转化:

(1)甲池是_________ 装置,通入O2气体的电极上的反应式为______________ 。乙池中SO42-移向_____ 电极(填“石墨”或“Ag”)。
(2) 当甲池消耗标况下33.6L O2时,电解质KOH的物质的量变化_____ mol,乙池若要恢复电解前的状态则需要加入__________ (填所加物质的质量及化学式)。
(3) 丙池中发生的电解反应的离子方程式为______________ 。

(1)甲池是
(2) 当甲池消耗标况下33.6L O2时,电解质KOH的物质的量变化
(3) 丙池中发生的电解反应的离子方程式为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】尿素 是一种重要的化工产品,工业生产尿素的主要流程如下:
是一种重要的化工产品,工业生产尿素的主要流程如下:

(1)工业合成氨的化学方程式是_______ 。
(2)尿素分子中C、N原子间的共用电子对偏向N原子,从原子结构的角度解释原因:______ 。
(3)由NH3和CO2合成尿素分为两步反应(均为可逆反应),其能量变化示意图如下:

①合成尿素总反应的热化学方程式是_______ 。
②粗尿素中含有NH2COONH4杂质。通过控制温度和压强,可将NH2COONH4分解为NH3和CO2。研究温度和压强对NH2COONH4分解率的影响,结果如下:
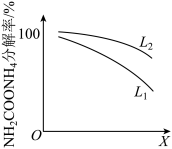
X代表_____ (填“温度”或“压强”),L1_____ L2(填“>”或“<”)。
(4)工业上含尿素的废水需经处理后才能排放。一种利用电化学方法降解尿素的装置示意图如下:
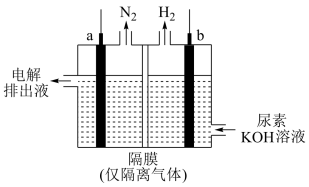
写出尿素被降解的电极反应式是______ 。
 是一种重要的化工产品,工业生产尿素的主要流程如下:
是一种重要的化工产品,工业生产尿素的主要流程如下:
(1)工业合成氨的化学方程式是
(2)尿素分子中C、N原子间的共用电子对偏向N原子,从原子结构的角度解释原因:
(3)由NH3和CO2合成尿素分为两步反应(均为可逆反应),其能量变化示意图如下:

①合成尿素总反应的热化学方程式是
②粗尿素中含有NH2COONH4杂质。通过控制温度和压强,可将NH2COONH4分解为NH3和CO2。研究温度和压强对NH2COONH4分解率的影响,结果如下:

X代表
(4)工业上含尿素的废水需经处理后才能排放。一种利用电化学方法降解尿素的装置示意图如下:

写出尿素被降解的电极反应式是
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】废旧磷酸铁锂电池的回收利用具有重要研究价值。利用废旧电池正极极片料(主要成分为LiFePO4,还含有少量的Al、石墨等)回收金属化合物,并通过电解Na2SO4溶液生产所需的H2SO4溶液和NaOH溶液,从而实现物质的循环利用。工艺流程如下,回答下列问题:
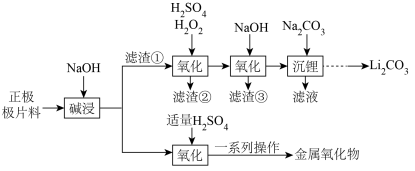
(1)加快“碱浸”速率的方法___________ (任写1条)。
(2)“氧化”过程H2O2的用量比理论用量稍高的原因是___________ 。
(3)滤渣③的主要成分是___________ 。
(4)“沉淀”中发生反应的离子方程式为___________ ,“沉淀”过程后的“一系列操作”具体为___________ 。
(5)“沉锂”所得“滤液”经纯化后得Na2SO4溶液,利用下列装置电解Na2SO4溶液制备H2SO4溶液和NaOH溶液,从而实现物质循环利用。

①离子交换膜b应为___________ (填“阳离子”或“阴离子”)交换膜;
②一定条件下,c(Na2SO4)、电解时间对电解所得溶液的c(H+)、c(OH-)及电流效率(η(NaOH)、η(H2SO4))的影响如图,则最佳电解条件中c(Na2SO4)为___________ mol·L-1左右、电解时间为___________ h左右。

(6)生产中通常需要测定正极极片料的总铁量。取mg样品,用盐酸充分溶解、过滤、洗涤,将滤液和洗涤液合并后配成250mL溶液。取25.00mL与适量TiCl3溶液反应,将Fe3+恰好完全还原为Fe2+。加入混酸介质,滴入指示剂,用0.01mol·L-1K2Cr2O7标准溶液滴定,三次滴定平均消耗VmLK2Cr2O7标准溶液。
①用K2Cr2O7标准溶液滴定过程中反应的离子方程式为___________ 。
②样品中铁的质量分数为___________ 。

(1)加快“碱浸”速率的方法
(2)“氧化”过程H2O2的用量比理论用量稍高的原因是
(3)滤渣③的主要成分是
(4)“沉淀”中发生反应的离子方程式为
(5)“沉锂”所得“滤液”经纯化后得Na2SO4溶液,利用下列装置电解Na2SO4溶液制备H2SO4溶液和NaOH溶液,从而实现物质循环利用。

①离子交换膜b应为
②一定条件下,c(Na2SO4)、电解时间对电解所得溶液的c(H+)、c(OH-)及电流效率(η(NaOH)、η(H2SO4))的影响如图,则最佳电解条件中c(Na2SO4)为

(6)生产中通常需要测定正极极片料的总铁量。取mg样品,用盐酸充分溶解、过滤、洗涤,将滤液和洗涤液合并后配成250mL溶液。取25.00mL与适量TiCl3溶液反应,将Fe3+恰好完全还原为Fe2+。加入混酸介质,滴入指示剂,用0.01mol·L-1K2Cr2O7标准溶液滴定,三次滴定平均消耗VmLK2Cr2O7标准溶液。
①用K2Cr2O7标准溶液滴定过程中反应的离子方程式为
②样品中铁的质量分数为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】(1)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:①CO(g)+2H2(g) ⇌CH3OH(g) △H1②CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g) △H2 ③CO2(g) + H2(g) ⇌CO(g)+H2O(g) △H3已知反应①中相关的化学键键能数据如下:
由此计算△H1=___________ kJ•mol-1;已知△H2= -58 kJ•mol-1,则△H3= ____________ kJ•mol-1。
(2)燃料电池是符合绿色化学理念的新型发电装置,CH3OH—空气燃料电池是一种碱性(20%—30%的KOH溶液)燃料电池。电池放电时,负极的电极反应式为___________ .正极的电极反应式为________________ .
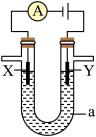
(3)下图是一个电解过程示意图,假设使用CH3OH—空气燃料电池作为本过程中的电源,其中a为电解液,X和Y是两块电极板。
①若X为铁,Y为银,a为一定浓度的硝酸银溶液,通电后,Y极板上发生的电极反应式为:_____ 。
②若X、Y分别为石墨和铜,a为CuSO4溶液,铜片的质量变化128g,则 CH3OH一空气燃料电池理论上消耗标准状况下的空气_______ L(假设空气中氧气体积分数为20%)。
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1075 | 465 | 413 |
(2)燃料电池是符合绿色化学理念的新型发电装置,CH3OH—空气燃料电池是一种碱性(20%—30%的KOH溶液)燃料电池。电池放电时,负极的电极反应式为
(3)下图是一个电解过程示意图,假设使用CH3OH—空气燃料电池作为本过程中的电源,其中a为电解液,X和Y是两块电极板。
①若X为铁,Y为银,a为一定浓度的硝酸银溶液,通电后,Y极板上发生的电极反应式为:
②若X、Y分别为石墨和铜,a为CuSO4溶液,铜片的质量变化128g,则 CH3OH一空气燃料电池理论上消耗标准状况下的空气
您最近半年使用:0次



