图像分析是研究化学问题的重要手段。请分析以下图像,回答有关问题。
(1)理论分析在密闭容器中发生的反应: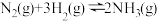
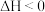 。不同时刻,保持其它条件不变,只改变某一个条件,正、逆反应速率随时间变化示意图如图所示。
。不同时刻,保持其它条件不变,只改变某一个条件,正、逆反应速率随时间变化示意图如图所示。

请在以下表格中填入各时刻改变的条件。
(2)密闭容器中,发生反应: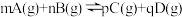
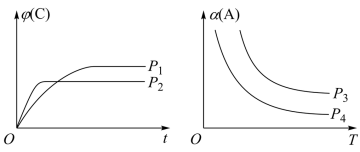
 。图为C的体积分数
。图为C的体积分数 在不同压强P下随时间t变化的曲线和A的转化率a(A)在不同压强下随温度T变化的曲线。
在不同压强P下随时间t变化的曲线和A的转化率a(A)在不同压强下随温度T变化的曲线。
请回答下列问题(填“>”、“=”或“<”):
①m+n______ p+q。 ②
______ 0。 ③
______  。
。
(3)常温下,相同pH的盐酸和醋酸分别加水稀释,溶液中氢离子浓度随溶液体积变化曲线如图所示。
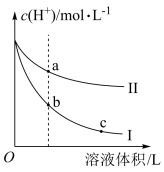
①曲线Ⅱ表示的是______ 稀释的变化曲线。
②将a点溶液与b点溶液混合,醋酸的电离平衡
 将向
将向______ 移动。
③a、b、c三点的导电能力大小顺序为______ 。
(1)理论分析在密闭容器中发生的反应:
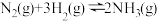
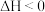 。不同时刻,保持其它条件不变,只改变某一个条件,正、逆反应速率随时间变化示意图如图所示。
。不同时刻,保持其它条件不变,只改变某一个条件,正、逆反应速率随时间变化示意图如图所示。
请在以下表格中填入各时刻改变的条件。
| 时刻 |  |  |  |  |  |  |
| 条件变化 | 使用 催化剂 | 增加 反应物 |
(2)密闭容器中,发生反应:
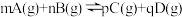
 。图为C的体积分数
。图为C的体积分数 在不同压强P下随时间t变化的曲线和A的转化率a(A)在不同压强下随温度T变化的曲线。
在不同压强P下随时间t变化的曲线和A的转化率a(A)在不同压强下随温度T变化的曲线。
请回答下列问题(填“>”、“=”或“<”):
①m+n


 。
。(3)常温下,相同pH的盐酸和醋酸分别加水稀释,溶液中氢离子浓度随溶液体积变化曲线如图所示。

①曲线Ⅱ表示的是
②将a点溶液与b点溶液混合,醋酸的电离平衡
 将向
将向③a、b、c三点的导电能力大小顺序为
更新时间:2022-12-09 08:11:28
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气:C(s)+H2O(g) H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,该反应在低温下
H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,该反应在低温下_______ (填“能”或“不能”)自发进行。
(2)已知在400℃时,N2(g)+3H2(g) 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。
①400℃时,2NH3(g) N2(g)+3H2(g)的K'=
N2(g)+3H2(g)的K'=_______ (填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正_______ v(N2)逆(填“>”“<”“=”或“不能确定”)。
③若在恒温下将容器的容积缩小到原来的二分之一,则合成氨反应的平衡_______ 移动(填“向左”、“向右”或“不”),反应的∆H_______ (填“增大”、“减小”或“不变”)。
(3)若将C(s)+H2O(g) H2(g)+CO(g) ΔH=+131.3kJ·mol-1的温度由500℃升高到900℃,则平衡常数K(500℃)
H2(g)+CO(g) ΔH=+131.3kJ·mol-1的温度由500℃升高到900℃,则平衡常数K(500℃)_______ K(900℃)(填“大于”,“小于”或“等于”下同)。
(4)25℃时,H2O H++OH— ,若将温度由升高到100℃,则Kw(25℃)
H++OH— ,若将温度由升高到100℃,则Kw(25℃)_______ Kw(100℃)。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气:C(s)+H2O(g)
 H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,该反应在低温下
H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,该反应在低温下(2)已知在400℃时,N2(g)+3H2(g)
 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。①400℃时,2NH3(g)
 N2(g)+3H2(g)的K'=
N2(g)+3H2(g)的K'=②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正
③若在恒温下将容器的容积缩小到原来的二分之一,则合成氨反应的平衡
(3)若将C(s)+H2O(g)
 H2(g)+CO(g) ΔH=+131.3kJ·mol-1的温度由500℃升高到900℃,则平衡常数K(500℃)
H2(g)+CO(g) ΔH=+131.3kJ·mol-1的温度由500℃升高到900℃,则平衡常数K(500℃)(4)25℃时,H2O
 H++OH— ,若将温度由升高到100℃,则Kw(25℃)
H++OH— ,若将温度由升高到100℃,则Kw(25℃)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,写出CO2与NaOH溶液反应的主要化学方程式__________ 。
(2)研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1= -53.7 kJ·mol-1Ⅰ
CH3OH(g)+H2O(g) ΔH1= -53.7 kJ·mol-1Ⅰ
CO2(g)+H2(g) CO(g)+H2O(g) ΔH2Ⅱ
CO(g)+H2O(g) ΔH2Ⅱ
某实验室控制CO2和H2初始投料比为1∶2.2,经过相同反应时间测得如下实验数据:
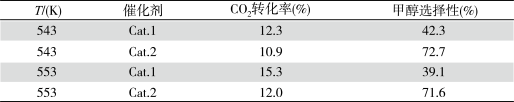
【备注】Cat.1∶Cu/ZnO纳米棒;Cat.2∶Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比
已知: CO和H2的标准燃烧热分别为-283.0 kJ·mol-1和-285.8 kJ·mol-1;
H2O(l)= H2O(g) ΔH3 =+44.0 kJ·mol-1
请回答(不考虑温度对ΔH的影响):
①反应Ⅱ的ΔH2 =________ kJ·mol-1。
②研究证实,CO2可在酸性水溶液中通过电解生成甲醇,则生成甲醇的电极反应式是________ 。
③表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是_____________ 。
(3)O2辅助的Al~CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。电池的负极反应式:_______ 。电池的正极反应式:6O2+6e-=6O2-;6CO2+6O2-=3C2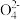 +6O2,反应过程中O2的作用是
+6O2,反应过程中O2的作用是________ 。该电池的总反应式:__________ 。

(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,写出CO2与NaOH溶液反应的主要化学方程式
(2)研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1= -53.7 kJ·mol-1Ⅰ
CH3OH(g)+H2O(g) ΔH1= -53.7 kJ·mol-1ⅠCO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2Ⅱ
CO(g)+H2O(g) ΔH2Ⅱ某实验室控制CO2和H2初始投料比为1∶2.2,经过相同反应时间测得如下实验数据:

【备注】Cat.1∶Cu/ZnO纳米棒;Cat.2∶Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比
已知: CO和H2的标准燃烧热分别为-283.0 kJ·mol-1和-285.8 kJ·mol-1;
H2O(l)= H2O(g) ΔH3 =+44.0 kJ·mol-1
请回答(不考虑温度对ΔH的影响):
①反应Ⅱ的ΔH2 =
②研究证实,CO2可在酸性水溶液中通过电解生成甲醇,则生成甲醇的电极反应式是
③表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是
(3)O2辅助的Al~CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。电池的负极反应式:
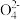 +6O2,反应过程中O2的作用是
+6O2,反应过程中O2的作用是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】已知A和B反应的化学方程式为A(g)+2B(g) C(g)。回答下列问题:
C(g)。回答下列问题:
(1)图1是反应A(g)+2B(g) C(g)在不同温度下A的转化率随时间变化的曲线。
C(g)在不同温度下A的转化率随时间变化的曲线。
①该反应的△H___ (填“>”“<”或“=”)0。
②T1和T2温度下的平衡常数大小关系是K1___ (填“>”“<”或“=”)K2。在T1温度下,向体积为1L的密闭容器中,充入1molA(g)和2molB(g),测得A(g)和C(g)的浓度随时间变化如图2所示。则该反应的平衡常数为___ 。
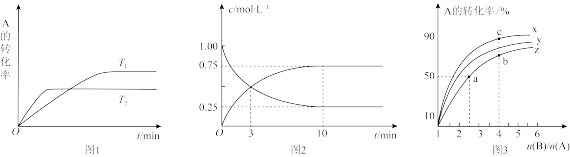
③若容器容积不变,下列措施可增加A转化率的是___ (填字母)。
a.升高温度 b.将C(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)在容积为1L的恒容密闭容器中,分别研究在230°C、250℃和270℃条件下的上述反应。三种温度下B与A的物质的量之比与A平衡转化率的关系如图3所示。曲线z对应的温度是___ ℃;该温度下,若反应物A的物质的量为1 mol,则该反应的化学平衡常数为___ (用分数表示)。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为___ 。
 C(g)。回答下列问题:
C(g)。回答下列问题:(1)图1是反应A(g)+2B(g)
 C(g)在不同温度下A的转化率随时间变化的曲线。
C(g)在不同温度下A的转化率随时间变化的曲线。①该反应的△H
②T1和T2温度下的平衡常数大小关系是K1

③若容器容积不变,下列措施可增加A转化率的是
a.升高温度 b.将C(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)在容积为1L的恒容密闭容器中,分别研究在230°C、250℃和270℃条件下的上述反应。三种温度下B与A的物质的量之比与A平衡转化率的关系如图3所示。曲线z对应的温度是
您最近一年使用:0次
【推荐1】氯化亚铜 是一种白色粉末,广泛应用于化工和印染等行业。
是一种白色粉末,广泛应用于化工和印染等行业。 难溶于乙醇,在潮湿的空气中易被氧化,酸性条件下不稳定,易生成
难溶于乙醇,在潮湿的空气中易被氧化,酸性条件下不稳定,易生成 和
和 。工业上用铜矿粉(主要含
。工业上用铜矿粉(主要含 及少量
及少量 、
、 等)为原料制备
等)为原料制备 。流程如图
。流程如图
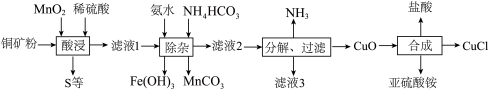
(1)“酸浸”中,加入稀 不宜过量太多的原因是
不宜过量太多的原因是_______ 。
(2)滤液3的主要成分是_______ ;过程中可以循环利用的物质是_______ 。
(3)生成 的离子方程式为:
的离子方程式为:_______ 。
(4)析出的 晶体用乙醇洗涤的目的是
晶体用乙醇洗涤的目的是_______ 。
(5)合成过程中氯化亚铜的产率与温度、溶液 的关系如图所示。
的关系如图所示。
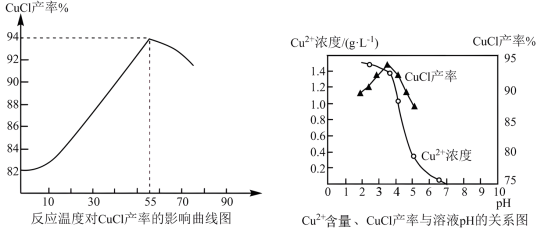
①据图分析,生产氯化亚铜的适宜条件为_______ 。
②合成时,盐酸用量过多对产品造成的影响是_______ 。
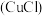 是一种白色粉末,广泛应用于化工和印染等行业。
是一种白色粉末,广泛应用于化工和印染等行业。 难溶于乙醇,在潮湿的空气中易被氧化,酸性条件下不稳定,易生成
难溶于乙醇,在潮湿的空气中易被氧化,酸性条件下不稳定,易生成 和
和 。工业上用铜矿粉(主要含
。工业上用铜矿粉(主要含 及少量
及少量 、
、 等)为原料制备
等)为原料制备 。流程如图
。流程如图
(1)“酸浸”中,加入稀
 不宜过量太多的原因是
不宜过量太多的原因是(2)滤液3的主要成分是
(3)生成
 的离子方程式为:
的离子方程式为:(4)析出的
 晶体用乙醇洗涤的目的是
晶体用乙醇洗涤的目的是(5)合成过程中氯化亚铜的产率与温度、溶液
 的关系如图所示。
的关系如图所示。
①据图分析,生产氯化亚铜的适宜条件为
②合成时,盐酸用量过多对产品造成的影响是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】Co3O4在磁性材料、电化学领域应用广泛,可通过先获得CoCO3沉淀,再加热CoCO3的方法制备。
(1)以CoCl2溶液为原料,制备CoCO3的主要实验流程如图:

①“反应”时需控制温度为50~60℃,其反应的离子方程式为___ 。
②已知:Ksp[Co(OH)2]=1.6×10-15,Ksp(CoCO3)=1.4×10-13。制备CoCO3时不宜使用Na2CO3溶液代替NH4HCO3溶液,其原因是___ 。
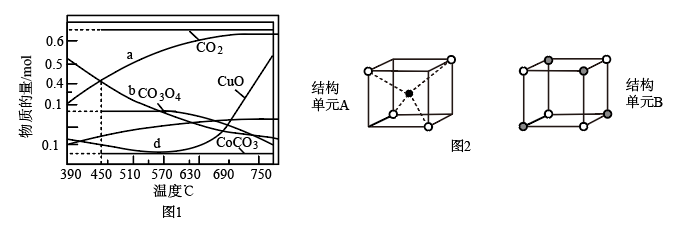
(2)加热CoCO3制备Co3O4时有部分Co2+转化为Co3+。取1molCoCO3在空气中加热,反应温度对反应产物的影响如图1所示。参与该反应的物质还有___ (写化学式)。Co3O4晶体中包含A、B两种结构单元,如图2所示( 、
、 表示两种不同价态的Co原子,
表示两种不同价态的Co原子, 表示O原子)。其中Co原子的配位数分别为
表示O原子)。其中Co原子的配位数分别为___ 、___ 。
(3)以尿素为原料也可获得CoCO3并制备Co3O4。已知:尿素水溶液呈弱碱性,在70℃以上能缓慢水解产生CO ,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素、盐酸为原料,制备Co3O4的实验方案:
,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素、盐酸为原料,制备Co3O4的实验方案:___ 。
(1)以CoCl2溶液为原料,制备CoCO3的主要实验流程如图:

①“反应”时需控制温度为50~60℃,其反应的离子方程式为
②已知:Ksp[Co(OH)2]=1.6×10-15,Ksp(CoCO3)=1.4×10-13。制备CoCO3时不宜使用Na2CO3溶液代替NH4HCO3溶液,其原因是
(2)加热CoCO3制备Co3O4时有部分Co2+转化为Co3+。取1molCoCO3在空气中加热,反应温度对反应产物的影响如图1所示。参与该反应的物质还有
 、
、 表示两种不同价态的Co原子,
表示两种不同价态的Co原子, 表示O原子)。其中Co原子的配位数分别为
表示O原子)。其中Co原子的配位数分别为
(3)以尿素为原料也可获得CoCO3并制备Co3O4。已知:尿素水溶液呈弱碱性,在70℃以上能缓慢水解产生CO
 ,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素、盐酸为原料,制备Co3O4的实验方案:
,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素、盐酸为原料,制备Co3O4的实验方案:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】25℃时,电离平衡常数:
回答下列问题:
(1)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH⇌CH3CH3COO﹣+H+△H>0,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是___________ 。
a.加入少量0.10mol·L﹣1的稀盐酸
b.加热
c.加水稀释至0.010mol·L﹣1
d.加入少量冰醋酸
e.加入少量氯化钠固体
f.加入少量0.10mol·L﹣1的NaOH溶液
(2)向0.1mol/L醋酸溶液中加入水,电离平衡向_____ 移动(填“左”或“右”);n(CH3COOH)___________ ;c(CH3COO-)/c(H+)___________ (填“增大”、“减小”或“不变”);
(3)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是___________ 。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH﹣) D.c(OH﹣)/c(H+)
(4)500mL0.1mol/L醋酸溶液a和500mL0.1mol/L盐酸溶液b与足量Zn粉反应,初始速率a_______ b;生成H2的量a___________ b;完全中和这两种酸,消耗NaOH的量a_________ b(填“<”、“>”或“=”)。
(5)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图。则HX的电离平衡常数___________ (填“大于”、“等于”或“小于”)醋酸溶液。稀释后,HX溶液中水电离出来的c(H+)___________ 醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)
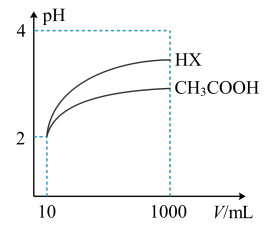
(6)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=___________ (填准确数值)。
(7)某溶液含两种相同物质的量的溶质,且其中只存在OH﹣、H+、NH 、Cl﹣四种离子,且c(NH
、Cl﹣四种离子,且c(NH )>c(Cl﹣)>c(OH﹣)>c(H+),则这两种溶质是
)>c(Cl﹣)>c(OH﹣)>c(H+),则这两种溶质是___________ 。
(8)0.1mol·L-1的氨水与0.05mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性:___________ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8 |
(1)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH⇌CH3CH3COO﹣+H+△H>0,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是
a.加入少量0.10mol·L﹣1的稀盐酸
b.加热
c.加水稀释至0.010mol·L﹣1
d.加入少量冰醋酸
e.加入少量氯化钠固体
f.加入少量0.10mol·L﹣1的NaOH溶液
(2)向0.1mol/L醋酸溶液中加入水,电离平衡向
(3)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH﹣) D.c(OH﹣)/c(H+)
(4)500mL0.1mol/L醋酸溶液a和500mL0.1mol/L盐酸溶液b与足量Zn粉反应,初始速率a
(5)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图。则HX的电离平衡常数

(6)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=
(7)某溶液含两种相同物质的量的溶质,且其中只存在OH﹣、H+、NH
 、Cl﹣四种离子,且c(NH
、Cl﹣四种离子,且c(NH )>c(Cl﹣)>c(OH﹣)>c(H+),则这两种溶质是
)>c(Cl﹣)>c(OH﹣)>c(H+),则这两种溶质是(8)0.1mol·L-1的氨水与0.05mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性:
您最近一年使用:0次



