草酸钴在化学中应用广泛,可以用于制取催化剂和指示剂。以钴矿[主要成分是 、
、 、
、 ,还含有少量
,还含有少量 、
、 、CuO、FeO及
、CuO、FeO及 杂质]制取草酸钴晶体(
杂质]制取草酸钴晶体( )
)
的工艺流程如图所示:
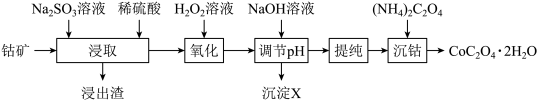
常温下,有关沉淀数据如表(“完全沉淀时,金属离子浓度 )。
)。
回答下列问题:
(1)“浸取”前,需要对钴矿进行粉碎处理的目的是_______ ;浸出渣的主要成分是_______ 。(填化学式)。浸出液中主要含有 、
、 、
、 、
、 、
、 和
和 离子,写出“浸取”时,
离子,写出“浸取”时, 发生反应的化学方程式:
发生反应的化学方程式:_______ 。
(2)“氧化”时,发生反应的离子方程式为_______ 。
(3)常温下,“调节pH”得到的沉淀X的主要成分是_______ ;若“调节pH”后,溶液中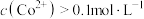 ,则需调节溶液pH的范围是
,则需调节溶液pH的范围是_______ (忽略溶液的体积变化)。
(4)“提纯”分为萃取和反萃取两步进行,先向除杂后的溶液中加入某有机酸萃取剂 ,发生反应:
,发生反应: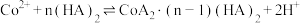 。当溶液pH处于4.5到6.5之间时,
。当溶液pH处于4.5到6.5之间时, 萃取率随着溶液pH增大而增大,其原因是
萃取率随着溶液pH增大而增大,其原因是_______ ;反萃取时,应加入的物质是_______ (填溶液名称)。
 、
、 、
、 ,还含有少量
,还含有少量 、
、 、CuO、FeO及
、CuO、FeO及 杂质]制取草酸钴晶体(
杂质]制取草酸钴晶体( )
)的工艺流程如图所示:

常温下,有关沉淀数据如表(“完全沉淀时,金属离子浓度
 )。
)。| 沉淀 |  |  |  |  |  |
| 恰好完全沉淀时pH | 10.1 | 9.4 | 6.7 | 2.8 | 5.2 |
(1)“浸取”前,需要对钴矿进行粉碎处理的目的是
 、
、 、
、 、
、 、
、 和
和 离子,写出“浸取”时,
离子,写出“浸取”时, 发生反应的化学方程式:
发生反应的化学方程式:(2)“氧化”时,发生反应的离子方程式为
(3)常温下,“调节pH”得到的沉淀X的主要成分是
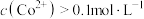 ,则需调节溶液pH的范围是
,则需调节溶液pH的范围是(4)“提纯”分为萃取和反萃取两步进行,先向除杂后的溶液中加入某有机酸萃取剂
 ,发生反应:
,发生反应: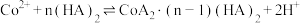 。当溶液pH处于4.5到6.5之间时,
。当溶液pH处于4.5到6.5之间时, 萃取率随着溶液pH增大而增大,其原因是
萃取率随着溶液pH增大而增大,其原因是
更新时间:2022-12-18 15:43:35
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】在25℃时对氨水进行如下操作。回答下列问题:
(1)向氨水中加入少量水,则溶液中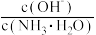 将
将_______ (填“增大”、“减小”或“不变”)。
(2)向0.1mol/L20mL氨水中逐滴加入0.1mol/L VmL盐酸。
①若使氨水恰好被中和,则所得溶液的pH_______ 7(填“>”、“<”或“=”),用离子方程式表示其原因:_______ 。
②若所得溶液 ,则此时加入盐酸的体积V
,则此时加入盐酸的体积V_______ 20mL(填“>”、“<”或“=”),溶液中 、
、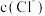 、
、 、
、 的大小关系为
的大小关系为_______ 。
③若加入盐酸的体积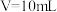 ,则此时溶液中
,则此时溶液中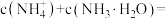
_______ mol/L。
(3)向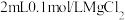 溶液中加入1mL 0.1mol/L氨水,有白色沉淀产生,继续加入4滴
溶液中加入1mL 0.1mol/L氨水,有白色沉淀产生,继续加入4滴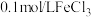 溶液,观察到白色沉淀变为红褐色。试用离子方程式解释白色沉淀变为红褐色的原因:
溶液,观察到白色沉淀变为红褐色。试用离子方程式解释白色沉淀变为红褐色的原因:_______ 。
(4)向 溶液中滴加氨水产生蓝色沉淀,若所得溶液
溶液中滴加氨水产生蓝色沉淀,若所得溶液 ,已知
,已知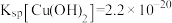 ,则溶液中
,则溶液中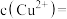
_______ mol/L。
(1)向氨水中加入少量水,则溶液中
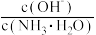 将
将(2)向0.1mol/L20mL氨水中逐滴加入0.1mol/L VmL盐酸。
①若使氨水恰好被中和,则所得溶液的pH
②若所得溶液
 ,则此时加入盐酸的体积V
,则此时加入盐酸的体积V 、
、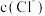 、
、 、
、 的大小关系为
的大小关系为③若加入盐酸的体积
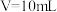 ,则此时溶液中
,则此时溶液中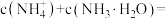
(3)向
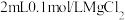 溶液中加入1mL 0.1mol/L氨水,有白色沉淀产生,继续加入4滴
溶液中加入1mL 0.1mol/L氨水,有白色沉淀产生,继续加入4滴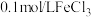 溶液,观察到白色沉淀变为红褐色。试用离子方程式解释白色沉淀变为红褐色的原因:
溶液,观察到白色沉淀变为红褐色。试用离子方程式解释白色沉淀变为红褐色的原因:(4)向
 溶液中滴加氨水产生蓝色沉淀,若所得溶液
溶液中滴加氨水产生蓝色沉淀,若所得溶液 ,已知
,已知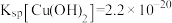 ,则溶液中
,则溶液中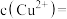
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】硫元素及其化合物在工农业生产中有重要应用。请按要求回答下列问题。
(1)基态S原子的价电子排布式为____ 。SO2为____ (填“极性”或“非极性”)分子,其中心原子的杂化类型为____ ;其分子的VSEPR模型为____ 形,分子的空间结构为____ 形,其晶体类型为____ 。
(2)燃煤废气(含N2、O2、SO2、CO2、H2O、NO2等)可与H2S反应转化为S,实现废物利用、保护环境的目的。写出其中两个反应的化学方程式____ 、____ 。
(3)化工原料CS2可利用硫(沸点为445℃)与CH4(g)为原料制备。在某温度下,S8分解为S2,与CH4(g)发生反应:2S2(g)+CH4(g) CS2(g)+2H2S(g)。
CS2(g)+2H2S(g)。
①初始时n(S2):nCH4)=2:1,当CH4的转化率为60%时,CS2的体积分数为____ 。
②写出可判断该反应达到平衡的一项标志:____ 。
③)在恒温密闭容器中一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。

i.据图分析,可得出生成CS2的反应ΔH____ 0(填“>”、“<”或“=”)。
ii.工业上通常采用在600~650℃的条件下进行此反应,而不采用低于600℃的原因是____ 。
(4)探究S2-的化学性质
①同学甲向CuCl2溶液中滴入Na2S溶液,观察有黑色沉淀生成。写出该反应的离子方程式为____ 。
②同学乙设计如图所示实验,静置一周过程中观察蛋壳内溶液无明显现象;烧杯内溶液渐渐褪色且有淡黄色浑浊。已知Ksp(CuS)=6.3×10-35。

i.可预测蛋壳外c(S2-)<____ mol/L。
ii.解释观察到现象可能的原因是S2-可通过蛋壳上的微孔。Cu2+不能:还可能是____ 。
(1)基态S原子的价电子排布式为
(2)燃煤废气(含N2、O2、SO2、CO2、H2O、NO2等)可与H2S反应转化为S,实现废物利用、保护环境的目的。写出其中两个反应的化学方程式
(3)化工原料CS2可利用硫(沸点为445℃)与CH4(g)为原料制备。在某温度下,S8分解为S2,与CH4(g)发生反应:2S2(g)+CH4(g)
 CS2(g)+2H2S(g)。
CS2(g)+2H2S(g)。①初始时n(S2):nCH4)=2:1,当CH4的转化率为60%时,CS2的体积分数为
②写出可判断该反应达到平衡的一项标志:
③)在恒温密闭容器中一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。

i.据图分析,可得出生成CS2的反应ΔH
ii.工业上通常采用在600~650℃的条件下进行此反应,而不采用低于600℃的原因是
(4)探究S2-的化学性质
①同学甲向CuCl2溶液中滴入Na2S溶液,观察有黑色沉淀生成。写出该反应的离子方程式为
②同学乙设计如图所示实验,静置一周过程中观察蛋壳内溶液无明显现象;烧杯内溶液渐渐褪色且有淡黄色浑浊。已知Ksp(CuS)=6.3×10-35。

i.可预测蛋壳外c(S2-)<
ii.解释观察到现象可能的原因是S2-可通过蛋壳上的微孔。Cu2+不能:还可能是
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某小组同学以AgCl和AgI为例探究物质的溶解度大小与沉淀转化方向之间的关系。已知:
实验Ⅰ:
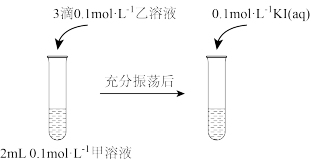
实验Ⅱ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数: )。
)。
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
请回答下列问题:
(1)实验Ⅰ证明了AgCl转化为AgI,甲溶液可以是_______ (填标号)。
a. 溶液 b.NaCl溶液 c.KI溶液
溶液 b.NaCl溶液 c.KI溶液
(2)实验Ⅰ沉淀转化反应的离子方程式是_______ 。AgCl和AgI共存的悬浊液中,
_______ (保留一位小数)。[已知: ,
,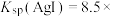
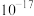 ]
]
(3)实验Ⅱ的步骤ⅰ中,B中石墨上的电极反应是_______ 。
(4)结合信息解释实验Ⅱ中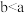 的原因:
的原因:_______ 。
(5)实验Ⅱ的现象能说明AgI转化为AgCl,理由是_______ 。
| 物质 | AgI | AgCl |
| 溶解度/g(20℃) |  | 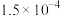 |

实验Ⅱ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:
 )。
)。| 装置 | 步骤 | 电压表读数 |
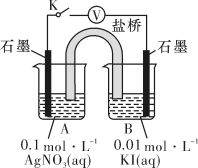 | ⅰ.按图连接装置并加入试剂,闭合K | a |
ⅱ.向B中滴入 (aq),至沉淀完全 (aq),至沉淀完全 | b | |
| ⅲ.再向B中投入一定量NaCl(s) | c | |
| ⅳ.重复ⅰ,再向B中加入与ⅲ等量的NaCl(s) | a |
请回答下列问题:
(1)实验Ⅰ证明了AgCl转化为AgI,甲溶液可以是
a.
 溶液 b.NaCl溶液 c.KI溶液
溶液 b.NaCl溶液 c.KI溶液(2)实验Ⅰ沉淀转化反应的离子方程式是

 ,
,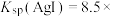
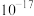 ]
](3)实验Ⅱ的步骤ⅰ中,B中石墨上的电极反应是
(4)结合信息解释实验Ⅱ中
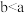 的原因:
的原因:(5)实验Ⅱ的现象能说明AgI转化为AgCl,理由是
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】钪(Sc)是一种典型的稀散元素,具有重要的工业利用价值,从钛尾矿( mSc2O3·nTiO2·xFeO·ySiO2)中提取Sc2O3的流程如下:

(1)“焙烧”时,为提高焙烧效率,下列措施中无效的是___________ (填标号)
a.不断搅拌 b.进一步粉碎固体颗粒 c.增大压强 d.适当升高温度
(2)“酸浸”时,需在80℃条件下进行,则适宜的加热方式为______________________ 。
(3)“萃取”时,使用伯胺N1923的煤油溶液作为萃取液,萃取率α受振荡时间和萃取剂浓度的影响,椴据下表1和表2数据,萃取时适宜的振荡时间和萃取剂浓度分别为___________ min、___________ %。
表1 振荡时间对萃取率的影响
表2 萃取剂浓度对萃取率的影响
(4)“酸洗”后滤液中存在的金属阳离子有Na+、Sc3+、Ti4+、Fe2+,且浓度均小于0.100mol·L-1,“反萃取”时,加氢氧化钠溶液调节溶液pH=__________ 时,可使Sc3+沉淀完全(当离子浓度减小至10-5 mol·L-1时,可认为沉淀完全),从滤渣Ⅲ中可以回收的金属元素名称为__________ 。(已知;lg2=0.3,1g5=0.7;室温下,Ti4+完全沉淀的pH为1.05,Ksp[Fe(OH)2]=4.0×10-17,Ksp[Sc(OH)3]=1.25×10-33)
(5)草酸钪[Sc2(C2O4)3]在空气中“灼烧”的化学方程式为______________________ 。
(6)若从1吨该钛尾矿中提取得到110.4gSc2O3,则该矿中含钪的质量分数为___________ 。

(1)“焙烧”时,为提高焙烧效率,下列措施中无效的是
a.不断搅拌 b.进一步粉碎固体颗粒 c.增大压强 d.适当升高温度
(2)“酸浸”时,需在80℃条件下进行,则适宜的加热方式为
(3)“萃取”时,使用伯胺N1923的煤油溶液作为萃取液,萃取率α受振荡时间和萃取剂浓度的影响,椴据下表1和表2数据,萃取时适宜的振荡时间和萃取剂浓度分别为
表1 振荡时间对萃取率的影响
| t/min | 1 | 2 | 5 | 10 | 15 |
| α(Sc3+)/% | 85.2 | 89.3 | 91.2 | 98.7 | 98.8 |
| α(Ti4+)/% | 4.9 | 8.9 | 9.6 | 10.0 | 11.3 |
| α(Fe2+)/% | 0.90 | 1.00 | 1.31 | 1.41 | 1.43 |
| 伯胺N1923/% | 1 | 5 | 10 | 15 | 20 |
| α(Sc3+)/% | 86.7 | 93.1 | 94.2 | 98.8 | 98.9 |
| α(Ti4+)/% | 8.1 | 9.0 | 9.9 | 10.1 | 11.7 |
| α(Fe2+)/% | 0.91 | 1.20 | 1.31 | 1.43 | 2.13 |
(5)草酸钪[Sc2(C2O4)3]在空气中“灼烧”的化学方程式为
(6)若从1吨该钛尾矿中提取得到110.4gSc2O3,则该矿中含钪的质量分数为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】七水合硫酸亚铁( )是一种重要的食品或饲料添加剂、颜料及电子工业的原材料。某同学设计了利用工业烧渣(工业烧渣的主要成分是FeO 、Fe2O3、Al2O3、SiO2)并采用如图流程来制备七水合硫酸亚铁:
)是一种重要的食品或饲料添加剂、颜料及电子工业的原材料。某同学设计了利用工业烧渣(工业烧渣的主要成分是FeO 、Fe2O3、Al2O3、SiO2)并采用如图流程来制备七水合硫酸亚铁:
(1)工业烧渣中Fe2O3与稀硫酸反应的离子方程式________________________________ 。
(2)加入的试剂X是:____________ 。
A.NaOH B.HNO3 C.Cu D.Fe
(3)固体2的主要成分是____________ (填化学式)。
(4)若需检验还原后的FeSO4溶液中是否存在有Fe3+,可选择的方法是取2-3mL试液,在其中滴加_________ 溶液(填名称 ),当_________ 时(填实验现象),说明溶液中存在Fe3+。
(5)利用工业烧渣还可以制得一种重要的净水剂Na2FeO4,其基本原理是先由烧渣制得氢氧化铁,再将氢氧化铁与NaClO、烧碱在40℃ 反应,即可制备Na2FeO4,其中NaClO被还原成NaCl,此方法称为“湿法”;请写出湿法制备Na2FeO4的化学方程式:______________________ 。
(6)制备Na2FeO4还有一种方法称为“干法”,其反应原理为: ;若用FeSO4·7H2O替代FeSO4进行上述反应,当标准状况下产生11.2L O2时,需要FeSO4·7H2O的质量是
;若用FeSO4·7H2O替代FeSO4进行上述反应,当标准状况下产生11.2L O2时,需要FeSO4·7H2O的质量是__________ g。(已知FeSO4的相对分子质量为152)
 )是一种重要的食品或饲料添加剂、颜料及电子工业的原材料。某同学设计了利用工业烧渣(工业烧渣的主要成分是FeO 、Fe2O3、Al2O3、SiO2)并采用如图流程来制备七水合硫酸亚铁:
)是一种重要的食品或饲料添加剂、颜料及电子工业的原材料。某同学设计了利用工业烧渣(工业烧渣的主要成分是FeO 、Fe2O3、Al2O3、SiO2)并采用如图流程来制备七水合硫酸亚铁: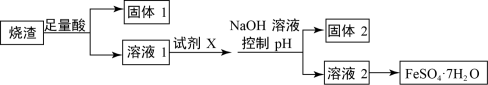
(1)工业烧渣中Fe2O3与稀硫酸反应的离子方程式
(2)加入的试剂X是:
A.NaOH B.HNO3 C.Cu D.Fe
(3)固体2的主要成分是
(4)若需检验还原后的FeSO4溶液中是否存在有Fe3+,可选择的方法是取2-3mL试液,在其中滴加
(5)利用工业烧渣还可以制得一种重要的净水剂Na2FeO4,其基本原理是先由烧渣制得氢氧化铁,再将氢氧化铁与NaClO、烧碱在40℃ 反应,即可制备Na2FeO4,其中NaClO被还原成NaCl,此方法称为“湿法”;请写出湿法制备Na2FeO4的化学方程式:
(6)制备Na2FeO4还有一种方法称为“干法”,其反应原理为:
 ;若用FeSO4·7H2O替代FeSO4进行上述反应,当标准状况下产生11.2L O2时,需要FeSO4·7H2O的质量是
;若用FeSO4·7H2O替代FeSO4进行上述反应,当标准状况下产生11.2L O2时,需要FeSO4·7H2O的质量是
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】SCR催化剂是工业上广泛应用的燃煤烟气脱硝催化剂,其主要成分为WO3、TiO2、V2O5,以及少量SiO2、CaO、Al2O3、Fe2O3等。一种从废SCR催化剂中回收钨的工艺如下:

回答下列问题
(1)“酸浸还原”中V2O5转化成可溶于水的VOC2O4,VOC2O4中V的化合价是___________ ,该反应的化学方程式为___________ 。可用浓盐酸代替草酸,但缺点是___________ 。
(2)“碱浸”时WO3转化为WO 的离子方程式为
的离子方程式为___________ 。
(3)“试剂a”可选用___________ (选填“盐酸”、“氢氧化钠”或“氨水”)。“滤渣”的主要成分是___________ 。
(4)常温下Ksp[Ca(OH)2]=5.5×10-6,Ksp(CaWO4)=8.7×10-9。“沉钨”过程中不断加入石灰乳,当测得“滤液”中pH=13时,c(WO )为
)为___________ mol·L-l(保留2位有效数字)
(5)“熔融电解”过程中阴极反应为WO +6e-=W+4O2-。电解过程中石墨阳极有损耗并有气体产生,用反应方程式解释该现象
+6e-=W+4O2-。电解过程中石墨阳极有损耗并有气体产生,用反应方程式解释该现象___________ 。

回答下列问题
(1)“酸浸还原”中V2O5转化成可溶于水的VOC2O4,VOC2O4中V的化合价是
(2)“碱浸”时WO3转化为WO
 的离子方程式为
的离子方程式为(3)“试剂a”可选用
(4)常温下Ksp[Ca(OH)2]=5.5×10-6,Ksp(CaWO4)=8.7×10-9。“沉钨”过程中不断加入石灰乳,当测得“滤液”中pH=13时,c(WO
 )为
)为(5)“熔融电解”过程中阴极反应为WO
 +6e-=W+4O2-。电解过程中石墨阳极有损耗并有气体产生,用反应方程式解释该现象
+6e-=W+4O2-。电解过程中石墨阳极有损耗并有气体产生,用反应方程式解释该现象
您最近半年使用:0次



