回答下列问题:
(1)某研究性学习小组利用Na2S2O3溶液和稀硫酸溶液的反应生成单质硫和二氧化硫,探究浓度和温度对化学反应速率的影响,进行了如下实验:
①写出该反应的离子方程式:_______ 。
②V1 =_______ 、T1 = _______ ;V2 = _______ 。
③实验A、B两个实验对比,可以研究的问题是:_______
(2)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
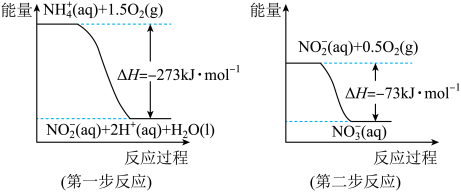
1 mol NH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是_______ 。
(3)有人用图3进行H2O2与MnO2反应的速率测定实验。
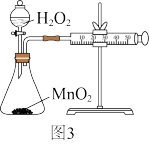
①有人认为可将装置改进为图4,你认为是否合理_______ (选填“合理”或“不合理”)。
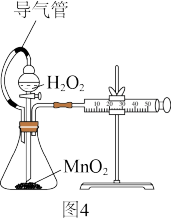
②实验中,加入10ml 2mol/L的H2O2,反应10s时,收集到22.4mL氧气,则这10s内,用过氧化氢表示的反应速率是_______ mol/(L·s)。
(1)某研究性学习小组利用Na2S2O3溶液和稀硫酸溶液的反应生成单质硫和二氧化硫,探究浓度和温度对化学反应速率的影响,进行了如下实验:
| 实验序号 | 实验温度/K | 有关物质 | 浑浊所需时间/s | ||||
| 稀硫酸溶液 | Na2S2O3溶液 | H2O | |||||
| V/mL | c/mol·L–1 | V/mL | c/mol·L–1 | V/mL | |||
| A | 298 | 2 | 0.1 | 5 | 0.1 | 0 | t1 |
| B | T1 | 2 | 0.1 | 4 | 0.1 | V1 | 8 |
| C | 313 | 2 | 0.1 | V2 | 0.1 | 1 | t2 |
②V1 =
③实验A、B两个实验对比,可以研究的问题是:
(2)在微生物作用的条件下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
1 mol NH
 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是(3)有人用图3进行H2O2与MnO2反应的速率测定实验。

①有人认为可将装置改进为图4,你认为是否合理

②实验中,加入10ml 2mol/L的H2O2,反应10s时,收集到22.4mL氧气,则这10s内,用过氧化氢表示的反应速率是
更新时间:2023-01-03 21:28:51
|
相似题推荐
【推荐1】零价纳米铁在环境修复中具有广泛应用,可用来处理地下水中的铼酸根离子( )。
)。
资料:零价纳米铁胶粒表面带正电,采用物理吸附和还原的共同作用,可将ReO 固定,防止其随地下水的运动而迁移。
固定,防止其随地下水的运动而迁移。
(1)利用无机炭作为还原剂,在高温下通过氧化还原反应来制备零价纳米铁,涉及的反应有:
6Fe2O3(s)+C(s)=4Fe3O4(s)+CO2(g) ∆H=+akJ/mol
Fe3O4(s)+2C(s)=3Fe(s)+2CO2(g) ∆H=+bkJ/mol
写出无机炭还原氧化铁制备纳米铁的热化学方程式___ 。
(2)液相还原法也可用来制备零价纳米铁。
将50mLKBH4(B元素的化合价为+3)水溶液添加到50mLFeSO4水溶液中,搅拌数秒钟,溶液变黑时停止搅拌,用磁铁分离沉淀,先用蒸馏水充分洗涤,再用无水乙醇洗涤3次,氮气保护下烘干,即得所需纳米铁。反应原理为:Fe2++2 +6H2O=Fe↓+2B(OH)3↓+7H2↑
+6H2O=Fe↓+2B(OH)3↓+7H2↑
①氮气作用下烘干的目的是___ 。
②每生成1molFe,转移电子数为___ 。
(3)零价纳米铁具有很强的还原能力。某酸性样品溶液中含有K+、Na+、Ca2+、Cl-、 等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的
等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的 还原成固态的ReO2而除去,自身转化成Fe3+。
还原成固态的ReO2而除去,自身转化成Fe3+。
①写出反应的离子方程式___ 。
②反应后样品溶液中阴离子浓度降低,而阳离子浓度几乎无变化,可能的原因是___ 。
③研究表明pH过高或过低会使 的去除率降低,可能的原因分别是
的去除率降低,可能的原因分别是___ 。
 )。
)。资料:零价纳米铁胶粒表面带正电,采用物理吸附和还原的共同作用,可将ReO
 固定,防止其随地下水的运动而迁移。
固定,防止其随地下水的运动而迁移。(1)利用无机炭作为还原剂,在高温下通过氧化还原反应来制备零价纳米铁,涉及的反应有:
6Fe2O3(s)+C(s)=4Fe3O4(s)+CO2(g) ∆H=+akJ/mol
Fe3O4(s)+2C(s)=3Fe(s)+2CO2(g) ∆H=+bkJ/mol
写出无机炭还原氧化铁制备纳米铁的热化学方程式
(2)液相还原法也可用来制备零价纳米铁。
将50mLKBH4(B元素的化合价为+3)水溶液添加到50mLFeSO4水溶液中,搅拌数秒钟,溶液变黑时停止搅拌,用磁铁分离沉淀,先用蒸馏水充分洗涤,再用无水乙醇洗涤3次,氮气保护下烘干,即得所需纳米铁。反应原理为:Fe2++2
 +6H2O=Fe↓+2B(OH)3↓+7H2↑
+6H2O=Fe↓+2B(OH)3↓+7H2↑①氮气作用下烘干的目的是
②每生成1molFe,转移电子数为
(3)零价纳米铁具有很强的还原能力。某酸性样品溶液中含有K+、Na+、Ca2+、Cl-、
 等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的
等离子。在酸性环境下,用零价纳米铁可将该样品溶液中的 还原成固态的ReO2而除去,自身转化成Fe3+。
还原成固态的ReO2而除去,自身转化成Fe3+。①写出反应的离子方程式
②反应后样品溶液中阴离子浓度降低,而阳离子浓度几乎无变化,可能的原因是
③研究表明pH过高或过低会使
 的去除率降低,可能的原因分别是
的去除率降低,可能的原因分别是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】 是一种丰富的碳资源,将清洁转化为高附加值化学品以实现资源利用是研究热点。
是一种丰富的碳资源,将清洁转化为高附加值化学品以实现资源利用是研究热点。
I.合成甲醇
在 的
的 加氢反应器中,主要反应有:
加氢反应器中,主要反应有:
反应i
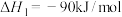
反应ii
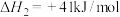
反应iii

(1)
______ KJ/mol。
(2)同时也存在副反应iv: ,反应器进行一段时间后要间歇降到室温,可提高甲醇的产率。对比反应iii、iv,解释其原因
,反应器进行一段时间后要间歇降到室温,可提高甲醇的产率。对比反应iii、iv,解释其原因______ 。(已知 的沸点为
的沸点为 的沸点为
的沸点为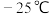 )
)
Ⅱ.甲醇的综合利用:以 和甲醇为原料直接合成碳酸二甲酯
和甲醇为原料直接合成碳酸二甲酯 。
。
反应v
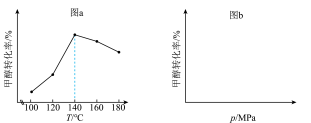
(3)在不同的实验条件下,测定甲醇的转化率。温度的数据结果为图a,压强的数据结果在图b中未画出。
①反应 的
的
______ 0(填“>”或“<”)。
②在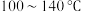 之间,随着温度升高,甲醇转化率增大的原因是
之间,随着温度升高,甲醇转化率增大的原因是______ 。
③在图b中绘制出压强和甲醇转化率之间的关系(作出趋势即可)______ 。
 是一种丰富的碳资源,将清洁转化为高附加值化学品以实现资源利用是研究热点。
是一种丰富的碳资源,将清洁转化为高附加值化学品以实现资源利用是研究热点。I.合成甲醇

在
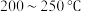 的
的 加氢反应器中,主要反应有:
加氢反应器中,主要反应有:反应i

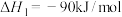
反应ii

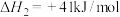
反应iii


(1)

(2)同时也存在副反应iv:
 ,反应器进行一段时间后要间歇降到室温,可提高甲醇的产率。对比反应iii、iv,解释其原因
,反应器进行一段时间后要间歇降到室温,可提高甲醇的产率。对比反应iii、iv,解释其原因 的沸点为
的沸点为 的沸点为
的沸点为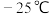 )
)Ⅱ.甲醇的综合利用:以
 和甲醇为原料直接合成碳酸二甲酯
和甲醇为原料直接合成碳酸二甲酯 。
。反应v

(3)在不同的实验条件下,测定甲醇的转化率。温度的数据结果为图a,压强的数据结果在图b中未画出。
①反应
 的
的
②在
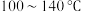 之间,随着温度升高,甲醇转化率增大的原因是
之间,随着温度升高,甲醇转化率增大的原因是③在图b中绘制出压强和甲醇转化率之间的关系(作出趋势即可)

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】为了实现“将全球温度上升幅度控制在2℃以内”的目标,科学家正在研究温室气体CO2的转化和利用。
(1)海洋是地球上碳元素的最大“吸收池”
①溶于海水中的CO2主要以四种无机碳形式存在,分别为CO2、H2CO3、CO32-和_________ (填离子符号)。
②在海洋中,可通过如图所示的途径来固碳。则发生光合作用时,CO2与H2O反应生成(CH2O)x和O2的化学方程式为__________________ 。

(2)有科学家提出可利用FeO来吸收CO2,已知:
C(s)+2H2O(g) CO2(g)+2H2(g) △H=+113.4 kJ·mol-1
CO2(g)+2H2(g) △H=+113.4 kJ·mol-1
3FeO(s)+H2O(g) Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1
Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1
则6FeO(s)+CO2(g) 2Fe3O4(s)+C(s) △H=
2Fe3O4(s)+C(s) △H=_____ kJ·mol-1。
(3)以CO2为原料可制备甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g),向一恒容密闭容器中充入1moCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g),向一恒容密闭容器中充入1moCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。

①若A点的正反应速率用v正(CO2)来表示,A点的逆反应速率用v逆(CO2)来表示,则v正(CO2)_______ (填“>”“ <”或“=”)v逆(CO2)。
②0~3min内,氢气的平均反应速率v(H2)_______________ 。
(4)在一定条件下,二氧化碳转化为甲烷:CO2(g)+4H2(g) CH4(g)+2 H2O(g),△H。向一密闭容积正充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。则该温度下上述反应的平衡常数K=
CH4(g)+2 H2O(g),△H。向一密闭容积正充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。则该温度下上述反应的平衡常数K= ________ 。若200℃时该反应的平衡常数K=64.8,则该反应的△H_____ (填“>’’或“<”)O。
(1)海洋是地球上碳元素的最大“吸收池”
①溶于海水中的CO2主要以四种无机碳形式存在,分别为CO2、H2CO3、CO32-和
②在海洋中,可通过如图所示的途径来固碳。则发生光合作用时,CO2与H2O反应生成(CH2O)x和O2的化学方程式为

(2)有科学家提出可利用FeO来吸收CO2,已知:
C(s)+2H2O(g)
 CO2(g)+2H2(g) △H=+113.4 kJ·mol-1
CO2(g)+2H2(g) △H=+113.4 kJ·mol-1 3FeO(s)+H2O(g)
 Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1
Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1则6FeO(s)+CO2(g)
 2Fe3O4(s)+C(s) △H=
2Fe3O4(s)+C(s) △H=(3)以CO2为原料可制备甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),向一恒容密闭容器中充入1moCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g),向一恒容密闭容器中充入1moCO2(g)和3molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
①若A点的正反应速率用v正(CO2)来表示,A点的逆反应速率用v逆(CO2)来表示,则v正(CO2)
②0~3min内,氢气的平均反应速率v(H2)
(4)在一定条件下,二氧化碳转化为甲烷:CO2(g)+4H2(g)
 CH4(g)+2 H2O(g),△H。向一密闭容积正充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。则该温度下上述反应的平衡常数K=
CH4(g)+2 H2O(g),△H。向一密闭容积正充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时测得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。则该温度下上述反应的平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)若经2s后测得C的浓度为0.6mol/L,现有下列几种说法:①用物质A表示的反应的平均速率为0.3mol·L-1·s-1②用物质B表示的反应的平均速率为0.6mol·L-1·s-1③2s时物质A的转化率为70%④2s时物质B的浓度为0.7mol/L其中正确的是
2C(g)若经2s后测得C的浓度为0.6mol/L,现有下列几种说法:①用物质A表示的反应的平均速率为0.3mol·L-1·s-1②用物质B表示的反应的平均速率为0.6mol·L-1·s-1③2s时物质A的转化率为70%④2s时物质B的浓度为0.7mol/L其中正确的是________________
A.①④B.①③C.②③D.③④
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比。
(1)一定能证明2SO2(g)+O2(g) 2SO3(g)达到平衡状态的是
2SO3(g)达到平衡状态的是_______ (填序号,下同)。
(2)一定能证明I2(g)+H2(g) 2HI(g)达到平衡状态的是
2HI(g)达到平衡状态的是_________ 。
(3)一定能证明A(s)+2B(g) C(g)+D(g)达到平衡状态的是
C(g)+D(g)达到平衡状态的是________ 。(注:B、C、D均为无色物质)
Ⅲ.(1)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4+2H2O Pb+PbO2+2H2SO4,放电过程中硫酸浓度由5mol/L下降到4mol/L,电解液体积为2L(反应过程溶液体积变化忽略不计),则放电过程中外电路中转移电子的物质的量为
Pb+PbO2+2H2SO4,放电过程中硫酸浓度由5mol/L下降到4mol/L,电解液体积为2L(反应过程溶液体积变化忽略不计),则放电过程中外电路中转移电子的物质的量为___________ mol。
(2)有人设计将两根Pt丝作电极插入KOH溶液中,然后向两极上分别通入乙醇和氧气而构成燃料电池。此燃料电池工作时,其负极电极反应式为:________________ 。
 2C(g)若经2s后测得C的浓度为0.6mol/L,现有下列几种说法:①用物质A表示的反应的平均速率为0.3mol·L-1·s-1②用物质B表示的反应的平均速率为0.6mol·L-1·s-1③2s时物质A的转化率为70%④2s时物质B的浓度为0.7mol/L其中正确的是
2C(g)若经2s后测得C的浓度为0.6mol/L,现有下列几种说法:①用物质A表示的反应的平均速率为0.3mol·L-1·s-1②用物质B表示的反应的平均速率为0.6mol·L-1·s-1③2s时物质A的转化率为70%④2s时物质B的浓度为0.7mol/L其中正确的是A.①④B.①③C.②③D.③④
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比。
(1)一定能证明2SO2(g)+O2(g)
 2SO3(g)达到平衡状态的是
2SO3(g)达到平衡状态的是(2)一定能证明I2(g)+H2(g)
 2HI(g)达到平衡状态的是
2HI(g)达到平衡状态的是(3)一定能证明A(s)+2B(g)
 C(g)+D(g)达到平衡状态的是
C(g)+D(g)达到平衡状态的是Ⅲ.(1)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4+2H2O
 Pb+PbO2+2H2SO4,放电过程中硫酸浓度由5mol/L下降到4mol/L,电解液体积为2L(反应过程溶液体积变化忽略不计),则放电过程中外电路中转移电子的物质的量为
Pb+PbO2+2H2SO4,放电过程中硫酸浓度由5mol/L下降到4mol/L,电解液体积为2L(反应过程溶液体积变化忽略不计),则放电过程中外电路中转移电子的物质的量为(2)有人设计将两根Pt丝作电极插入KOH溶液中,然后向两极上分别通入乙醇和氧气而构成燃料电池。此燃料电池工作时,其负极电极反应式为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】氮及其化合物在化肥、医药、材料等领域具有广泛应用,一定温度下,在容积固定为2L的密闭容器内充入4molN2,发生反应:2N2(g)=N4(g),测得不同时刻N4的浓度如下表:
请回答下列问题。
(1)从反应开始到15min,用N4表示的平均反应速率为___________ 。
(2)该反应达到平衡时,N2的转化率为___________ 。
(3)以下操作可以使化学反应速率变快的是___________ (填字母)。
A.将容器体积变为1L
B.适当降低温度
C.加入合适的催化剂
D.恒压条件下通入He
E.恒容条件下通入He
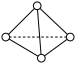
(4)N4分子呈正四面体结构,结构如图所示。已知断裂1molN—N键吸收170kJ热量,断裂1molN≡N键吸收942kJ热量,则1molN2气体转化为N4时要吸收热量___________ kJ。
(5)若在恒容绝热条件下发生上述反应,下列叙述能判断该反应达到平衡状态的是______(填字母)。
(6)有人设想以N2和H2为反应物,以溶有A的盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。
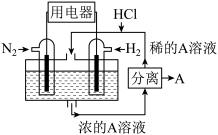
①A是___________ (填化学式)。
②该电池负极消耗1mol气体时,电路中转移的电子的物质的量为___________ 。
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| N4的浓度/mol•L-1 | 0 | 0.21 | 0.38 | 0.45 | 0.48 | 0.50 | 0.50 |
(1)从反应开始到15min,用N4表示的平均反应速率为
(2)该反应达到平衡时,N2的转化率为
(3)以下操作可以使化学反应速率变快的是
A.将容器体积变为1L
B.适当降低温度
C.加入合适的催化剂
D.恒压条件下通入He
E.恒容条件下通入He
(4)N4分子呈正四面体结构,结构如图所示。已知断裂1molN—N键吸收170kJ热量,断裂1molN≡N键吸收942kJ热量,则1molN2气体转化为N4时要吸收热量

(5)若在恒容绝热条件下发生上述反应,下列叙述能判断该反应达到平衡状态的是______(填字母)。
| A.2v正(N2)=v逆(N4) | B.温度不变 |
| C.混合气体的密度不变 | D.混合气体的平均相对分子质量不变 |

①A是
②该电池负极消耗1mol气体时,电路中转移的电子的物质的量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】工业上利用CO2和H2反应生成甲醇,也是减少CO2的一种方法。在容积为1 L的恒温恒容密闭容器中充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从反应开始到10分钟平衡,用CO2浓度的变化表示的反应速率v(CO2)=_______ mol/(L·min)。
(2)能判断该反应达到化学平衡状态的依据是_______。
(3)求该反应的平衡常数表达式K=_______ 。达平衡后,H2的转化率是_______ 。
(4)工业上也可用CO和H2合成甲醇
已知:①CO(g)+ O2(g)=CO2(g) △H1=-283.0 kJ/mol
O2(g)=CO2(g) △H1=-283.0 kJ/mol
②H2(g)+ O2(g)=H2O(g) △H2=-241.8 kJ/mol
O2(g)=H2O(g) △H2=-241.8 kJ/mol
③CH3OH(g)+ O2(g)=CO2(g)+2H2O(g) △H3=-192.2 kJ/mol
O2(g)=CO2(g)+2H2O(g) △H3=-192.2 kJ/mol
则反应CO(g)+2H2(g)=CH3OH(g) △H=_______ kJ/mol
(5)环戊二烯( )容易发生聚合生成二聚体,该反应为可逆反应。不同温度T1、T2下,溶液中环戊二烯浓度与反应时间的关系如图所示。回答下列问题:
)容易发生聚合生成二聚体,该反应为可逆反应。不同温度T1、T2下,溶液中环戊二烯浓度与反应时间的关系如图所示。回答下列问题:

①比较b、c处反应速率大小:v(b)_______ v(c) (填“大于”“小于”或“等于”)。
②比较反应温度T1、T2的大小:T1_______ T2 (填“大于”“小于”或“等于”)。
 CH3OH(g)+H2O(g) △H=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到10分钟平衡,用CO2浓度的变化表示的反应速率v(CO2)=
(2)能判断该反应达到化学平衡状态的依据是_______。
| A.容器内压强不变 | B.混合气体中c(CO2)不变 |
| C.v(CH3OH)=v(H2O) | D.混合气体的密度不变 |
(4)工业上也可用CO和H2合成甲醇
已知:①CO(g)+
 O2(g)=CO2(g) △H1=-283.0 kJ/mol
O2(g)=CO2(g) △H1=-283.0 kJ/mol②H2(g)+
 O2(g)=H2O(g) △H2=-241.8 kJ/mol
O2(g)=H2O(g) △H2=-241.8 kJ/mol③CH3OH(g)+
 O2(g)=CO2(g)+2H2O(g) △H3=-192.2 kJ/mol
O2(g)=CO2(g)+2H2O(g) △H3=-192.2 kJ/mol则反应CO(g)+2H2(g)=CH3OH(g) △H=
(5)环戊二烯(
 )容易发生聚合生成二聚体,该反应为可逆反应。不同温度T1、T2下,溶液中环戊二烯浓度与反应时间的关系如图所示。回答下列问题:
)容易发生聚合生成二聚体,该反应为可逆反应。不同温度T1、T2下,溶液中环戊二烯浓度与反应时间的关系如图所示。回答下列问题:
①比较b、c处反应速率大小:v(b)
②比较反应温度T1、T2的大小:T1
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”。实验时,先分别量取KMnO4酸性溶液、H2C2O4溶液,然后倒入大试管中迅速振荡,观察现象。
(1)可通过测定________ 来判断反应的快慢。
(2)为了观察到明显的现象,如果H2C2O4与KMnO4溶液的体积相同,则它们初始物质的量浓度需要满足的关系为:c(H2C2O4):c(KMnO4)______ 。
(3)甲同学设计了如表实验:
①V1=_____ ,T1=_____ 。
②若t1<8,则由实验A、B可以得出的结论是________ ;利用实验B中数据计算,从反应开始到结束,用KMnO4的浓度变化表示的反应速率为________ mol•L-1•s-1。
(4)用硫代硫酸钠和硫酸溶液发生反应时溶液变浑浊的时间,也可研究外界条件对化学反应速率的影响,写出相应反应的离子方程式_______ 。
(1)可通过测定
(2)为了观察到明显的现象,如果H2C2O4与KMnO4溶液的体积相同,则它们初始物质的量浓度需要满足的关系为:c(H2C2O4):c(KMnO4)
(3)甲同学设计了如表实验:
| 实验序号 | 实验温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
| V(mL) | C(mol/L) | V(mL) | C(mol/L) | V(mL) | t(s) | ||
| A | 293K | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
| B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
| C | 313K | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
②若t1<8,则由实验A、B可以得出的结论是
(4)用硫代硫酸钠和硫酸溶液发生反应时溶液变浑浊的时间,也可研究外界条件对化学反应速率的影响,写出相应反应的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】碳酸锂(相对分子质量为74)广泛应用于化工、冶金、陶瓷、医药、制冷、焊接、锂合金等行业。制备流程如下:
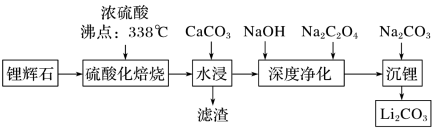
已知:碳酸锂的溶解度(g·L-1)见下表。
(1)硫酸化焙烧工业反应温度控制在250~300 ℃,主要原因是___________ ;同时,硫酸用量为理论耗酸量的115%左右,硫酸如果加入过多则___________ (填字母)。
A.增加酸耗量
B.增加后续杂质的处理量
C.增加后续中和酸的负担
(2)水浸时,需要在搅拌下加入石灰石粉末的主要作用是___________ 。
(3)“沉锂”需要在95 ℃以上进行,主要原因是___________ 。过滤碳酸锂所得母液中主要含有Na2SO4,还可能含有___________ 。

已知:碳酸锂的溶解度(g·L-1)见下表。
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(1)硫酸化焙烧工业反应温度控制在250~300 ℃,主要原因是
A.增加酸耗量
B.增加后续杂质的处理量
C.增加后续中和酸的负担
(2)水浸时,需要在搅拌下加入石灰石粉末的主要作用是
(3)“沉锂”需要在95 ℃以上进行,主要原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速的影响”。
(1)向酸性KMnO4溶液中加入一定量的H2C2O4溶液,当溶液中的KMnO4耗尽后,溶液紫色将褪去。为确保能观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4)∶n(KMnO4)___ 。
(2)为探究反应物浓度对化学反应速率的影响,该小组设计了如下实验方案:
表中x=___ mL,理由是___ 。
(3)已知50℃时,浓度c(H2C2O4)随反应时间t的变化曲线如图示,若保持其他条件不变,请在坐标图中画出25℃时c(H2C2O4)随t的变化曲线示意图___ 。

(1)向酸性KMnO4溶液中加入一定量的H2C2O4溶液,当溶液中的KMnO4耗尽后,溶液紫色将褪去。为确保能观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4)∶n(KMnO4)
(2)为探究反应物浓度对化学反应速率的影响,该小组设计了如下实验方案:
| 实验 序号 | 反应温 度/℃ | H2C2O4溶液 | 酸性KMnO4溶液 | H2O | ||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | ||
| ① | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| ② | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
(3)已知50℃时,浓度c(H2C2O4)随反应时间t的变化曲线如图示,若保持其他条件不变,请在坐标图中画出25℃时c(H2C2O4)随t的变化曲线示意图

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】已知将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应H2O2+2H++2I-=2H2O+I2,且生成I2立即与试剂X反应而被消耗。一段时间后,试剂X将被反应生成的I2完全消耗。由于溶液中I-继续被H2O2氧化,生成I2与淀粉作用,溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需时间,即可推算反应H2O2+2H++2I-=2H2O+I2的反应速率。下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
回答下列问题:
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-=2H2O+I2反应速率的影响。实验2中m=_______ 。
(2)一定温度下,H2O2+2H++2I-=2H2O+I2,反应速率可以表示为:v=k·ca(H2O2)·cb(I-)·c(H+) (k为反应速率常数),则:
①实验4烧杯中溶液开始变蓝的时间t=_______ min。
②根据上表数据可知,b =_______ 。
(3)已知I2与X反应时,两者物质的量之比为1∶2。按上面表格中的X和KI的加入量,加入V(H2O2)>_______ ,才确保看到蓝色。
(4)若要探究温度对H2O2+2H++2I-=2H2O+I2反应速率影响,在实验中温度不宜过高且采用水浴加热,其原因是_______ 。
| 编 号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
| 0.1 mol/LKI溶液 | H2O | 0.01 mol/LX溶液 | 0.1 mol/L双氧水 | 0.1 mol/L稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | 无 | t |
| 5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-=2H2O+I2反应速率的影响。实验2中m=
(2)一定温度下,H2O2+2H++2I-=2H2O+I2,反应速率可以表示为:v=k·ca(H2O2)·cb(I-)·c(H+) (k为反应速率常数),则:
①实验4烧杯中溶液开始变蓝的时间t=
②根据上表数据可知,b =
(3)已知I2与X反应时,两者物质的量之比为1∶2。按上面表格中的X和KI的加入量,加入V(H2O2)>
(4)若要探究温度对H2O2+2H++2I-=2H2O+I2反应速率影响,在实验中温度不宜过高且采用水浴加热,其原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】为减少 对环境造成的影响,可采用“
对环境造成的影响,可采用“ 催化加经制甲醇”方法将其资源化利用。该反应体系中涉及以下两个反应:
催化加经制甲醇”方法将其资源化利用。该反应体系中涉及以下两个反应:
I.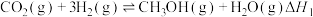
Ⅱ.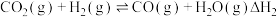
回答下列问题:
(1)反应Ⅰ、Ⅱ的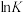 (
( 代表化学平衡常数)随
代表化学平衡常数)随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。
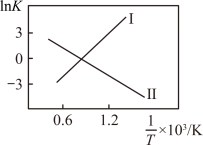

___________ 0(填“>”、“<”或“=”);升高温度,反应 的化学平衡常数
的化学平衡常数___________ (填“增大”、“减小”或“不变”)。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________(填字母)。
(3)恒压下将 和
和 按体积比
按体积比 混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内
混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内 的选择性和产率随温度的变化如图。
的选择性和产率随温度的变化如图。
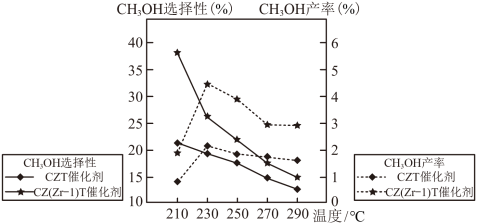
其中: 的选择性
的选择性
①在上述条件下合成甲醇的工业条件是___________ (填字母)。
A. B.
B. C.催化CZT D.催化剂
C.催化CZT D.催化剂
②在 以上,升高温度
以上,升高温度 的转化率增大,但甲醇的产率降低,原因是
的转化率增大,但甲醇的产率降低,原因是___________ 。
(4)恒温恒压密闭容器中,加入 和
和 ,只发生反应I和反应Ⅱ,初始压强为
,只发生反应I和反应Ⅱ,初始压强为 ,在
,在 发生反应,反应达平衡时,
发生反应,反应达平衡时, 的转化率为
的转化率为 ,容器体积减小
,容器体积减小 。则反应Ⅱ的平衡常数
。则反应Ⅱ的平衡常数
___________ (保留两位有效数字)。
 对环境造成的影响,可采用“
对环境造成的影响,可采用“ 催化加经制甲醇”方法将其资源化利用。该反应体系中涉及以下两个反应:
催化加经制甲醇”方法将其资源化利用。该反应体系中涉及以下两个反应:I.
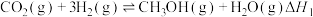
Ⅱ.
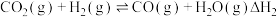
回答下列问题:
(1)反应Ⅰ、Ⅱ的
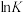 (
( 代表化学平衡常数)随
代表化学平衡常数)随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。

 的化学平衡常数
的化学平衡常数(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________(填字母)。
A.增大 的浓度,反应Ⅰ的平衡向正反应方向移动 的浓度,反应Ⅰ的平衡向正反应方向移动 |
| B.降低温度,反应Ⅰ和Ⅱ的正、逆反应速率都减小 |
| C.恒温恒容下充入氦气,反应Ⅰ的平衡向正反应方向移动 |
| D.增大压强,反应I和Ⅱ重新达到平衡的时间不同 |
(3)恒压下将
 和
和 按体积比
按体积比 混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内
混合,在不同催化剂作用下发生反应Ⅰ和反应Ⅱ,在相同的时间段内 的选择性和产率随温度的变化如图。
的选择性和产率随温度的变化如图。
其中:
 的选择性
的选择性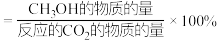
①在上述条件下合成甲醇的工业条件是
A.
 B.
B. C.催化CZT D.催化剂
C.催化CZT D.催化剂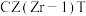
②在
 以上,升高温度
以上,升高温度 的转化率增大,但甲醇的产率降低,原因是
的转化率增大,但甲醇的产率降低,原因是(4)恒温恒压密闭容器中,加入
 和
和 ,只发生反应I和反应Ⅱ,初始压强为
,只发生反应I和反应Ⅱ,初始压强为 ,在
,在 发生反应,反应达平衡时,
发生反应,反应达平衡时, 的转化率为
的转化率为 ,容器体积减小
,容器体积减小 。则反应Ⅱ的平衡常数
。则反应Ⅱ的平衡常数
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某学习小组探究金属与不同酸反应的差异,以及影响反应速率的因素。
实验药品:1.0moL/L盐酸、2.0mol/L盐酸、1.0mol/L硫酸、2.0mol/L硫酸,相同大小的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为25.0mL,金属用量均为6.0g。
(1)帮助该组同学完成以上实验设计表。
(2)该小组同学在对比①和⑤实验时发现①的反应速率明显比⑤快,你能对问题原因作出哪些假设或猜想(列出一种即可)?________________________________________________________________ 。
实验药品:1.0moL/L盐酸、2.0mol/L盐酸、1.0mol/L硫酸、2.0mol/L硫酸,相同大小的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为25.0mL,金属用量均为6.0g。
(1)帮助该组同学完成以上实验设计表。
| 实验目的 | 实验编号 | 温度 | 金属铝形态 | 酸及浓度 |
| 1.实验①和②探究盐酸浓度对该反应速率的影响; 2.实验②和③探究 3.实验②和④探究金属规格(铝片,铝粉)对该反应速率的影响; 4.①和⑤实验探究铝与稀盐酸和稀硫酸反应的差异 | ① | 铝片 | ||
② | 30˚C | 铝片 | 1.0mol/L盐酸 | |
③ | 40˚C | 铝片 | 1.0mol/L盐酸 | |
④ | | 铝粉 | | |
⑤ | 30˚C | 铝片 | 1.0mol/L硫酸 |
您最近一年使用:0次



