科学家发现某些生物酶体系可以促进H+和e-的转移(如a、b和c),能将海洋中的NO 转化为N2进入大气层,反应过程如图所示。下列说法错误的是
转化为N2进入大气层,反应过程如图所示。下列说法错误的是

 转化为N2进入大气层,反应过程如图所示。下列说法错误的是
转化为N2进入大气层,反应过程如图所示。下列说法错误的是
A.过程I→Ⅲ的总反应为NO +NH +NH =N2↑+2H2O =N2↑+2H2O |
| B.a、b两过程转移的电子数之和等于c过程转移的电子数 |
C.过程I中反应可表示为NO +e-+H2O +e-+H2O NO+2OH- NO+2OH- |
| D.适当增加H+浓度,可以增大过程Ⅱ的反应速率 |
更新时间:2023-01-12 17:37:49
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】某同学在实验室中用KMnO4代替MnO2制备Cl2,反应原理为2KMnO4+16HCl(浓)== 2KCl+2MnCl2+5Cl2↑+8H2O。下列叙述不正确 的是
| A.氧化剂为KMnO4,其中Cl元素被还原 |
| B.若有0.8molH2O生成,则反应中有NA个电子转移 |
| C.浓HCl在反应中起酸性和还原性的作用 |
| D.氧化剂与还原剂的物质的量之比为1:5 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】在反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中( )
| A.氧化产物与还原产物的物质的量之比为2∶5 | B.被氧化的HCl占参加反应HCl总分子数的5/8 |
| C.KMnO4只有一部分发生还原反应 | D.氧化剂与还原剂的物质的量之比为5∶1 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】高铁酸钾 (K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。湿法制备的主要反应方程为:2Fe(OH)3+3ClO-+4OH-=2FeO42- +3Cl-+5H2O,干法制备的主要反应方程为:2FeSO4 +6Na2O2 = 2Na2FeO4 +2Na2O +2Na2SO4 +O2↑ 下列有关说法不正确的是
| A.低温下,高铁酸钾的溶解度比高铁酸钠更小 |
| B.湿法制备中每生成1mol Na2FeO4 转移3mol电子 |
| C.干法制备中还原剂与氧化剂的物质的量之比为1:3 |
| D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】下列实验方案设计中,能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 证明Fe2+具有还原性 | 向较浓的FeCl2溶液中滴入少量酸性KMnO4溶液,观察到KMnO4溶液紫色褪去 |
| B | 探究浓度对化学反应速率的影响 | 用两支试管各取5mL0.2mol/L的H2C2O4(草酸)溶液,分别加入2mL0.1mol/L和0.2mol/L的KMnO4溶液,记录溶液褪色所需的时间 |
| C | 证明蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,冷却后向其中加入足量稀NaOH溶液,再加入新制的银氨溶液,并水浴加热,产生了银镜 |
| D | 酸性:H2SO3>H2CO3 | 常温下,分别将SO2和CO2通入水中制备饱和溶液,再用pH计测定pH |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
【推荐2】下列实验操作、现象、解释或结论都正确的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 用两支试管各取5mL0.1mol/L的KMnO4溶液,分别加入2mL0.1mol/L和0.2mol/L的H2C2O4(草酸)溶液,记录溶液褪色所需的时间 | 后者褪色更快 | 浓度越大,化学反应速率越快 |
| B | 加热NaI固体和浓磷酸的混合物 | 有气体产生 | 生成了HI气体 |
| C | 向苯酚浊液中滴加饱和Na2CO3溶液 | 浊液变澄清 | 酸性:苯酚>碳酸 |
| D | 分别在20℃、30℃下,取0.1mol·L-1KI溶液,向其中先加入0.1mol·L-1的硫酸,再加入淀粉溶液,发生反应4H++O2+4I-=2I2+2H2O | 30℃下,溶液更快出现蓝色 | 温度越高,化学反应速率越快 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐3】向绝热恒容密闭容器中通入SO2和NO2,在一定条件下发生反应SO2(g)+NO2(g)  SO3(g)+NO(g),正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
SO3(g)+NO(g),正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
②SO2浓度:a点小于c点
③反应物的总能量高于生成物的总能量
④Δt1=Δt2,ab段NO2的消耗量小于bc段NO2的消耗量
⑤混合物颜色不再变化,说明反应达到平衡
⑥体系压强不再变化,说明反应达到平衡
⑦逆反应速率图象在此时间段内和上图趋势相同
⑧达到平衡后,改变容器体积增大压强,逆反应速率可能先增大后减小
 SO3(g)+NO(g),正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
SO3(g)+NO(g),正反应速率随时间变化的示意图如下图,下列结论中正确的个数为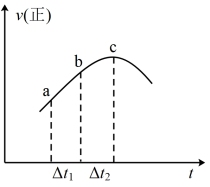
②SO2浓度:a点小于c点
③反应物的总能量高于生成物的总能量
④Δt1=Δt2,ab段NO2的消耗量小于bc段NO2的消耗量
⑤混合物颜色不再变化,说明反应达到平衡
⑥体系压强不再变化,说明反应达到平衡
⑦逆反应速率图象在此时间段内和上图趋势相同
⑧达到平衡后,改变容器体积增大压强,逆反应速率可能先增大后减小
| A.4个 | B.5个 | C.6个 | D.7个 |
您最近一年使用:0次



