Ⅰ.已知:工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用下进行的,反应器中发生了下列反应:
①
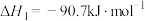
②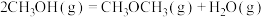
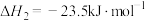
③
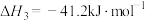
(1)反应器中的总反应可表示为 ,计算该反应的
,计算该反应的
_______ 。
Ⅱ. 催化加氢既可以合成乙烯,也可以实现碳中和,其反应为
催化加氢既可以合成乙烯,也可以实现碳中和,其反应为
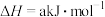 。起始时按
。起始时按 的投料比将
的投料比将 和
和 充入10L恒容密闭容器中,不同温度下平衡时
充入10L恒容密闭容器中,不同温度下平衡时 和
和 的物质的量如图所示:
的物质的量如图所示:

(2)①下列说法正确的是_______ (填序号)。
A.393K时,向恒容密闭容器中充入 ,压强增大,平衡正向移动
,压强增大,平衡正向移动
B.使用催化剂,可降低反应活化能,加快反应速率
C.测得容器内混合气体密度不随时间改变时,说明反应已达平衡
D.其他条件不变时,缩小容器体积,则 增大,
增大, 减小
减小
②393K下, 的平衡转化率为
的平衡转化率为_______ (保留三位有效数字)。
③393K下,该反应达到平衡后,再向容器中按 投入
投入 和
和 ,则重新达到平衡时
,则重新达到平衡时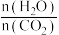 将
将_______ (填“变大”“不变”或“变小”)。
(3)用惰性电极电解酸性的 水溶液可得到乙烯,其原理如图所示:
水溶液可得到乙烯,其原理如图所示:
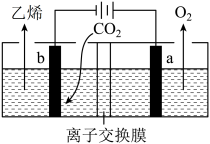
①a为_______ (填“正极”“负极”“阳极”或“阴极”)。
②b电极上的电极反应式为_______ 。
①

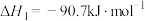
②
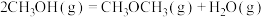
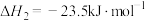
③

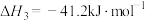
(1)反应器中的总反应可表示为
 ,计算该反应的
,计算该反应的
Ⅱ.
 催化加氢既可以合成乙烯,也可以实现碳中和,其反应为
催化加氢既可以合成乙烯,也可以实现碳中和,其反应为
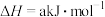 。起始时按
。起始时按 的投料比将
的投料比将 和
和 充入10L恒容密闭容器中,不同温度下平衡时
充入10L恒容密闭容器中,不同温度下平衡时 和
和 的物质的量如图所示:
的物质的量如图所示:
(2)①下列说法正确的是
A.393K时,向恒容密闭容器中充入
 ,压强增大,平衡正向移动
,压强增大,平衡正向移动B.使用催化剂,可降低反应活化能,加快反应速率
C.测得容器内混合气体密度不随时间改变时,说明反应已达平衡
D.其他条件不变时,缩小容器体积,则
 增大,
增大, 减小
减小②393K下,
 的平衡转化率为
的平衡转化率为③393K下,该反应达到平衡后,再向容器中按
 投入
投入 和
和 ,则重新达到平衡时
,则重新达到平衡时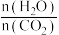 将
将(3)用惰性电极电解酸性的
 水溶液可得到乙烯,其原理如图所示:
水溶液可得到乙烯,其原理如图所示:
①a为
②b电极上的电极反应式为
更新时间:2023-01-14 22:07:17
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)①反应N2(g)+3H2(g) 2NH3(g)的化学平衡常数表达式为
2NH3(g)的化学平衡常数表达式为_____ 。
②实验室检验氨气的方法是____ 。
(2)在一定条件下氨的平衡含量如表。
①该反应为_____ (填“吸热”或“放热”)反应。
②哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是____ 。
(3)实验室研究是工业生产的基石。如图中的实验数据是在其它条件不变时,不同温度(200℃、400℃、600℃)、压强下,平衡混合物中NH3的物质的量分数的变化情况。
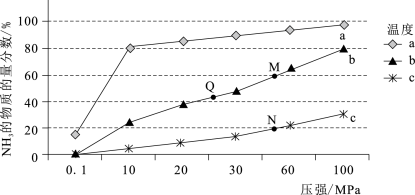
①曲线a对应的温度是____ 。
②M、N、Q点平衡常数K的大小关系是____ 。
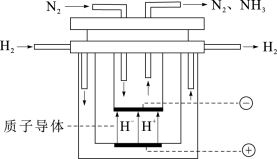
(4)尽管哈伯的合成氨法被评为“20世纪科学领域中最辉煌的成就”之一,但仍存在耗能高、产率低等问题。因此,科学家在持续探索,寻求合成氨的新路径。如图为电解法合成氨的原理示意图,阴极的电极反应式为____ 。
(5)NH3转化为NO是工业制取硝酸的重要一步,已知:100kPa、298K时:
4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H=-1268kJ·mol-1
2N2(g)+6H2O(g) △H=-1268kJ·mol-1
2NO(g) N2(g)+O2(g) △H=-180.5kJ·mol-1
N2(g)+O2(g) △H=-180.5kJ·mol-1
请写出NH3转化为NO的热化学方程式____ 。
(1)①反应N2(g)+3H2(g)
 2NH3(g)的化学平衡常数表达式为
2NH3(g)的化学平衡常数表达式为②实验室检验氨气的方法是
(2)在一定条件下氨的平衡含量如表。
| 温度/℃ | 压强/MPa | 氨的平衡含量 |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
②哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是
(3)实验室研究是工业生产的基石。如图中的实验数据是在其它条件不变时,不同温度(200℃、400℃、600℃)、压强下,平衡混合物中NH3的物质的量分数的变化情况。

①曲线a对应的温度是
②M、N、Q点平衡常数K的大小关系是
(4)尽管哈伯的合成氨法被评为“20世纪科学领域中最辉煌的成就”之一,但仍存在耗能高、产率低等问题。因此,科学家在持续探索,寻求合成氨的新路径。如图为电解法合成氨的原理示意图,阴极的电极反应式为

(5)NH3转化为NO是工业制取硝酸的重要一步,已知:100kPa、298K时:
4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H=-1268kJ·mol-1
2N2(g)+6H2O(g) △H=-1268kJ·mol-12NO(g)
 N2(g)+O2(g) △H=-180.5kJ·mol-1
N2(g)+O2(g) △H=-180.5kJ·mol-1请写出NH3转化为NO的热化学方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氨在国民经济中占有重要的地位,十九世纪初人们就开始致力于研究工业合成氨。合成氨生产包括造气、净化、合成三个步骤。
(1)已知:①CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1=+247.4kJ/mol
2CO(g)+2H2(g) △H1=+247.4kJ/mol
②CH4(g)+2H2O(g) CO2(g)+4H2(g) △H2=+165kJ/mol
CO2(g)+4H2(g) △H2=+165kJ/mol
则CH4和水蒸气在高温下反应生成CO和氢气的热化学反应方程式为___________ 。
(2)某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2L的恒容密闭容器中测得如表所示数据。请回答下列问题:
①分析表中数据,判断5min时反应是否处于平衡状态___________ (填“是”或“否”);前5min反应的平均反应速率v(CH4)=___________ 。
②反应在7~10min内,CO的物质的量减少的原因可能是___________ (填字母)。
A.减小压强 B.降低温度 C.升高温度 D.充入H2
(3)在密闭反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,当反应N2(g)+3H2(g) 2NH3(g) △H=﹣92.4kJ/mol达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图所示。
2NH3(g) △H=﹣92.4kJ/mol达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图所示。
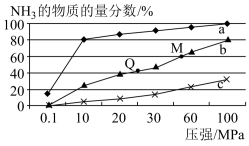
①曲线a对应的温度是___________ 。
②M点对应的H2的转化率是___________ 。
(1)已知:①CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H1=+247.4kJ/mol
2CO(g)+2H2(g) △H1=+247.4kJ/mol②CH4(g)+2H2O(g)
 CO2(g)+4H2(g) △H2=+165kJ/mol
CO2(g)+4H2(g) △H2=+165kJ/mol则CH4和水蒸气在高温下反应生成CO和氢气的热化学反应方程式为
(2)某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2L的恒容密闭容器中测得如表所示数据。请回答下列问题:
| 时间/min | CH4/mol | H2O/mol | CO/mol | H2/mol |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | a | 0.80 | c | 0.60 |
| 7 | 0.20 | b | 0.20 | d |
| 10 | 0.21 | 0.81 | 0.19 | 0.62 |
①分析表中数据,判断5min时反应是否处于平衡状态
②反应在7~10min内,CO的物质的量减少的原因可能是
A.减小压强 B.降低温度 C.升高温度 D.充入H2
(3)在密闭反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,当反应N2(g)+3H2(g)
 2NH3(g) △H=﹣92.4kJ/mol达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图所示。
2NH3(g) △H=﹣92.4kJ/mol达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图所示。
①曲线a对应的温度是
②M点对应的H2的转化率是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】氨是基本有机化学工业及氮肥生产的主要原料。回答以下问题:
(1)哈伯法合成氨是目前主流方法。
①该方法存在不少缺点,例如转化率低(10%~15%)、___________ (写一条);
②哈伯法使用的氢源含有H2S气体,可以采用ZnO吸收法实现脱硫目的。已知:
 ;
;
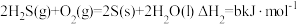 ;
;
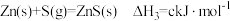 。
。
脱硫反应的热化学方程式为___________ 。
(2)电化学合成氨有望解决哈伯法的不足,以NO为氮源通过电解法制取氨气成为研究热点之一、已知酸性溶液中反应时,该过程存在(a)、(b)两种反应历程且均通过五步完成,示意如下:
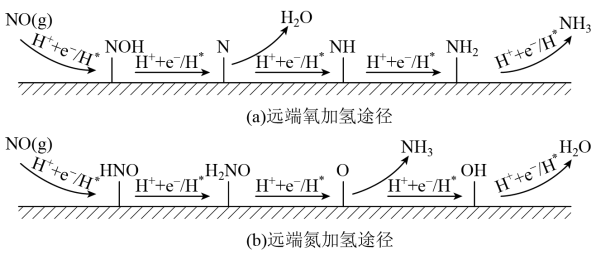
①两种途径最终ΔH(a)=ΔH(b),理由是___________ 。
②已知部分键能数据如表:
相同条件下,(a)、(b)途径中第一步反应的产物能量相对大小为:E(a)___________ E(b)(填“>”“<”或“=”)。
③该电化学合成氨的阴极反应式为___________ 。
(3)我省专家对“氨-氢”燃料电池研究已经取得突破,工作原理如图所示。

①负极电极反应式为___________ 。
②电极电势较高的区域为___________ (填“A”或“B”)。
③当外电路通过1mol电子时,消耗标况下氧气的体积为___________ L。
(1)哈伯法合成氨是目前主流方法。
①该方法存在不少缺点,例如转化率低(10%~15%)、
②哈伯法使用的氢源含有H2S气体,可以采用ZnO吸收法实现脱硫目的。已知:
 ;
;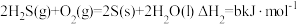 ;
;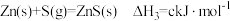 。
。脱硫反应的热化学方程式为
(2)电化学合成氨有望解决哈伯法的不足,以NO为氮源通过电解法制取氨气成为研究热点之一、已知酸性溶液中反应时,该过程存在(a)、(b)两种反应历程且均通过五步完成,示意如下:

①两种途径最终ΔH(a)=ΔH(b),理由是
②已知部分键能数据如表:
| 化学键 | N-H | O-H | N-O |
| 键能/kJ·mol-1 | 389 | 464 | 230 |
③该电化学合成氨的阴极反应式为
(3)我省专家对“氨-氢”燃料电池研究已经取得突破,工作原理如图所示。

①负极电极反应式为
②电极电势较高的区域为
③当外电路通过1mol电子时,消耗标况下氧气的体积为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】碳、硫、氮及其化合物在工农业、国防等领域占有重要地位。
(1)已知:
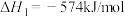


若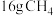 和
和 充分反应,生成
充分反应,生成 、
、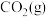 和
和 ,共放出热量867kJ,则
,共放出热量867kJ,则
_____ 。
(2) 与
与 之间存在反应
之间存在反应 。在一定条件下,该反应
。在一定条件下,该反应 、
、 的消耗速率与自身压强间存在关系
的消耗速率与自身压强间存在关系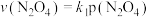 ,
,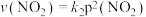 ,其中
,其中 、
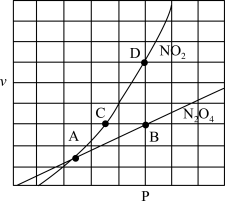
、 是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,
是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是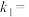
_____ ,在下图上标出的点中,能表示反应达到平衡状态的点为_____ (填字母代号)。
(3)在有氧条件下,新型催化剂M能催化 与
与 反应生成
反应生成 。
。
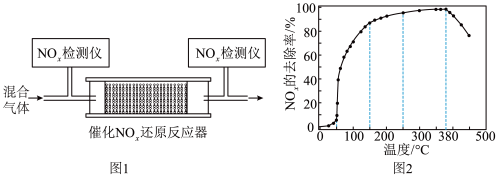
① 与
与 生成
生成 的反应中,当生成
的反应中,当生成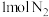 时,转移的电子为
时,转移的电子为_____  。
。
②将一定比例的 、
、 和
和 的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图1)。反应相同时间
的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图1)。反应相同时间 的去除率随反应温度的变化曲线(如图2)所示,在
的去除率随反应温度的变化曲线(如图2)所示,在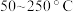 范围内随着温度的升高,
范围内随着温度的升高, 的去除率先迅速上升后上升缓慢的主要原因是
的去除率先迅速上升后上升缓慢的主要原因是_____ ;当反应温度高于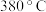 时,
时, 的去除率迅速下降的原因可能是
的去除率迅速下降的原因可能是_____ 。
(1)已知:

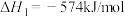


若
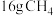 和
和 充分反应,生成
充分反应,生成 、
、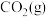 和
和 ,共放出热量867kJ,则
,共放出热量867kJ,则
(2)
 与
与 之间存在反应
之间存在反应 。在一定条件下,该反应
。在一定条件下,该反应 、
、 的消耗速率与自身压强间存在关系
的消耗速率与自身压强间存在关系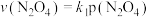 ,
,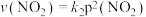 ,其中
,其中 、
、 是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,
是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是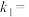

(3)在有氧条件下,新型催化剂M能催化
 与
与 反应生成
反应生成 。
。
①
 与
与 生成
生成 的反应中,当生成
的反应中,当生成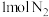 时,转移的电子为
时,转移的电子为 。
。②将一定比例的
 、
、 和
和 的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图1)。反应相同时间
的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图1)。反应相同时间 的去除率随反应温度的变化曲线(如图2)所示,在
的去除率随反应温度的变化曲线(如图2)所示,在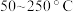 范围内随着温度的升高,
范围内随着温度的升高, 的去除率先迅速上升后上升缓慢的主要原因是
的去除率先迅速上升后上升缓慢的主要原因是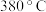 时,
时, 的去除率迅速下降的原因可能是
的去除率迅速下降的原因可能是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】合成气(主要成分为CO、 及少量CO、
及少量CO、 )在工业上有广泛用途。
)在工业上有广泛用途。
(1)
 也称为水煤气变换反应(简称WGS),主要应用在制氢工业和合成氨工业。在金属催化剂Au(Ⅲ)表面上发生的所有基元反应步骤的活化能数值(单位:kJ/mol)如右表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。其他条件一定时,决定WGS反应速率的基元反应为
也称为水煤气变换反应(简称WGS),主要应用在制氢工业和合成氨工业。在金属催化剂Au(Ⅲ)表面上发生的所有基元反应步骤的活化能数值(单位:kJ/mol)如右表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。其他条件一定时,决定WGS反应速率的基元反应为_____ (填编号),基元反应 的焓变
的焓变
_____ kJ/mol。
由表中数据计算WGS反应的焓变
_____ kJ/mol。
(2)合成甲醇的主要反应为:
 。将CO与
。将CO与 混合气体充入密闭容器中,投料比
混合气体充入密闭容器中,投料比 ,测得平衡时混合气体中
,测得平衡时混合气体中 的物质的量分数
的物质的量分数 与温度(T)、压强(p)之间的关系如图所示。
与温度(T)、压强(p)之间的关系如图所示。
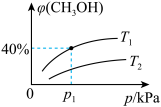
①图像中
_____  (填“>”、“<”或“=”,下同)。温度为
(填“>”、“<”或“=”,下同)。温度为 和
和 时对应的平衡常数分别为
时对应的平衡常数分别为 、
、 ,则
,则
_____  。
。
② 、
、 时,CO的转化率为
时,CO的转化率为_____ (保留3位有效数字)﹔压强平衡常数
_____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用含 的代数式表示)。
的代数式表示)。
③恒温恒容条件下,下列叙述不能说明反应达到化学平衡状态的是_____ 。
A.CO、 的物质的量浓度不再随时间的变化而变化
的物质的量浓度不再随时间的变化而变化
B.混合气体的平均摩尔质量不再随时间的变化而变化
C.混合气体的密度不再随时间的变化而变化
D.若将容器改为绝热恒容容器时,平衡常数K不随时间变化而变化
 及少量CO、
及少量CO、 )在工业上有广泛用途。
)在工业上有广泛用途。(1)

 也称为水煤气变换反应(简称WGS),主要应用在制氢工业和合成氨工业。在金属催化剂Au(Ⅲ)表面上发生的所有基元反应步骤的活化能数值(单位:kJ/mol)如右表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。其他条件一定时,决定WGS反应速率的基元反应为
也称为水煤气变换反应(简称WGS),主要应用在制氢工业和合成氨工业。在金属催化剂Au(Ⅲ)表面上发生的所有基元反应步骤的活化能数值(单位:kJ/mol)如右表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。其他条件一定时,决定WGS反应速率的基元反应为 的焓变
的焓变
由表中数据计算WGS反应的焓变

| 基元反应 | 正逆反应活化能 | ||
 |  | ||
| ① |  | 0 | 67 |
| ② | 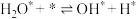 | 150 | 0 |
| ③ |  | 71 | 67 |
| ④ |  | 74 | 25 |
| ⑤ |  | 0 | 42 |
| ⑥ |  | 37 | 203 |
| ⑦ |  | 17 | 0 |
(2)合成甲醇的主要反应为:

 。将CO与
。将CO与 混合气体充入密闭容器中,投料比
混合气体充入密闭容器中,投料比 ,测得平衡时混合气体中
,测得平衡时混合气体中 的物质的量分数
的物质的量分数 与温度(T)、压强(p)之间的关系如图所示。
与温度(T)、压强(p)之间的关系如图所示。
①图像中

 (填“>”、“<”或“=”,下同)。温度为
(填“>”、“<”或“=”,下同)。温度为 和
和 时对应的平衡常数分别为
时对应的平衡常数分别为 、
、 ,则
,则
 。
。②
 、
、 时,CO的转化率为
时,CO的转化率为
 的代数式表示)。
的代数式表示)。③恒温恒容条件下,下列叙述不能说明反应达到化学平衡状态的是
A.CO、
 的物质的量浓度不再随时间的变化而变化
的物质的量浓度不再随时间的变化而变化B.混合气体的平均摩尔质量不再随时间的变化而变化
C.混合气体的密度不再随时间的变化而变化
D.若将容器改为绝热恒容容器时,平衡常数K不随时间变化而变化
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
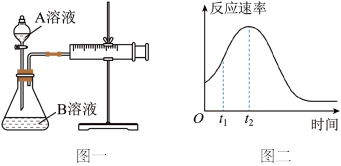
【推荐3】Ⅰ.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
(1)该实验探究的是___ (因素)对化学反应速率的影响。如图一,相同时间内针筒中所得的CO2体积大小关系是___ (填实验序号)。
(2)若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min末,c(MnO )=
)=___ mol·L-1(假设混合液体积为50mL)。
(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定___ 来比较化学反应速率。
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂②___ 。
Ⅱ.一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行反应:N2(g)+3H2(g) 2NH3(g)ΔH=-QkJ·mol-1。
2NH3(g)ΔH=-QkJ·mol-1。
(1)下列有关描述正确的有___ 。
A.当容器内的压强不变时,该反应已达平衡
B.当反应达平衡时,向容器中充入1molHe,反应速率会加快
C.若充入2molNH3(g),充分反应后吸热QkJ
D.常温常压,氨气和水700:1(体积比)溶解,原因之一是氨气和水分子之间可形成氢键
(2)若起始时向容器中充入10mol·L-1的N2和15mol·L-1的H2,10min时测得容器内NH3的浓度为1.5mol·L-1。10min内用N2表示的反应速率为___ ;此时H2的转化率为___ 。
 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):| 实验序号 | A溶液 | B溶液 |
| ① | 20mL0.1mol·L-1H2C2O4溶液 | 30mL0.1mol·L-1KMnO4溶液 |
| ② | 20mL0.2mol·L-1H2C2O4溶液 | 30mL0.1mol·L-1KMnO4溶液 |

(2)若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min末,c(MnO
 )=
)=(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂②
Ⅱ.一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行反应:N2(g)+3H2(g)
 2NH3(g)ΔH=-QkJ·mol-1。
2NH3(g)ΔH=-QkJ·mol-1。(1)下列有关描述正确的有
A.当容器内的压强不变时,该反应已达平衡
B.当反应达平衡时,向容器中充入1molHe,反应速率会加快
C.若充入2molNH3(g),充分反应后吸热QkJ
D.常温常压,氨气和水700:1(体积比)溶解,原因之一是氨气和水分子之间可形成氢键
(2)若起始时向容器中充入10mol·L-1的N2和15mol·L-1的H2,10min时测得容器内NH3的浓度为1.5mol·L-1。10min内用N2表示的反应速率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-离子(O2+4e-=2O2-)。
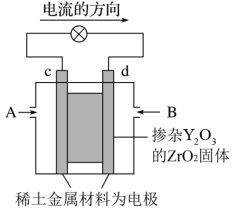
(1)c电极为___________ 极,d电极上的电极反应式为___________
(2)如图所示为用惰性电极电解100mL0.5mol·L-1CuSO4溶液,a电极上的电极反应式为_______ 若a电极产生56mL(标准状况)气体,则所得溶液的pH=________ (不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入______ (填序号)
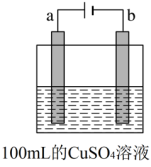
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
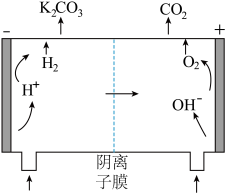
(3)用该电池电解KHCO3溶液可使K2CO3溶液再生,其原理如图所示。简述再生K2CO3的原理:_________ 。

(1)c电极为
(2)如图所示为用惰性电极电解100mL0.5mol·L-1CuSO4溶液,a电极上的电极反应式为

a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
(3)用该电池电解KHCO3溶液可使K2CO3溶液再生,其原理如图所示。简述再生K2CO3的原理:

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g)△H1
CH3OH(g)△H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g) CO(g)+H2O(g)△H3
CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
由此计算△H1=___ kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=___ kJ·mol-1。
(2)科学家提出制备“合成气反应历程分两步:
反应①:CH4(g)=C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)=2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:
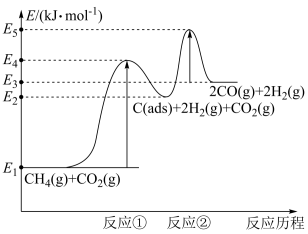
CH4与CO2制备合成气的热化学方程式为__ 。
(3)利用铜基配合物1,10—phenanthroline—Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段之,其装置原理如图所示。
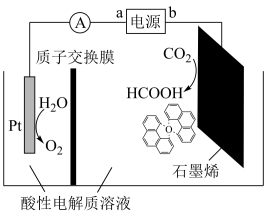
①电池工作过程中,图中Pt电极附近溶液的pH__ (填“变大”或“变小”),阴极的电极反应式为___ 。
②每转移2mol电子,阴极室溶液质量增加___ g。
(4)利用“Na—CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 2Na2CO3+C.放电时该电池“吸入CO2,其工作原理如图所示:
2Na2CO3+C.放电时该电池“吸入CO2,其工作原理如图所示:
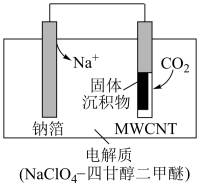
①放电时,正极的电极反应式为___ 。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mol电子时,两极的质量差为___ g。(假设放电前两电极质量相等)
①CO(g)+2H2(g)
 CH3OH(g)△H1
CH3OH(g)△H1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2③CO2(g)+H2(g)
 CO(g)+H2O(g)△H3
CO(g)+H2O(g)△H3回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)科学家提出制备“合成气反应历程分两步:
反应①:CH4(g)=C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)=2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:

CH4与CO2制备合成气的热化学方程式为
(3)利用铜基配合物1,10—phenanthroline—Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段之,其装置原理如图所示。

①电池工作过程中,图中Pt电极附近溶液的pH
②每转移2mol电子,阴极室溶液质量增加
(4)利用“Na—CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2
 2Na2CO3+C.放电时该电池“吸入CO2,其工作原理如图所示:
2Na2CO3+C.放电时该电池“吸入CO2,其工作原理如图所示:
①放电时,正极的电极反应式为
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mol电子时,两极的质量差为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】二氧化碳的捕集和资源化利用是缓解温室效应的重要战略方向。
(1)我国在二氧化碳催化加氢合成甲醇上取得了突破性进展,有关反应如下:
反应ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.6kJ·mol-1
反应ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H=+41kJ·mol-1
CO(g)+H2O(g) △H=+41kJ·mol-1
根据反应ⅰ和反应ⅱ,推出CO(g)和H2(g)合成甲醇的热化学方程式为_______ 。
(2)在催化剂M的作用下,CO2(g)+H2(g) CO(g)+H2O(g)的微观反应历程和相对能量(E)如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知:
CO(g)+H2O(g)的微观反应历程和相对能量(E)如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知: 表示C,
表示C, 表示O,
表示O, 表示H。
表示H。
历程Ⅰ: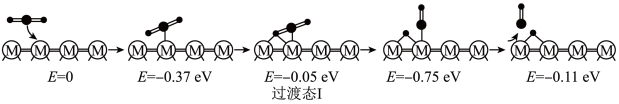
反应甲:CO2(g)=CO(g)+O*
历程Ⅱ: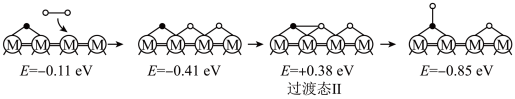
反应乙:H2(g)+O*=HO*+H*
历程Ⅲ: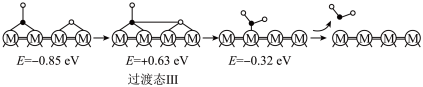
反应丙:_______
①历程Ⅲ中的反应丙可表示为_______ 。
②决定CO2(g)+H2(g) CO(g)+H2O(g)的总反应速率的是历程
CO(g)+H2O(g)的总反应速率的是历程_______ (填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
(3)将CO2和H2按物质的量之比1:3充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得CO2的平衡转化率随温度、压强变化的情况如图所示。
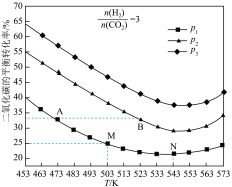
①压强p1、p2、p3 的大小关系为_______ 。
②A点、B点的化学反应速率大小:v(A)_______ v(B) (填“<”、“=”或“>”)。
③温度高于543K时,CO2的平衡转化率随温度的升高而增大的原因是_______ 。
④图中M点对应的温度下,已知CO的选择性(生成的CO与转化的CO2的百分比)为50%,该温度下反应ii的平衡常数为_______ (结果保留3位小数)。
如图是某科研团队设计的光电催化反应器,可由CO2制得异丙醇,其中A、B均是惰性电极。
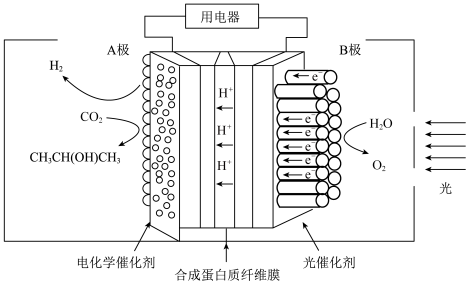
(4)B电极为该电化学装置的_______ 极。
(5)A极上CO2参与的电极反应式为_______ 。
(1)我国在二氧化碳催化加氢合成甲醇上取得了突破性进展,有关反应如下:
反应ⅰ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.6kJ·mol-1反应ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g) △H=+41kJ·mol-1
CO(g)+H2O(g) △H=+41kJ·mol-1根据反应ⅰ和反应ⅱ,推出CO(g)和H2(g)合成甲醇的热化学方程式为
(2)在催化剂M的作用下,CO2(g)+H2(g)
 CO(g)+H2O(g)的微观反应历程和相对能量(E)如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知:
CO(g)+H2O(g)的微观反应历程和相对能量(E)如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知: 表示C,
表示C, 表示O,
表示O, 表示H。
表示H。历程Ⅰ:

反应甲:CO2(g)=CO(g)+O*
历程Ⅱ:

反应乙:H2(g)+O*=HO*+H*
历程Ⅲ:

反应丙:_______
①历程Ⅲ中的反应丙可表示为
②决定CO2(g)+H2(g)
 CO(g)+H2O(g)的总反应速率的是历程
CO(g)+H2O(g)的总反应速率的是历程(3)将CO2和H2按物质的量之比1:3充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得CO2的平衡转化率随温度、压强变化的情况如图所示。

①压强p1、p2、p3 的大小关系为
②A点、B点的化学反应速率大小:v(A)
③温度高于543K时,CO2的平衡转化率随温度的升高而增大的原因是
④图中M点对应的温度下,已知CO的选择性(生成的CO与转化的CO2的百分比)为50%,该温度下反应ii的平衡常数为
如图是某科研团队设计的光电催化反应器,可由CO2制得异丙醇,其中A、B均是惰性电极。

(4)B电极为该电化学装置的
(5)A极上CO2参与的电极反应式为
您最近一年使用:0次
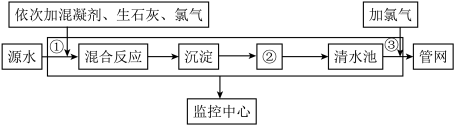
【推荐1】如图是目前我国城市饮用水的生产流程,生活饮用水水质的标准主要有:色度、浑浊度、pH、细菌总数、气味等。
(1)目前我国规定一、二类水质的饮用水中铝含量不得高于0.2mg/L。已知常温下Al(OH)3的Ksp=3.2×10-34,如果某城市的出厂饮用水的pH为6,则水中Al3+含量______ (填“符合”或“不符合”)标准。
(2)流程中②的分离方式相当于化学基本操作中的______ 操作,①、③中加氯气的作用是______ 。
(3)FeCl3具有净水作用,但腐蚀设备,而聚合硫酸铁[Fe(OH)SO4]n是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。
①FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示):______ 。
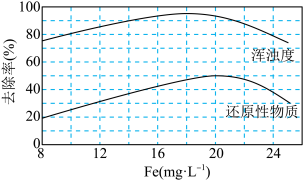
②某污水处理厂用聚合硫酸铁净化污水的结果如图所示。由图中数据得出每升污水中投放聚合硫酸铁[以Fe(mg•L-1)表示]的最佳范围为______ 。
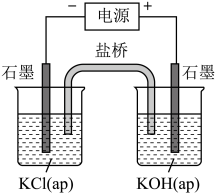
(4)高铁酸钾是一种氧化、吸附、絮凝、助凝、杀菌、除臭为一体的新型高效多功能绿色水处理剂,可通过“化学-电解法”探究其合成,原理如图所示。接通电源,调节电压,将一定量Cl2通入KOH溶液,然后滴入含Fe3+的溶液,控制温度,可制得K2FeO4。
①请写出“化学法”得到FeO 的离子方程式
的离子方程式______ 。
②请写出阳极的电极反应式(含FeO )
)______ 。

(1)目前我国规定一、二类水质的饮用水中铝含量不得高于0.2mg/L。已知常温下Al(OH)3的Ksp=3.2×10-34,如果某城市的出厂饮用水的pH为6,则水中Al3+含量
(2)流程中②的分离方式相当于化学基本操作中的
(3)FeCl3具有净水作用,但腐蚀设备,而聚合硫酸铁[Fe(OH)SO4]n是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。
①FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示):
②某污水处理厂用聚合硫酸铁净化污水的结果如图所示。由图中数据得出每升污水中投放聚合硫酸铁[以Fe(mg•L-1)表示]的最佳范围为

(4)高铁酸钾是一种氧化、吸附、絮凝、助凝、杀菌、除臭为一体的新型高效多功能绿色水处理剂,可通过“化学-电解法”探究其合成,原理如图所示。接通电源,调节电压,将一定量Cl2通入KOH溶液,然后滴入含Fe3+的溶液,控制温度,可制得K2FeO4。

①请写出“化学法”得到FeO
 的离子方程式
的离子方程式②请写出阳极的电极反应式(含FeO
 )
)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】页岩气中含有CH4、CO2、H2S等气体,是可供开采天然气资源。页岩气的有效利用需要处理其中所含的CO2和H2S。
Ⅰ.CO2的处理:
(1)CO2和CH4重整可制合成气(主要成分为CO、H2),已知下列热化学反应方程式:
①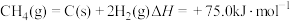
②
③
则反应 的
的
___________ 。
(2)Ni催化CO2加H2形成CH4,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中CH4的百分含量及CO2的转化率随温度的变化如图2所示。
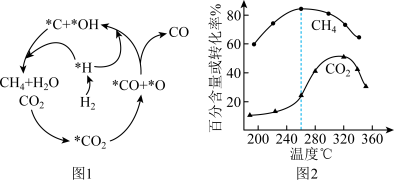
①260℃时生成主要产物所发生反应的化学方程式为___________ 。
②温度高于320℃,CO2的转化率下降的原因是___________ 。
Ⅱ.H2S的处理:
方法一:工业上常采用如图3电解装置电解: 和KHCO3混合溶液,电解一段时间后,通入H2S加以处理。利用生成的铁的化合物
和KHCO3混合溶液,电解一段时间后,通入H2S加以处理。利用生成的铁的化合物 将气态废弃物中的H2S转化为可利用的硫单质,自身转化为
将气态废弃物中的H2S转化为可利用的硫单质,自身转化为 。已知:水溶液中电离方程式:
。已知:水溶液中电离方程式:
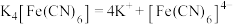
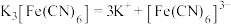
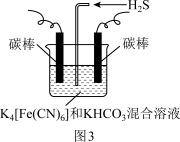
(3)电解时,阳极的电极反应式为___________ 。
方法二:表面喷淋水的活性炭可用于吸附氧化H2S,其原理可用如图4表示。

(4)其它条件不变时,水膜的酸碱性与厚度会影响H2S的去除率。适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是___________ 。
方法三:Fe2O3可用作脱除H2S气体的脱硫剂。Fe2O3脱硫和Fe2O3再生的可能反应机理如图5所示。
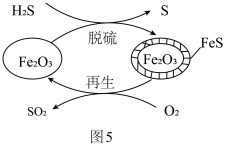
(5)Fe2O3脱硫剂的脱硫和再生过程可以描述为___________ 。
(6)再生时需控制通入O2的浓度和温度。400℃条件下,氧气浓度较大时,会出现脱硫剂再生时质量增大,且所得再生脱硫剂脱硫效果差,原因是___________ 。
Ⅰ.CO2的处理:
(1)CO2和CH4重整可制合成气(主要成分为CO、H2),已知下列热化学反应方程式:
①
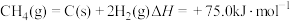
②

③

则反应
 的
的
(2)Ni催化CO2加H2形成CH4,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中CH4的百分含量及CO2的转化率随温度的变化如图2所示。

①260℃时生成主要产物所发生反应的化学方程式为
②温度高于320℃,CO2的转化率下降的原因是
Ⅱ.H2S的处理:
方法一:工业上常采用如图3电解装置电解:
 和KHCO3混合溶液,电解一段时间后,通入H2S加以处理。利用生成的铁的化合物
和KHCO3混合溶液,电解一段时间后,通入H2S加以处理。利用生成的铁的化合物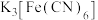 将气态废弃物中的H2S转化为可利用的硫单质,自身转化为
将气态废弃物中的H2S转化为可利用的硫单质,自身转化为 。已知:水溶液中电离方程式:
。已知:水溶液中电离方程式: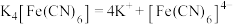
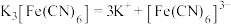

(3)电解时,阳极的电极反应式为
方法二:表面喷淋水的活性炭可用于吸附氧化H2S,其原理可用如图4表示。

(4)其它条件不变时,水膜的酸碱性与厚度会影响H2S的去除率。适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是
方法三:Fe2O3可用作脱除H2S气体的脱硫剂。Fe2O3脱硫和Fe2O3再生的可能反应机理如图5所示。

(5)Fe2O3脱硫剂的脱硫和再生过程可以描述为
(6)再生时需控制通入O2的浓度和温度。400℃条件下,氧气浓度较大时,会出现脱硫剂再生时质量增大,且所得再生脱硫剂脱硫效果差,原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】氮及其化合物在工业生产等领域中有着重要应用,同时氮的氧化物也是造成空气污染的主要成分之一,降低其排放可以改善空气质量。
(1)联氨(N2H4,又称肼)是一种良好的火箭推进剂。已知相关化学键的键能如表所示:
若使1molN2O4(g)完全分解成相应的原子时需要吸收的能量是xkJ,则2N2H4(g)+N2O4(g)⇌3N2(g)+4H2O(g)∆H=______ kJ·mol−1。
(2)NO和CO均为汽车尾气的成分,在催化转换器中二者可发生反应减少尾气污染。已知2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ∆H<0。向密闭容器中按n(NO):n(CO)=1:1通入气体,在不同温度下反应达到平衡时,NO的平衡转化率随压强变化曲线如图所示:
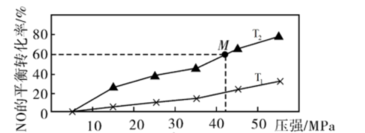
①T1______ T2(填“>”、“<”),理由是______ 。
②M点时混合气体的平均相对分子质量为______ (保留两位小数)。
③一定温度下,向恒容容器中通入等物质的量的NO和CO,测得容器中压强随时间的变化关系如表所示:
该反应条件下的平衡常数Kp=______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),该反应中的v正=k正·p2(NO)p2(CO),v逆=k逆·p(N2)p2(CO2),则该反应达到平衡时,k正______ k逆(填“>”、“<”或“=”)。
(3)电化学法也可合成氨。用低温固体质子导体作电解质,电解N2(g)、H2(g)合成氨气的原理如图所示:
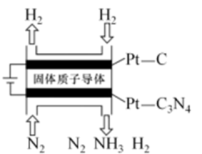
①阴极产生氨气的电极反应式为______ 。
②实验研究发现,当外加电压超过一定值以后,发现阴极产物中氨气所占体积分数随电压的增大而减小,其可能原因为______ 。
(1)联氨(N2H4,又称肼)是一种良好的火箭推进剂。已知相关化学键的键能如表所示:
| 化学键 | N-H | N-N | N≡N | O-H |
| 键能(kJ·mol-1) | a | b | c | d |
若使1molN2O4(g)完全分解成相应的原子时需要吸收的能量是xkJ,则2N2H4(g)+N2O4(g)⇌3N2(g)+4H2O(g)∆H=
(2)NO和CO均为汽车尾气的成分,在催化转换器中二者可发生反应减少尾气污染。已知2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ∆H<0。向密闭容器中按n(NO):n(CO)=1:1通入气体,在不同温度下反应达到平衡时,NO的平衡转化率随压强变化曲线如图所示:

①T1
②M点时混合气体的平均相对分子质量为
③一定温度下,向恒容容器中通入等物质的量的NO和CO,测得容器中压强随时间的变化关系如表所示:
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| p/kPa | 200 | 185 | 173 | 165 | 160 | 160 |
该反应条件下的平衡常数Kp=
(3)电化学法也可合成氨。用低温固体质子导体作电解质,电解N2(g)、H2(g)合成氨气的原理如图所示:

①阴极产生氨气的电极反应式为
②实验研究发现,当外加电压超过一定值以后,发现阴极产物中氨气所占体积分数随电压的增大而减小,其可能原因为
您最近一年使用:0次



