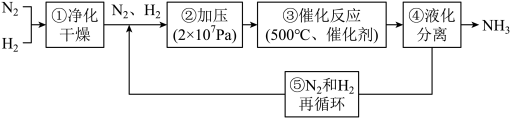
下列说法错误的是
| A.合成氨反应采取循环操作主要是为了提高化学反应速率 |
B.  、 、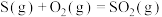  ,则 ,则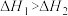 |
C.反应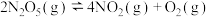  ,能自发进行的原因是 ,能自发进行的原因是 |
D.一定温度下,对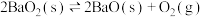 平衡体系缩小体积,再次达到平衡时 平衡体系缩小体积,再次达到平衡时 不变 不变 |
22-23高二上·河南·期末 查看更多[6]
安徽省明光市第二中学2023-2024学年高二上学期期中考试化学试卷 江西省部分学校2023-2024学年高二下学期开学考试化学试题陕西省榆林市府谷县府谷中学2023-2024学年高二下学期开学化学试题河北省沧州市2023-2024学年高二上学期12月月考化学试题(已下线)专题05 化学反应的方向 化学反应的调控 -【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)河南省商开大联考2022~2023学年高二上学期期末考试化学试题
更新时间:2023-02-21 22:50:49
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】一定温度下, 的氯化、溴化反应能量及一段时间后产物的选择性如图,下列叙述错误的是
的氯化、溴化反应能量及一段时间后产物的选择性如图,下列叙述错误的是
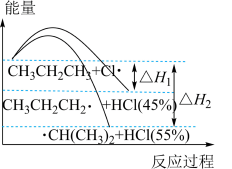
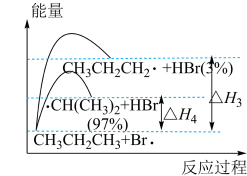
 的氯化、溴化反应能量及一段时间后产物的选择性如图,下列叙述错误的是
的氯化、溴化反应能量及一段时间后产物的选择性如图,下列叙述错误的是

A. |
B.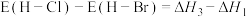 (E表示键能) (E表示键能) |
| C.丙烷中不同基团上碳氢键断裂吸收的能量不同 |
| D.以丙烷为原料合成丙醇时,“先氯代再水解”有利于提高2-丙醇的含量 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】通过反应I: 可将有机氯化工业的副产品
可将有机氯化工业的副产品 转化为
转化为 。在0.2
。在0.2 、反应物起始物质的量比
、反应物起始物质的量比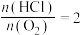 条件下,不同温度时
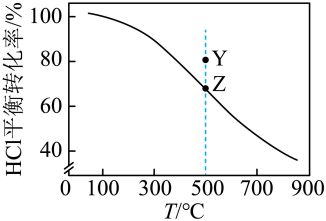
条件下,不同温度时 平衡转化率如图所示。向反应体系中加入
平衡转化率如图所示。向反应体系中加入 ,能增大反应速率。已知反应II:
,能增大反应速率。已知反应II: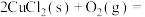
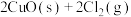
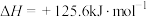 ;反应III:
;反应III:
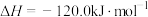 。下列说法正确的是
。下列说法正确的是
 可将有机氯化工业的副产品
可将有机氯化工业的副产品 转化为
转化为 。在0.2
。在0.2 、反应物起始物质的量比
、反应物起始物质的量比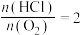 条件下,不同温度时
条件下,不同温度时 平衡转化率如图所示。向反应体系中加入
平衡转化率如图所示。向反应体系中加入 ,能增大反应速率。已知反应II:
,能增大反应速率。已知反应II: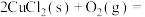
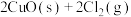
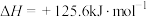 ;反应III:
;反应III:
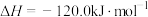 。下列说法正确的是
。下列说法正确的是
A.反应Ⅰ的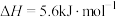 |
B.升高温度和增大压强均能提高反应Ⅰ中 的平衡转化率 的平衡转化率 |
C.保持其他条件不变,500℃时,使用 能使Z点移至Y点 能使Z点移至Y点 |
D.在0.2 ,500℃条件下,若起始 ,500℃条件下,若起始 ,可使Z点移动到Y点 ,可使Z点移动到Y点 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确 的是
①C(s)+H2O(g)=CO(g)+H2(g) ΔH1=akJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=bkJ·mol-1
③CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3=ckJ·mol-1
④2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4=dkJ·mol-1
①C(s)+H2O(g)=CO(g)+H2(g) ΔH1=akJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=bkJ·mol-1
③CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3=ckJ·mol-1
④2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4=dkJ·mol-1
| A.反应①、②为反应③提供原料气 |
| B.反应③也是CO2资源化利用的方法之一 |
| C.反应C(s)+2H2O(l)=CO2(g)+2H2(g)的ΔH=(a+b)kJ·mol-1 |
| D.反应2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)的ΔH=(2b+2c+d)kJ·mol-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列有关说法正确的是
| A.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 |
| B.对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
C.CH3COOH 溶液加水稀释后,溶液中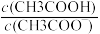 的值增大 的值增大 |
| D.Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解向左移动,溶液的pH 增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】已知苯酚( C6H5OH)与Fe3+反应生成[Fe(C6H5O)6]3- (紫色)。将1mL0.1mol/LKI溶液和6mL0.1mol/LFeCl3 溶液混合,发生反应:2Fe3+(aq) +2I-(aq)=2Fe2+(aq)+I2(aq),下列有关该反应的说法错误的是
| A.加入2mL四氯化碳,振荡,平衡向右移动 |
| B.经四氯化碳多次萃取,在分离后的水溶液中滴加苯酚溶液,若溶液呈紫色,说明该反应是可逆反应 |
| C.加入KCl固体,平衡不移动 |
D.该反应的平衡常数K= |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】下列坐标图均涉及平衡原理,其中相关表述正确的是


A.图①表示室温下,用0.1mol·L-1氨水吸收HCl气体时,溶液的粒子浓度随吸收HCl的变化,实线表示c(NH3·H2O),虚线表示c(NH ),处于M点时溶液呈中性 ),处于M点时溶液呈中性 |
B.图②表示2SO2(g)+O2(g) 2SO3(g) △H<0正逆反应的平衡常数K随温度的变化 2SO3(g) △H<0正逆反应的平衡常数K随温度的变化 |
C.图③表示反应2NH3(g) 3H2(g)+N2(g)在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系 3H2(g)+N2(g)在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系 |
D.图④表示AgCl(s) Ag+(aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处 Ag+(aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】哈伯工业合成氨的流程如图,为提高原料平衡转化率采取的措施是
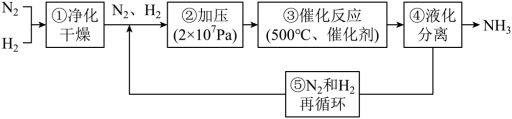

| A.①②③④⑤ | B.②③④⑤ | C.②④⑤ | D.②③④ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】化学的发展经历了悠久的历史,下列说法正确的是
| A.法拉第发现了苯的分子式C6H6,凯库勒提出了苯为单双键交替的环形结构 |
| B.哈伯确定了合成氨反应的温度、压强、催化剂,并实现了氨气的工业合成 |
| C.阿伏加德罗提出了分子学说,范德华最早研究了分子间作用力 |
| D.门捷列夫研究了元素周期律,并绘制出了第一张完整的元素周期表 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】哈伯法合成氨技术是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g)+3H2(g) 2NH3(g) △H<0,△S<0。下列有关工合成氨的说法正确的是
2NH3(g) △H<0,△S<0。下列有关工合成氨的说法正确的是
 2NH3(g) △H<0,△S<0。下列有关工合成氨的说法正确的是
2NH3(g) △H<0,△S<0。下列有关工合成氨的说法正确的是| A.因为△H<0,所以该反应一定能自发进行 |
| B.因为△S<0,所以该反应一定不能自发进行 |
| C.在高温下进行是为了提高反应物的转化率 |
| D.使用催化剂加快反应速率是因为催化剂降低了反应的活化能 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列说法正确的是( )
| A.所有自发进行的化学反应都是放热反应 |
B.反应2A(g)+B(g) 2C(g) ΔH<0在高温下能自发进行 2C(g) ΔH<0在高温下能自发进行 |
| C.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程 |
| D.同一物质的固、液、气三种状态的熵值相同 |
您最近一年使用:0次