前四周期元素A、B、C、D、E、F原子序数依次增大,其相关性质如表所示:
回答下列问题:
(1)E元素基态原子电子排布式为_______ 。
(2)F元素基态原子的价电子轨道排布式_______ 。高温条件下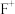 比
比 稳定的原因
稳定的原因_______ (涉及元素写元素符号)。
(3)A、B元素第一电离能由大到小的关系是_______ (用元素符号表示)。
(4)D元素简单阳离子净水原理为_______ (用离子方程式表示)。
(5)写出B、C组成的含有两种化学键的化合物的电子式:_______ 。
(6)C的最高价氧化物的水化物溶液中通入一定量 得溶液X,向X中逐滴加入盐酸,所加盐酸的体积与产生
得溶液X,向X中逐滴加入盐酸,所加盐酸的体积与产生 的体积(标准状况)关系如图所示。
的体积(标准状况)关系如图所示。
①溶液X中溶质的化学式为_______ 。
②当加入35 mL盐酸时、产生 的体积为
的体积为_______ mL(标准状况下)。
| A | 元素的气态氢化物极易溶于水。可用作制冷剂 |
| B | 没有最高正价、原子最外层与最内层电子数之和为8 |
| C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
| D | 与C同周期、其简单阳离子的某种盐常用作净水剂 |
| E | 前四周期元素中,E元素基态原子未成对电子数最多 |
| F | 基态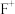 各能线电子全充满 各能线电子全充满 |
(1)E元素基态原子电子排布式为
(2)F元素基态原子的价电子轨道排布式
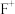 比
比 稳定的原因
稳定的原因(3)A、B元素第一电离能由大到小的关系是
(4)D元素简单阳离子净水原理为
(5)写出B、C组成的含有两种化学键的化合物的电子式:
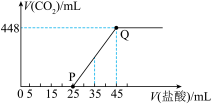
(6)C的最高价氧化物的水化物溶液中通入一定量
 得溶液X,向X中逐滴加入盐酸,所加盐酸的体积与产生
得溶液X,向X中逐滴加入盐酸,所加盐酸的体积与产生 的体积(标准状况)关系如图所示。
的体积(标准状况)关系如图所示。
①溶液X中溶质的化学式为
②当加入35 mL盐酸时、产生
 的体积为
的体积为
更新时间:2023-02-21 22:50:49
|
相似题推荐
【推荐1】黑色金属材料是工业上对铁、铬、锰的统称,Fe、Cr、Mn及其化合物在日常生活生产中的用途相当广泛。根据所学知识,回答下列问题:
(1)Fe2(SO4)3具有净水作用,Fe2(SO4)3净水的原理是______________________________ 。为节约成本,工业上用NaClO3氧化酸性FeSO4废液得到Fe2(SO4)3。若酸性FeSO4废液中c(Fe2+)=2.0 10-2 mol•L-1,c(Fe3+)=l.0×10-3 mol • L-1,c(SO
10-2 mol•L-1,c(Fe3+)=l.0×10-3 mol • L-1,c(SO )=2.65×10-2mol • L-1,则该溶液的pH约为
)=2.65×10-2mol • L-1,则该溶液的pH约为______________ 。
(2)向Fe2(SO4)3溶液中加入KOH溶液至过量,微热,再通入Cl2,可观察到溶液呈紫色(高铁酸钾:K2FeO4。写出此过程发生反应的离子方程式:______________ 。
(3)FeSO4可用于治疗缺铁性贫血症,为验证药品的还原性,某实验小组取少量药用FeSO4配制成溶液,并取2 mL FeSO4溶液于试管中,滴入几滴浓硝酸,振荡,试管中产生红棕 色气体,溶液变为深棕色。为探究溶液没有变为黄色的原因补充了如下实验:向FeSO4溶液和Fe2(SO4)3溶液中分别通入NO2,观察到FeSO4溶液变为深棕色,Fe2(SO4)3溶液无明显变化。
①“试管中产生红棕色气体,溶液变为深棕色”的原因是______________ 。
② 实验小组改进实验,观察到溶液变为黄色的实验操作是______________ 。
II.在K2Cr2O7溶液中存在下列平衡:
(4)下列有关K2Cr2O7溶液的说法正确的是 (填标号)。
III.MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。它在空气中加热易转化为不同价态锰的氧化物,其固体残留率( )随温度的变化如图所示
)随温度的变化如图所示
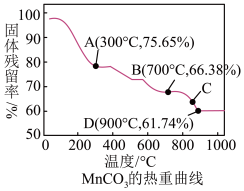
(5)300℃时,剩余固体中n(Mn): n(O)为______________ 。
(6)图中C点对应固体的成分为______________ (填化学式)。
(1)Fe2(SO4)3具有净水作用,Fe2(SO4)3净水的原理是
 10-2 mol•L-1,c(Fe3+)=l.0×10-3 mol • L-1,c(SO
10-2 mol•L-1,c(Fe3+)=l.0×10-3 mol • L-1,c(SO )=2.65×10-2mol • L-1,则该溶液的pH约为
)=2.65×10-2mol • L-1,则该溶液的pH约为(2)向Fe2(SO4)3溶液中加入KOH溶液至过量,微热,再通入Cl2,可观察到溶液呈紫色(高铁酸钾:K2FeO4。写出此过程发生反应的离子方程式:
(3)FeSO4可用于治疗缺铁性贫血症,为验证药品的还原性,某实验小组取少量药用FeSO4配制成溶液,并取2 mL FeSO4溶液于试管中,滴入几滴浓硝酸,振荡,试管中产生红棕 色气体,溶液变为深棕色。为探究溶液没有变为黄色的原因补充了如下实验:向FeSO4溶液和Fe2(SO4)3溶液中分别通入NO2,观察到FeSO4溶液变为深棕色,Fe2(SO4)3溶液无明显变化。
①“试管中产生红棕色气体,溶液变为深棕色”的原因是
② 实验小组改进实验,观察到溶液变为黄色的实验操作是
II.在K2Cr2O7溶液中存在下列平衡:

(4)下列有关K2Cr2O7溶液的说法正确的是 (填标号)。
| A.加入少量硫酸,溶液的橙色加深 |
| B.加入少量水稀释,溶液中离子总数增加 |
| C.加入少量NaOH溶液,平衡逆向移动 |
| D.加入少量K2Cr2O7固体,平衡正向移动,K2Cr2O7转化率变大 |
III.MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。它在空气中加热易转化为不同价态锰的氧化物,其固体残留率(
 )随温度的变化如图所示
)随温度的变化如图所示
(5)300℃时,剩余固体中n(Mn): n(O)为
(6)图中C点对应固体的成分为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】MnSO4·H2O在工业、农业等方面有广泛的应用。软锰矿-黄铁矿硫酸浸出法是工业上制取硫酸锰的一种方法。

(1)酸浸时主要反应为15MnO2+2FeS2+14H2SO4= 15MnSO4 + Fe2(SO4)3 +14H2O,反应中被氧化的元素是____ 。酸浸时,硫酸过量的目的是:①____ ;②____ 。
(2)加入CaCO3可以将滤液中的Fe3+转化为Fe(OH)3而除去,该反应的化学方程式为____ 。CaCO3用量过大,对MnSO4·H2O产量的影响是,____ (填“升高”“降低”或“无影响”)。
(3)硫酸锰在不同温度下结晶可分别得到MnSO4·7H2O、MnSO4·5H2O和MnSO4·H2O。硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如下图所示。从过滤Ⅱ所得的滤液中获得较高纯度MnSO4·H2O的操作是:控制温度在80 ℃~90 ℃之间蒸发结晶,____ ,使固体MnSO4·H2O与溶液分离,____ 、真空干燥。


(1)酸浸时主要反应为15MnO2+2FeS2+14H2SO4= 15MnSO4 + Fe2(SO4)3 +14H2O,反应中被氧化的元素是
(2)加入CaCO3可以将滤液中的Fe3+转化为Fe(OH)3而除去,该反应的化学方程式为
(3)硫酸锰在不同温度下结晶可分别得到MnSO4·7H2O、MnSO4·5H2O和MnSO4·H2O。硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如下图所示。从过滤Ⅱ所得的滤液中获得较高纯度MnSO4·H2O的操作是:控制温度在80 ℃~90 ℃之间蒸发结晶,

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】无水氧化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为___________ 。
(2)工业上用铝土矿(主要成分为 ,含有
,含有 、
、 等杂质)制取无水氯化铝的一种工艺流程示意如下:
等杂质)制取无水氯化铝的一种工艺流程示意如下:
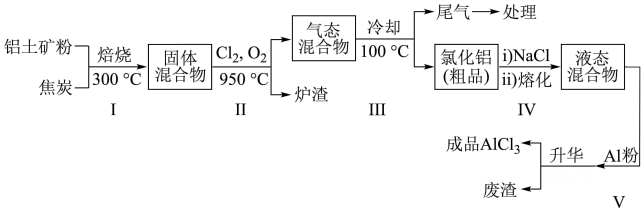
已知:
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是___________ (只要求写出一种)。
②步骤Ⅰ中,除了生成硅单质,还能生成___________ 单质。
③步骤Ⅲ经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为___________ 。
④结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是___________ 。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为
(2)工业上用铝土矿(主要成分为
 ,含有
,含有 、
、 等杂质)制取无水氯化铝的一种工艺流程示意如下:
等杂质)制取无水氯化铝的一种工艺流程示意如下:
已知:
| 物质 |  |  |  |  |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是
②步骤Ⅰ中,除了生成硅单质,还能生成
③步骤Ⅲ经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为
④结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐1】前四周期的A、B、C、D、E、F六种元素,原子序数依次增大。基态A原子核外电子的L层电子数是K层的2倍;B原子基态时的2p轨道上未成对的电子数最多;C元素为最活泼的非金属元素;D元素核外有3个电子层,最外层电子数是核外电子总数的 ;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。
(1)E元素在周期表中位置为_______ ,E3+价电子轨道表示式为_______ 。
(2)B、C、F三种元素电负性由大到小的顺序为_______ (用元素符号表示),第一电离能D_______ (填“>”、“<”或“=”)Al,其原因是_______ 。
(3)相同条件下,A、B的简单氢化物在水中溶解度较大的是_______ (填化学式),理由是_______ 。
(4)F元素可能的性质_______ (填标号)。
 ;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。(1)E元素在周期表中位置为
(2)B、C、F三种元素电负性由大到小的顺序为
(3)相同条件下,A、B的简单氢化物在水中溶解度较大的是
(4)F元素可能的性质
| A.其单质可作半导体材料 |
| B.存在-3、+3、+5等多种化合价 |
| C.最高价氧化物对应的水化物是强酸 |
| D.单质还原性弱于磷单质 |
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐2】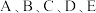 为原子序数依次增大的五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。
为原子序数依次增大的五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。
请回答下列问题:
(1) 元素的某种原子的中子数比质子数多1,则该原子符号为
元素的某种原子的中子数比质子数多1,则该原子符号为_____________ ; 元素的最简单氢化物的结构式为
元素的最简单氢化物的结构式为_____________________ 。
(2)化合物 仅含有
仅含有 两种元素且
两种元素且 的原子个数比为
的原子个数比为 ,则
,则 的电子式为
的电子式为_________________________ 。 与水反应的离子方程式为
与水反应的离子方程式为_________________________ ,每消耗 ,转移
,转移_____________  电子。
电子。
(3)化合物 仅含有
仅含有 两种元素,
两种元素, 与水反应的化学方程式为
与水反应的化学方程式为_____________________ 。
(4)用电子式表示化合物 的形成过程:
的形成过程:_________________________________________ 。
(5)非金属性:
_____________ C(填“ ”或“
”或“ ”),从原子结构角度简述其原因:
”),从原子结构角度简述其原因:_________ 。
 为原子序数依次增大的五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。
为原子序数依次增大的五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。
请回答下列问题:
(1)
 元素的某种原子的中子数比质子数多1,则该原子符号为
元素的某种原子的中子数比质子数多1,则该原子符号为 元素的最简单氢化物的结构式为
元素的最简单氢化物的结构式为(2)化合物
 仅含有
仅含有 两种元素且
两种元素且 的原子个数比为
的原子个数比为 ,则
,则 的电子式为
的电子式为 与水反应的离子方程式为
与水反应的离子方程式为 ,转移
,转移 电子。
电子。(3)化合物
 仅含有
仅含有 两种元素,
两种元素, 与水反应的化学方程式为
与水反应的化学方程式为(4)用电子式表示化合物
 的形成过程:
的形成过程:(5)非金属性:

 ”或“
”或“ ”),从原子结构角度简述其原因:
”),从原子结构角度简述其原因:
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐3】前20号主族元素A、B、、C、D、E、F的原子序数依次增大,它们的原子核最外层电子数之和为18,A的原子半径为自然界最小,B、F为同一主族,E为地壳中含量最多的金属元素,F原子最外层与最内曾电子数相等,C、D可以形成两种常见化合物。是回答以下问题:
(1)写出FC2的电子式____ ,FC2与A2D反应的化学方程式为___ 。
(2)AC、D三种元素形成的化合物C2A4D2中一定含有_____ 。(填“离子键”、“极性共价键”或“非极性共价键”)
(3)由D、E、F形成的简单离子的离子半径由大到小的顺序是______ 。(用元素离子符号表示)
(4)元素B的性质与元素E的性质很相似,写出下列反应的离子方程式:
单质B与氢氧化钠溶液反应:___ ;B的氧化物与氢氧化钠溶液反应:____ 。
(1)写出FC2的电子式
(2)AC、D三种元素形成的化合物C2A4D2中一定含有
(3)由D、E、F形成的简单离子的离子半径由大到小的顺序是
(4)元素B的性质与元素E的性质很相似,写出下列反应的离子方程式:
单质B与氢氧化钠溶液反应:
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】一种新型碳单晶一单层聚合C60。它是典型的半导体,预示其在光、电半导体器件中具有潜在应用。回答下列问题:
(1)基态碳原子的价电子轨道表示式为_______ 。
(2)下列有关单层聚合C60(准六方聚合C60的结构如图)的说法正确的是_______ (填字母)。
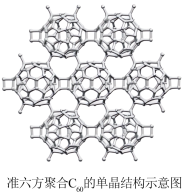
A.与金刚石、石墨烯互为同素异形体
B.与C60是同一种物质
C.所有的碳原子均为sp2杂化
D.它是一种共价化合物,不导电
E.它是由多个C60通过碳碳单键连接起来的
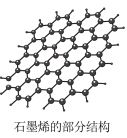
(3)石墨烯如图,分子中碳原子的杂化方式为_______ ,它具有很强的导电性,原因是_______ 。
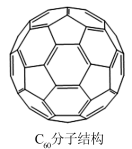
(4)C60的结构如图所示,它能与氯气反应形成C60Cl10分子,1molC60Cl10分子中含有碳碳双键的数目为_______ 。
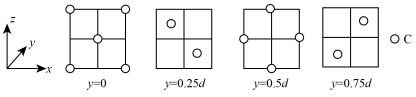
(5)金刚石晶胞的截面图如图所示(假设晶胞边长为dcm),原子1的分数坐标为_______ ,金刚石晶胞的密度为_______ (列出计算式,已知阿伏加德罗常数的值为NA)。
(1)基态碳原子的价电子轨道表示式为
(2)下列有关单层聚合C60(准六方聚合C60的结构如图)的说法正确的是

A.与金刚石、石墨烯互为同素异形体
B.与C60是同一种物质
C.所有的碳原子均为sp2杂化
D.它是一种共价化合物,不导电
E.它是由多个C60通过碳碳单键连接起来的
(3)石墨烯如图,分子中碳原子的杂化方式为

(4)C60的结构如图所示,它能与氯气反应形成C60Cl10分子,1molC60Cl10分子中含有碳碳双键的数目为

(5)金刚石晶胞的截面图如图所示(假设晶胞边长为dcm),原子1的分数坐标为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】FeSe、MgB2、Nb3Al等超导材料具有广泛应用前景。
(1)Fe2+基态价电子的轨道表示式(价电子排布图)__ ,Se、Mg、B三种元素的电负性大小顺序是__ 。
(2)蒸气状态下以二聚分子存在的A1Cl3的结构式是___ ,其中A1原子的杂化方式是___ ,分子中八个原子___ (选填“是”或“不是”)在同一平面上,该分子是____ (选填“极性“或“非极性“)分子。
(3)制备FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2过程中需将金属锂溶于液氨,从而制得具有很高反应活性的金属电子溶液,反应为:Li+(m+n)NH3—X+e-(NH3)n。
①X的化学式为____ ;
②NH3的价层电子对互斥模型是____ 。
(4)MgB2晶体结构中的B原子层具有类似石墨的层状结构,且被六方密排的Mg原子层隔开,B原子位于Mg原子组成的三棱柱的中心。已知:平面中Mg原子间的最近核间距为acm,平面间Mg原子间的最近核间距为bcm,阿伏加 德罗常数为NA。

①B原子层六元环中处于对位的B原子核间距为____ cm。
②MgB2晶体的密度是____ g·cm-3。
(1)Fe2+基态价电子的轨道表示式(价电子排布图)
(2)蒸气状态下以二聚分子存在的A1Cl3的结构式是
(3)制备FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2过程中需将金属锂溶于液氨,从而制得具有很高反应活性的金属电子溶液,反应为:Li+(m+n)NH3—X+e-(NH3)n。
①X的化学式为
②NH3的价层电子对互斥模型是
(4)MgB2晶体结构中的B原子层具有类似石墨的层状结构,且被六方密排的Mg原子层隔开,B原子位于Mg原子组成的三棱柱的中心。已知:平面中Mg原子间的最近核间距为acm,平面间Mg原子间的最近核间距为bcm,阿伏加 德罗常数为NA。

①B原子层六元环中处于对位的B原子核间距为
②MgB2晶体的密度是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】锌的配合物在工业中有着重要应用。回答下列问题:
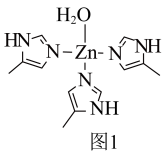
(1)一种锌的配合物M的结构如图1。___________ 区。M分子中元素电负性最大的原子处于基态时,其价电子排布图为___________ 。 构成。其晶体具有面心立方结构,晶胞由8个结构相似的组成单元(如图2)构成,其中虚线框内局部结构如图3。
构成。其晶体具有面心立方结构,晶胞由8个结构相似的组成单元(如图2)构成,其中虚线框内局部结构如图3。 中氧原子的轨道杂化方式为
中氧原子的轨道杂化方式为________ , 的配位数为
的配位数为_________ 。
②晶体内部空腔可吸附小分子,要增强晶体与 的吸附作用,可在对苯二甲酸根上引入
的吸附作用,可在对苯二甲酸根上引入________ (假设晶胞形状不变)。
A.—Cl B.—OH C. D.
D.
③已知该晶体密度为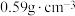 ,对苯二甲酸根与
,对苯二甲酸根与 的相对分子质量分别为
的相对分子质量分别为 和
和 ,
, 为阿伏加德罗常数的值,则该晶胞参数为
为阿伏加德罗常数的值,则该晶胞参数为___________ nm(用含 、
、 和
和 的式子表示)。
的式子表示)。
(1)一种锌的配合物M的结构如图1。
②已知配体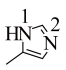 中的五元环为平面结构,则形成大
中的五元环为平面结构,则形成大 键时1号氮原子提供的电子数
键时1号氮原子提供的电子数 ”、“
”、“ ”或“
”或“ ”)2号氮原子提供的电子数;该分子具有碱性,原因是
”)2号氮原子提供的电子数;该分子具有碱性,原因是
 构成。其晶体具有面心立方结构,晶胞由8个结构相似的组成单元(如图2)构成,其中虚线框内局部结构如图3。
构成。其晶体具有面心立方结构,晶胞由8个结构相似的组成单元(如图2)构成,其中虚线框内局部结构如图3。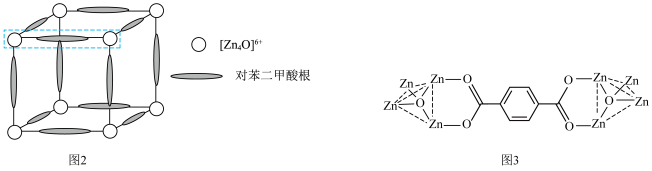
 中氧原子的轨道杂化方式为
中氧原子的轨道杂化方式为 的配位数为
的配位数为②晶体内部空腔可吸附小分子,要增强晶体与
 的吸附作用,可在对苯二甲酸根上引入
的吸附作用,可在对苯二甲酸根上引入A.—Cl B.—OH C.
 D.
D.
③已知该晶体密度为
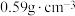 ,对苯二甲酸根与
,对苯二甲酸根与 的相对分子质量分别为
的相对分子质量分别为 和
和 ,
, 为阿伏加德罗常数的值,则该晶胞参数为
为阿伏加德罗常数的值,则该晶胞参数为 、
、 和
和 的式子表示)。
的式子表示)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】三草酸合铁酸钾{K3[Fe(C2O4)3]·3H2O}是制备铁触媒的主要原料,在光照下能分解:2 K3[Fe(C2O4)3]·3H2O 3K2C2O4+2FeC2O4+2CO2↑+6H2O。回答下列问题:
3K2C2O4+2FeC2O4+2CO2↑+6H2O。回答下列问题:
(1)基态Fe原子的电子排布式为___________ ,基态Fe2+与Fe3+中未成对电子的数目之比为___________ 。
(2)三草酸合铁酸钾所含元素中,第一电离能最大的是___________ (填元素符号,下同),电负性最大的是___________ 。
(3)H2O分子的立体构型为___________ 。
(4)金刚石的晶胞结构如图1所示,碳原子分别位于顶点、面心和体内。
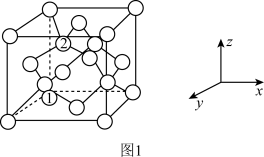
若图中原子1的坐标为(0,0,0),则原子2的坐标为___________ 。若金刚石的晶胞边长为apm,则其中碳碳键的键长d___________ (用含a的代数式表示)pm。
(5)铁有δ、γ、α三种同素异形体(如图2),三种晶体在不同温度下能发生转化。
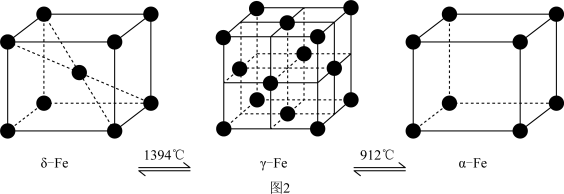
①δ、γ、α三种晶体晶胞中铁原子的配位数之比为___________ 。
②若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶胞的密度之比为___________ (用含a、b的代数式表示)。
 3K2C2O4+2FeC2O4+2CO2↑+6H2O。回答下列问题:
3K2C2O4+2FeC2O4+2CO2↑+6H2O。回答下列问题:(1)基态Fe原子的电子排布式为
(2)三草酸合铁酸钾所含元素中,第一电离能最大的是
(3)H2O分子的立体构型为
(4)金刚石的晶胞结构如图1所示,碳原子分别位于顶点、面心和体内。

若图中原子1的坐标为(0,0,0),则原子2的坐标为
(5)铁有δ、γ、α三种同素异形体(如图2),三种晶体在不同温度下能发生转化。

①δ、γ、α三种晶体晶胞中铁原子的配位数之比为
②若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶胞的密度之比为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
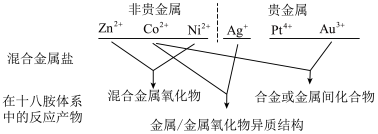
【推荐2】我国化学家研究发现,十八胺在较高温度下具有一定的还原性,由于不同的金属盐从十八胺中获得电子的能力不同,在十八胺体系中反应可以得到不同的产物:当以两种非贵金属盐为原料时得到混合金属氧化物(如 等),以
等),以 和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如
和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如 等),除
等),除 之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如
之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如 等)。
等)。
已知元素的电负性数据:
回答下列问题:
(1)十八胺含有氮元素,它在元素周期表中的位置为_______ 。三种含氮离子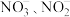 、
、 的键角由大到小的顺序是
的键角由大到小的顺序是_______ 。
(2) 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是_______ 。
(3)以 和钴盐为原料时得到的产物
和钴盐为原料时得到的产物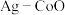 而非
而非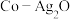 的原因是
的原因是_______ 。
(4)推测 盐和一种非金贵盐混合后在十八胺体系中发生反应所得产物类别为
盐和一种非金贵盐混合后在十八胺体系中发生反应所得产物类别为_______ 。
(5)一种含钴的离子结构如图所示。
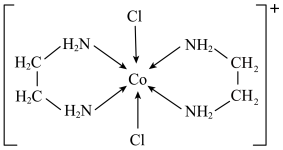
 的价电子排布式是
的价电子排布式是_______ 。已知磁矩 (n表示末成对电子数),则
(n表示末成对电子数),则 的磁矩
的磁矩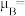
_______ 。
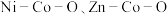 等),以
等),以 和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如
和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如 等),除
等),除 之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如
之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如 等)。
等)。
已知元素的电负性数据:
| 元素 |  |  |  |  |  |  |  |
| 电负性(鲍林标度) | 1.6 | 1.8 | 1.8 | 1.9 | 2.2 | 2.2 | 2.4 |
(1)十八胺含有氮元素,它在元素周期表中的位置为
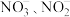 、
、 的键角由大到小的顺序是
的键角由大到小的顺序是(2)
 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是(3)以
 和钴盐为原料时得到的产物
和钴盐为原料时得到的产物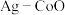 而非
而非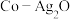 的原因是
的原因是(4)推测
 盐和一种非金贵盐混合后在十八胺体系中发生反应所得产物类别为
盐和一种非金贵盐混合后在十八胺体系中发生反应所得产物类别为(5)一种含钴的离子结构如图所示。

 的价电子排布式是
的价电子排布式是 (n表示末成对电子数),则
(n表示末成对电子数),则 的磁矩
的磁矩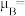
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】铁碳合金在现代建筑中占有十分重要的地位。
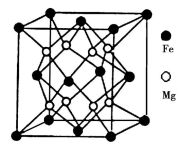
(1)基态Fe3+的M能层上电子排布式为_______ ,铁元素可形成多种配合物,如K3[Fe(CN)6]和Fe(CO)5,则这两种配合物所涉及的元素中,第一电离能由大到小的顺序为________ ,电负性最大的是_______ 。
(2)三聚氰胺(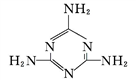 )中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。
)中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。
①三聚氰胺中,环上与环外的氮原子杂化轨道类型分别为_______ 。
②导致三聚氰胺与硝基苯熔点相差很大的根本原因是____________________ 。
(3)已知常温下草酸(HOOC—COOH)的电离平衡常数Ka1=5.6×10-2、Ka2=1.5×10-4,试从结构上解释Ka1、Ka2数值上的差异__________________ 。
(4)一定条件下,碳、氮两种元素可形成一种化合物,该化合物可作耐磨材料,其熔点________ (填“高于”、“低于”或“无法判断”)金刚石的熔点。
(5)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为________ ,若该晶胞的参数为dnm,则该合金的密度为____________ (不必化简,用NA表示阿伏伽德罗常数)。

(1)基态Fe3+的M能层上电子排布式为
(2)三聚氰胺(
 )中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。
)中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。①三聚氰胺中,环上与环外的氮原子杂化轨道类型分别为
②导致三聚氰胺与硝基苯熔点相差很大的根本原因是
(3)已知常温下草酸(HOOC—COOH)的电离平衡常数Ka1=5.6×10-2、Ka2=1.5×10-4,试从结构上解释Ka1、Ka2数值上的差异
(4)一定条件下,碳、氮两种元素可形成一种化合物,该化合物可作耐磨材料,其熔点
(5)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为
您最近一年使用:0次



