MnSO4·H2O在工业、农业等方面有广泛的应用。软锰矿-黄铁矿硫酸浸出法是工业上制取硫酸锰的一种方法。

(1)酸浸时主要反应为15MnO2+2FeS2+14H2SO4= 15MnSO4 + Fe2(SO4)3 +14H2O,反应中被氧化的元素是____ 。酸浸时,硫酸过量的目的是:①____ ;②____ 。
(2)加入CaCO3可以将滤液中的Fe3+转化为Fe(OH)3而除去,该反应的化学方程式为____ 。CaCO3用量过大,对MnSO4·H2O产量的影响是,____ (填“升高”“降低”或“无影响”)。
(3)硫酸锰在不同温度下结晶可分别得到MnSO4·7H2O、MnSO4·5H2O和MnSO4·H2O。硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如下图所示。从过滤Ⅱ所得的滤液中获得较高纯度MnSO4·H2O的操作是:控制温度在80 ℃~90 ℃之间蒸发结晶,____ ,使固体MnSO4·H2O与溶液分离,____ 、真空干燥。


(1)酸浸时主要反应为15MnO2+2FeS2+14H2SO4= 15MnSO4 + Fe2(SO4)3 +14H2O,反应中被氧化的元素是
(2)加入CaCO3可以将滤液中的Fe3+转化为Fe(OH)3而除去,该反应的化学方程式为
(3)硫酸锰在不同温度下结晶可分别得到MnSO4·7H2O、MnSO4·5H2O和MnSO4·H2O。硫酸锰在不同温度下的溶解度和该温度范围内析出晶体的组成如下图所示。从过滤Ⅱ所得的滤液中获得较高纯度MnSO4·H2O的操作是:控制温度在80 ℃~90 ℃之间蒸发结晶,

更新时间:2018-12-04 10:45:05
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】稀土在电子、激光、核工业、超导等诸多高科技领域有广泛的应用。钪(Sc)是一种稀土金属,利用钛尾矿回收金属钪和草酸的工艺流程如图1所示。回答下列问题:

已知:①xNH4Cl·yScF3·zH2O是“沉钪”过程中ScF3与氯化物形成的复盐沉淀,在强酸中部分溶解。
②“脱水除铵”是复盐沉淀的热分解过程。
③25℃时,部分物质的相关信息如表所示:
(1)“焙烧”过程生成Sc2O3的化学方程式为___________ 。
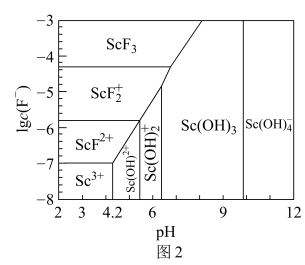
(2)含钪元素的微粒与lgc(F-)、pH的关系如下图所示,用氨水调节溶液的pH值,控制pH的范围是3.5<pH<___________ 。
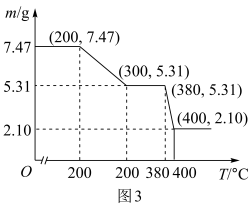
(3)“脱水除铵”过程中固体质量与温度的关系如下图所示,其中在380-400℃过程中会有白烟冒出,保温至无烟气产生,即得到 ScF3,由图3中数据可得x:z=___________ 。
(4)传统制备ScF3的方法是先得到ScF3·6H2O沉淀,再高温脱水得ScF3,但通常含有ScOF杂质,原因是___________ 。(用化学方程式表示)。流程中“沉钪”后“脱水除铵”可制得纯度很高的ScF3,其原因是___________ 。
(5)将1.8mol PbSO4加到1L含有0.12mol/L H2C2O4的废水中。发生的离子反应为PbSO4(s)+H2C2O4(aq) PbC2O4(s)+2H+(aq)+ SO
PbC2O4(s)+2H+(aq)+ SO (aq),该反应的平衡常数K=
(aq),该反应的平衡常数K=___________ 。滤饼经浓硫酸处理后的“沉淀”是___________ (化学式)。

已知:①xNH4Cl·yScF3·zH2O是“沉钪”过程中ScF3与氯化物形成的复盐沉淀,在强酸中部分溶解。
②“脱水除铵”是复盐沉淀的热分解过程。
③25℃时,部分物质的相关信息如表所示:
| Ksp(PbSO4) | Ksp(PbC2O4) | Ka1(H2C2O4) | Ka2(H2C2O4) |
| 2.0×10-8 | 5.0×10-10 | 6.0×10-2 | 6.25×10-5 |
(2)含钪元素的微粒与lgc(F-)、pH的关系如下图所示,用氨水调节溶液的pH值,控制pH的范围是3.5<pH<

(3)“脱水除铵”过程中固体质量与温度的关系如下图所示,其中在380-400℃过程中会有白烟冒出,保温至无烟气产生,即得到 ScF3,由图3中数据可得x:z=

(4)传统制备ScF3的方法是先得到ScF3·6H2O沉淀,再高温脱水得ScF3,但通常含有ScOF杂质,原因是
(5)将1.8mol PbSO4加到1L含有0.12mol/L H2C2O4的废水中。发生的离子反应为PbSO4(s)+H2C2O4(aq)
 PbC2O4(s)+2H+(aq)+ SO
PbC2O4(s)+2H+(aq)+ SO (aq),该反应的平衡常数K=
(aq),该反应的平衡常数K=
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】无水氯化钴( )呈蓝色,吸收不同量的水后变为粉红色至红色(如
)呈蓝色,吸收不同量的水后变为粉红色至红色(如 呈红色),常作湿度指示剂。实验室以钴渣(主要成分是CoO、
呈红色),常作湿度指示剂。实验室以钴渣(主要成分是CoO、 ,含少量Ni、
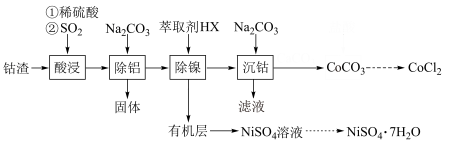
,含少量Ni、 等杂质)为原料制备无水氯化钴的流程如图(部分产物和条件省略):
等杂质)为原料制备无水氯化钴的流程如图(部分产物和条件省略):
已知:①几种金属离子转化为氢氧化物沉淀的pH如表所示:
② 极易水解生成两种气体,其中一种气体能使品红溶液褪色。
极易水解生成两种气体,其中一种气体能使品红溶液褪色。
回答下列问题:
(1)酸浸。将一定量钴渣加入到三颈瓶中(装置如图所示),将稀硫酸通过滴液漏斗加入其中,再向悬浊液中通入 。写出
。写出 参与反应的离子方程式为
参与反应的离子方程式为_______ 。
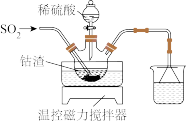
(2)除铝。得到固体的主要成分是_______ (填化学式),该步调节pH的范围为_______ 。
(3)制备无水 。实验室由
。实验室由 制备无水
制备无水 ,请补充实验方案:①
,请补充实验方案:①_______ ,用蒸馏水洗涤2~3次,低温干燥。将所得固体( )置于圆底烧瓶中,②
)置于圆底烧瓶中,②_______ ,停止加热,得到无水 。(实验中须使用的试剂:
。(实验中须使用的试剂: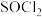 、
、 盐酸、
盐酸、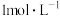 NaOH溶液)。
NaOH溶液)。
(4)钴(Ⅲ)可形成 (
(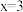 ,4,5,6)等一系列配位数为6的配合物。现取10.00 mL 0.1000 mol/L某钴(Ⅲ)配合物的水溶液,向其中滴加50.00 mL 0.2000 mol/L
,4,5,6)等一系列配位数为6的配合物。现取10.00 mL 0.1000 mol/L某钴(Ⅲ)配合物的水溶液,向其中滴加50.00 mL 0.2000 mol/L  溶液,立即产生白色沉淀0.1435g,过滤,充分加热滤液,将氨气全部逸出,又生成一定量的白色沉淀。通过计算求出该配合物的化学式为
溶液,立即产生白色沉淀0.1435g,过滤,充分加热滤液,将氨气全部逸出,又生成一定量的白色沉淀。通过计算求出该配合物的化学式为_______ (写出计算过程)。
 )呈蓝色,吸收不同量的水后变为粉红色至红色(如
)呈蓝色,吸收不同量的水后变为粉红色至红色(如 呈红色),常作湿度指示剂。实验室以钴渣(主要成分是CoO、
呈红色),常作湿度指示剂。实验室以钴渣(主要成分是CoO、 ,含少量Ni、
,含少量Ni、 等杂质)为原料制备无水氯化钴的流程如图(部分产物和条件省略):
等杂质)为原料制备无水氯化钴的流程如图(部分产物和条件省略):
已知:①几种金属离子转化为氢氧化物沉淀的pH如表所示:
| 金属离子 |  |  |  |
| 升始沉淀的pH | 4.0 | 7.6 | 7.7 |
| 完全沉淀的pH | 5.2 | 9.2 | 9.5 |
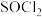 极易水解生成两种气体,其中一种气体能使品红溶液褪色。
极易水解生成两种气体,其中一种气体能使品红溶液褪色。回答下列问题:
(1)酸浸。将一定量钴渣加入到三颈瓶中(装置如图所示),将稀硫酸通过滴液漏斗加入其中,再向悬浊液中通入
 。写出
。写出 参与反应的离子方程式为
参与反应的离子方程式为
(2)除铝。得到固体的主要成分是
(3)制备无水
 。实验室由
。实验室由 制备无水
制备无水 ,请补充实验方案:①
,请补充实验方案:① )置于圆底烧瓶中,②
)置于圆底烧瓶中,② 。(实验中须使用的试剂:
。(实验中须使用的试剂: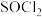 、
、 盐酸、
盐酸、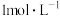 NaOH溶液)。
NaOH溶液)。(4)钴(Ⅲ)可形成
 (
(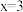 ,4,5,6)等一系列配位数为6的配合物。现取10.00 mL 0.1000 mol/L某钴(Ⅲ)配合物的水溶液,向其中滴加50.00 mL 0.2000 mol/L
,4,5,6)等一系列配位数为6的配合物。现取10.00 mL 0.1000 mol/L某钴(Ⅲ)配合物的水溶液,向其中滴加50.00 mL 0.2000 mol/L  溶液,立即产生白色沉淀0.1435g,过滤,充分加热滤液,将氨气全部逸出,又生成一定量的白色沉淀。通过计算求出该配合物的化学式为
溶液,立即产生白色沉淀0.1435g,过滤,充分加热滤液,将氨气全部逸出,又生成一定量的白色沉淀。通过计算求出该配合物的化学式为
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】大力推广锂电池新能源汽车对实现“碳达峰”和“碳中和”具有重要意义。 与
与 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为
都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 ,还有少量
,还有少量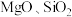 等杂质)来制备,工艺流程如下:
等杂质)来制备,工艺流程如下:
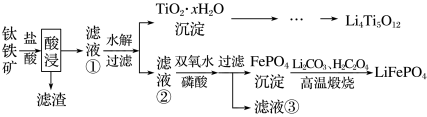
已知:“酸浸”后,钛主要以 形式存在。
形式存在。
回答下列问题:
(1)滤渣的主要成分是______ 。
(2)写出由 经水解制备
经水解制备 的离子方程式
的离子方程式______ 。
(3)在制备 的过程中会生成
的过程中会生成 (
( 为+4价),则
为+4价),则 中过氧键的数目为
中过氧键的数目为______ 。
(4)滤液②加双氧水的目的是______ 。
(5)写出制备 的化学方程式
的化学方程式______ 。
(6) 的晶胞结构示意图如(a)所示,晶胞参数为
的晶胞结构示意图如(a)所示,晶胞参数为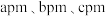 。其中
。其中 围绕
围绕 和
和 分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。电池充电时,
分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。电池充电时, [图(a)]脱出部分
[图(a)]脱出部分 ,转化为
,转化为 [图(b)],最终转化为
[图(b)],最终转化为 [图(c)]。则
[图(c)]。则 的晶胞密度为
的晶胞密度为______  ,充电过程
,充电过程 转化为转化为
转化为转化为 的电极反应式
的电极反应式______ 。

 与
与 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为
都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 ,还有少量
,还有少量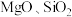 等杂质)来制备,工艺流程如下:
等杂质)来制备,工艺流程如下:
已知:“酸浸”后,钛主要以
 形式存在。
形式存在。回答下列问题:
(1)滤渣的主要成分是
(2)写出由
 经水解制备
经水解制备 的离子方程式
的离子方程式(3)在制备
 的过程中会生成
的过程中会生成 (
( 为+4价),则
为+4价),则 中过氧键的数目为
中过氧键的数目为(4)滤液②加双氧水的目的是
(5)写出制备
 的化学方程式
的化学方程式(6)
 的晶胞结构示意图如(a)所示,晶胞参数为
的晶胞结构示意图如(a)所示,晶胞参数为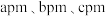 。其中
。其中 围绕
围绕 和
和 分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。电池充电时,
分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。电池充电时, [图(a)]脱出部分
[图(a)]脱出部分 ,转化为
,转化为 [图(b)],最终转化为
[图(b)],最终转化为 [图(c)]。则
[图(c)]。则 的晶胞密度为
的晶胞密度为 ,充电过程
,充电过程 转化为转化为
转化为转化为 的电极反应式
的电极反应式
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】某实验小组的同学为了探究CuSO4溶液与Na2CO3溶液的反应原理并验证产物,进行如下实验。
实验I:将CuSO4溶液与Na2CO3溶液混合,一定温度下充分反应至不产生气泡为止,过滤、冷水洗涤、低温干燥,得到蓝绿色固体。该小组同学猜想该固体xCuCO3·yCu(OH)2。
(1)为了验证猜想,先进行定性实验。
(2)为确定蓝绿色固体的组成,进一步测定x、y的值,使用如下装置再进行定量实验。
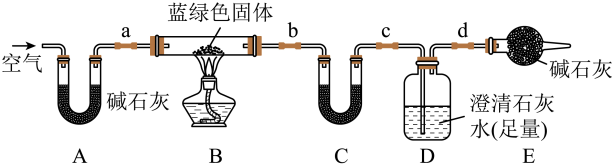
实验III:称取5.190g样品,充分加热至不再产生气体为止。
①装置C中盛放的试剂可以是_______ 。反应结束时要通入适量的空气,其作用是_______ 。
②实验结束后,测得装置C增重0.270g,装置D增重1.320g。该蓝绿色固体的化学式为_______ 。
(3)若x=y=1,写出CuSO4溶液和Na2CO3溶液混合时发生的离子方程式_______ 。
(4)已知20℃时溶解度数据:S[Ca(OH)2]=0.16g,S[Ba(OH)2]=3.89g。有同学据此提出可将装置D中的澄清石灰水换成等体积的饱和Ba(OH)2溶液更好,其可能的依据之一是_______ 。
(5)有同学为了降低实验误差,提出如下建议,其中合理的是_______ (填字母序号)。
A.加热装置B前,先通空气一段时间后再称量C、D的初始质量
B.将D换为盛有碱石灰的U形管
C.将C、D颠倒并省去E装置
实验I:将CuSO4溶液与Na2CO3溶液混合,一定温度下充分反应至不产生气泡为止,过滤、冷水洗涤、低温干燥,得到蓝绿色固体。该小组同学猜想该固体xCuCO3·yCu(OH)2。
(1)为了验证猜想,先进行定性实验。
| 实验II | 取适量蓝绿色固体,加入足量稀硫酸 | 固体溶解,生成蓝色溶液及 | 蓝绿色固体中含有 |

实验III:称取5.190g样品,充分加热至不再产生气体为止。
①装置C中盛放的试剂可以是
②实验结束后,测得装置C增重0.270g,装置D增重1.320g。该蓝绿色固体的化学式为
(3)若x=y=1,写出CuSO4溶液和Na2CO3溶液混合时发生的离子方程式
(4)已知20℃时溶解度数据:S[Ca(OH)2]=0.16g,S[Ba(OH)2]=3.89g。有同学据此提出可将装置D中的澄清石灰水换成等体积的饱和Ba(OH)2溶液更好,其可能的依据之一是
(5)有同学为了降低实验误差,提出如下建议,其中合理的是
A.加热装置B前,先通空气一段时间后再称量C、D的初始质量
B.将D换为盛有碱石灰的U形管
C.将C、D颠倒并省去E装置
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】实验室以含镍废料(主要成分为NiO,含少量FeO、 、CoO、BaO和
、CoO、BaO和 )为原料制备
)为原料制备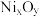 和碳酸钴
和碳酸钴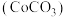 的工艺流程如图。
的工艺流程如图。
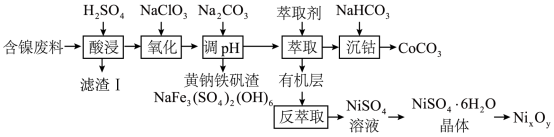
请回答以下问题:
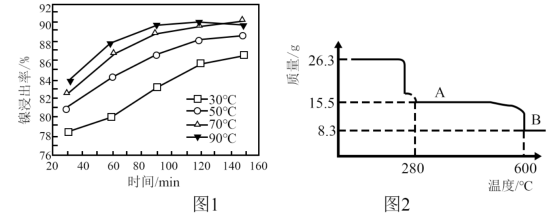
(1)“滤渣I”主要成分是______ ,“酸浸”过程中镍的浸出率与温度和时间的关系如图1所示,酸浸的最佳温度和时间是______ 。
(2)“氧化”时反应的离子方程式是______ ,实际生产中为了减少杂质离子的引入,可以用来替代 的试剂是
的试剂是______ 。
(3)“调pH”过程中, 不能过量的原因是
不能过量的原因是______ ,“沉钴”时反应的离子方程式是______ 。
(4)资料显示,硫酸镍结晶水合物的形态与温度有如表关系。
从 溶液获得稳定的
溶液获得稳定的 晶体的操作依次是蒸发浓缩、
晶体的操作依次是蒸发浓缩、______ 。
(5) 晶体煅烧时剩余固体质量与温度变化曲线如图2,该曲线中B段所表示氧化物的化学式为
晶体煅烧时剩余固体质量与温度变化曲线如图2,该曲线中B段所表示氧化物的化学式为______ 。
 、CoO、BaO和
、CoO、BaO和 )为原料制备
)为原料制备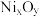 和碳酸钴
和碳酸钴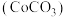 的工艺流程如图。
的工艺流程如图。
请回答以下问题:

(1)“滤渣I”主要成分是
(2)“氧化”时反应的离子方程式是
 的试剂是
的试剂是(3)“调pH”过程中,
 不能过量的原因是
不能过量的原因是(4)资料显示,硫酸镍结晶水合物的形态与温度有如表关系。
| 温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
| 晶体形态 |  |  | 多种结晶水合物 |  |
 溶液获得稳定的
溶液获得稳定的 晶体的操作依次是蒸发浓缩、
晶体的操作依次是蒸发浓缩、(5)
 晶体煅烧时剩余固体质量与温度变化曲线如图2,该曲线中B段所表示氧化物的化学式为
晶体煅烧时剩余固体质量与温度变化曲线如图2,该曲线中B段所表示氧化物的化学式为
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
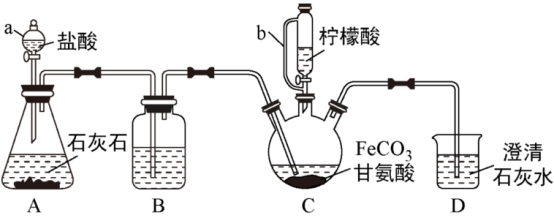
【推荐3】甘氨酸亚铁[ ]是新一代畜禽饲料补铁添加剂。某实验小组以碳酸亚铁和甘氨酸反应制备甘氨酸亚铁的装置如下(夹持和加热仪器略去):
]是新一代畜禽饲料补铁添加剂。某实验小组以碳酸亚铁和甘氨酸反应制备甘氨酸亚铁的装置如下(夹持和加热仪器略去):
查阅资料:
①反应原理为:
②甘氨酸易溶于水,微溶于乙醇:甘氨酸亚铁易溶于水,难溶于乙醇。
③柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
回答下列问题:
(1)仪器b的名称为___________ ,与a相比,其优点是___________ 。
(2)装置B中盛有的试剂为___________ 。
(3)实验中先打开a的活塞,当观察到___________ 时,再加热装置C,同时打开b的旋塞,向C中滴加柠檬酸。
(4)柠檬酸的作用是①___________ ,②___________ 。
(5)反应结束后过滤,取滤液,___________ ,过滤、洗涤、干燥得产品。
(6)装置C中盛有 和
和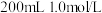 的甘氨酸溶液,最终干燥后得15.3g固体,其产率是
的甘氨酸溶液,最终干燥后得15.3g固体,其产率是___________ 。
 ]是新一代畜禽饲料补铁添加剂。某实验小组以碳酸亚铁和甘氨酸反应制备甘氨酸亚铁的装置如下(夹持和加热仪器略去):
]是新一代畜禽饲料补铁添加剂。某实验小组以碳酸亚铁和甘氨酸反应制备甘氨酸亚铁的装置如下(夹持和加热仪器略去):
查阅资料:
①反应原理为:

②甘氨酸易溶于水,微溶于乙醇:甘氨酸亚铁易溶于水,难溶于乙醇。
③柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
回答下列问题:
(1)仪器b的名称为
(2)装置B中盛有的试剂为
(3)实验中先打开a的活塞,当观察到
(4)柠檬酸的作用是①
(5)反应结束后过滤,取滤液,
(6)装置C中盛有
 和
和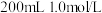 的甘氨酸溶液,最终干燥后得15.3g固体,其产率是
的甘氨酸溶液,最终干燥后得15.3g固体,其产率是
您最近半年使用:0次
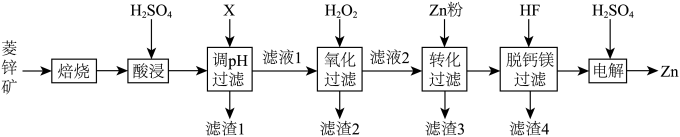
【推荐1】以菱锌矿(主要含有 ,另含有少量
,另含有少量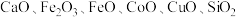 等)为原料电解制
等)为原料电解制 的流程如图:
的流程如图:
相关难溶物溶度积常数如下表:
(1)“酸浸”时为提高锌的浸出率,可采取的措施有_______ (写出一种即可)。
(2)“调 过滤”中,物质X最适宜选择
过滤”中,物质X最适宜选择_______ (填标号)。
A. B.
B. C.
C.
(3)“氧化过滤”中, 转化为
转化为 的离子方程式为
的离子方程式为_______ 。若反应结束时,溶液 为5,则残留的
为5,则残留的
_______  。
。
(4)“转化过滤”中,除去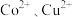 速率先慢后快的原因是
速率先慢后快的原因是_______ 。
(5)“脱钙镁过滤”后,溶液中
_______ 。
(6)“电解”装置示意如图。
①开始通电时,阳极表面形成 ,保护阳极不被酸性电解液腐蚀,相应的电极反应式为
,保护阳极不被酸性电解液腐蚀,相应的电极反应式为_______ 。
②电解过程中,电解液中 含量应维持在
含量应维持在 ,
, 含量不宜过高的原因是
含量不宜过高的原因是_______ 。
 ,另含有少量
,另含有少量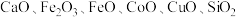 等)为原料电解制
等)为原料电解制 的流程如图:
的流程如图:
相关难溶物溶度积常数如下表:
| 物质 |  |  |  |  |
 | 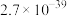 | 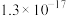 |  |  |
(1)“酸浸”时为提高锌的浸出率,可采取的措施有
(2)“调
 过滤”中,物质X最适宜选择
过滤”中,物质X最适宜选择A.
 B.
B. C.
C.
(3)“氧化过滤”中,
 转化为
转化为 的离子方程式为
的离子方程式为 为5,则残留的
为5,则残留的
 。
。(4)“转化过滤”中,除去
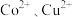 速率先慢后快的原因是
速率先慢后快的原因是(5)“脱钙镁过滤”后,溶液中

(6)“电解”装置示意如图。

①开始通电时,阳极表面形成
 ,保护阳极不被酸性电解液腐蚀,相应的电极反应式为
,保护阳极不被酸性电解液腐蚀,相应的电极反应式为②电解过程中,电解液中
 含量应维持在
含量应维持在 ,
, 含量不宜过高的原因是
含量不宜过高的原因是
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
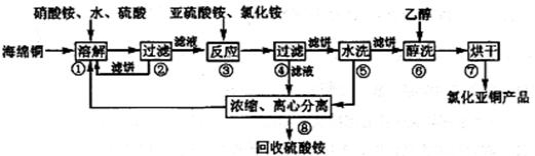
【推荐2】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
回答下列问题:
(1)写出“溶解”过程中发生的氧化还原反应的离子方程式(N元素被还原到最低价):_______ ,溶解温度应控制在60-70℃,原因是_______ 。
(2)写出步骤③中,氧化剂与还原剂的物质的量之比为________ 。已知NH4Cl、Cu2+的物质的量之比[n(NH4Cl)/n(Cu2+)]与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定程度后的氯化亚铜的沉淀率减少,其可能的原因是__________ 。

(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_____ (写名称),回收的主要物质是____ (写化学式)
(4)上述工艺中,步骤⑥醇洗的作用是__________ 。
(5)称取2.000g CuCl样品(杂质不参与反应),溶于一定量的0.5000mol/L FeCl3溶液中,加水稀释至200mL得到溶于,取20.00mL用0.1000mol/L的Ce(SO4)2溶液滴定到终点,消耗20.00mL Ce(SO4)2
有关反应式:Fe3++CuCl═Fe2++Cu2++Cl﹣ Ce4++Fe2+═Fe3++Ce3+
则样品中CuCl的质量分数_________ 。
回答下列问题:
(1)写出“溶解”过程中发生的氧化还原反应的离子方程式(N元素被还原到最低价):
(2)写出步骤③中,氧化剂与还原剂的物质的量之比为

(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是
(4)上述工艺中,步骤⑥醇洗的作用是
(5)称取2.000g CuCl样品(杂质不参与反应),溶于一定量的0.5000mol/L FeCl3溶液中,加水稀释至200mL得到溶于,取20.00mL用0.1000mol/L的Ce(SO4)2溶液滴定到终点,消耗20.00mL Ce(SO4)2
有关反应式:Fe3++CuCl═Fe2++Cu2++Cl﹣ Ce4++Fe2+═Fe3++Ce3+
则样品中CuCl的质量分数
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】Ni、Co均是重要的战略性金属。从处理后的矿石硝酸浸取液(含Ni2+、Co2+、Al3+、Mg2+)中,利用氨浸工艺可提取Ni、Co,并获得高附加值化工产品。工艺流程如下:

已知:氨性溶液由NH3·H2O、(NH4)2SO3和(NH4)2CO3配制。常温下,Ni2+、Co2+、Co3+与NH3形成可溶于水的配离子:lgKb(NH3·H2O)=-4.7;Co (OH)2易被空气氧化为Co (OH)3;部分氢氧化物的Ksp如下表。
回答下列问题:
(1)活性MgO可与水反应,化学方程式为___________ 。
(2)常温下,pH=9.9的氨性溶液中,c(NH3·H2O)___________ c(NH ) (填“>”“<”或“=”)。
) (填“>”“<”或“=”)。
(3) (NH4)2CO3会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了NH4Al(OH)2CO3的明锐衍射峰。
①NH4Al(OH)2CO3属于___________ (填“晶体”或“非晶体”)。
②(NH4)2CO3提高了Ni、Co的浸取速率,其原因是___________ 。
(4)①“析晶”过程中通入的酸性气体A为___________ 。
②由CoCl2可制备AlxCoOy晶体,其立方晶胞如图。Al与O最小间距大于Co与O最小间距,x、y为整数,则Co在晶胞中的位置为___________ ;晶体中一个Al周围与其最近的O的个数为___________ 。

(5)①“结晶纯化”过程中,没有引入新物质。晶体A含6个结晶水,则所得HNO3溶液中n(HNO3)与n(H2O)的比值,理论上最高为___________ 。
②“热解”对于从矿石提取Ni、Co工艺的意义,在于可重复利用HNO3和___________ (填化学式)。

已知:氨性溶液由NH3·H2O、(NH4)2SO3和(NH4)2CO3配制。常温下,Ni2+、Co2+、Co3+与NH3形成可溶于水的配离子:lgKb(NH3·H2O)=-4.7;Co (OH)2易被空气氧化为Co (OH)3;部分氢氧化物的Ksp如下表。
| 氢氧化物 | Co (OH)2 | Co (OH)3 | Ni(OH)2 | Al(OH)3 | Mg(OH)2 |
| Ksp | 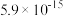 |  |  | 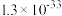 | 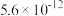 |
(1)活性MgO可与水反应,化学方程式为
(2)常温下,pH=9.9的氨性溶液中,c(NH3·H2O)
 ) (填“>”“<”或“=”)。
) (填“>”“<”或“=”)。(3) (NH4)2CO3会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了NH4Al(OH)2CO3的明锐衍射峰。
①NH4Al(OH)2CO3属于
②(NH4)2CO3提高了Ni、Co的浸取速率,其原因是
(4)①“析晶”过程中通入的酸性气体A为
②由CoCl2可制备AlxCoOy晶体,其立方晶胞如图。Al与O最小间距大于Co与O最小间距,x、y为整数,则Co在晶胞中的位置为

(5)①“结晶纯化”过程中,没有引入新物质。晶体A含6个结晶水,则所得HNO3溶液中n(HNO3)与n(H2O)的比值,理论上最高为
②“热解”对于从矿石提取Ni、Co工艺的意义,在于可重复利用HNO3和
您最近半年使用:0次



