我国化学家研究发现,十八胺在较高温度下具有一定的还原性,由于不同的金属盐从十八胺中获得电子的能力不同,在十八胺体系中反应可以得到不同的产物:当以两种非贵金属盐为原料时得到混合金属氧化物(如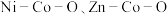 等),以
等),以 和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如
和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如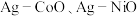 等),除
等),除 之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如
之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如 等)。
等)。
已知元素的电负性数据:
回答下列问题:
(1)十八胺含有氮元素,它在元素周期表中的位置为_______ 。三种含氮离子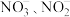 、
、 的键角由大到小的顺序是
的键角由大到小的顺序是_______ 。
(2) 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是_______ 。
(3)以 和钴盐为原料时得到的产物
和钴盐为原料时得到的产物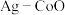 而非
而非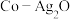 的原因是
的原因是_______ 。
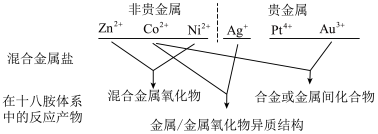
(4)推测 盐和一种非金贵盐混合后在十八胺体系中发生反应所得产物类别为
盐和一种非金贵盐混合后在十八胺体系中发生反应所得产物类别为_______ 。
(5)一种含钴的离子结构如图所示。
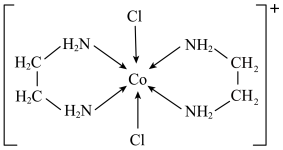
 的价电子排布式是
的价电子排布式是_______ 。已知磁矩 (n表示末成对电子数),则
(n表示末成对电子数),则 的磁矩
的磁矩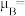
_______ 。
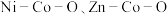 等),以
等),以 和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如
和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如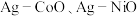 等),除
等),除 之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如
之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如 等)。
等)。
已知元素的电负性数据:
| 元素 |  |  |  |  |  |  |  |
| 电负性(鲍林标度) | 1.6 | 1.8 | 1.8 | 1.9 | 2.2 | 2.2 | 2.4 |
(1)十八胺含有氮元素,它在元素周期表中的位置为
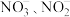 、
、 的键角由大到小的顺序是
的键角由大到小的顺序是(2)
 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是(3)以
 和钴盐为原料时得到的产物
和钴盐为原料时得到的产物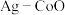 而非
而非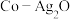 的原因是
的原因是(4)推测
 盐和一种非金贵盐混合后在十八胺体系中发生反应所得产物类别为
盐和一种非金贵盐混合后在十八胺体系中发生反应所得产物类别为(5)一种含钴的离子结构如图所示。

 的价电子排布式是
的价电子排布式是 (n表示末成对电子数),则
(n表示末成对电子数),则 的磁矩
的磁矩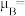
更新时间:2023-02-12 20:59:16
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】黑火药是我国古代四大发明之一,常用“一硫、二硝、三木炭”描述其组成,发生爆炸反应生成K2S、N2和CO2等。回答下列问题:
(1)基态S原子中,占据最高能级的核外电子的电子云轮廓图形状为_______ 。
(2)KNO3中所含元素的第一电离能由大到小的顺序为_______ (用元素符号表示);其阴离子的立体构型为_______ 。
(3)相同条件下,CO的沸点高于N2的原因为_______ 。(已知:CO和N2相对分子质量均为28)
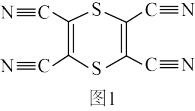
(4)化合物M(如图1所示)是合成含硫功能材料的配体。其中C原子的杂化方式为_______ ;σ键与π键的数目之比为_______ 。
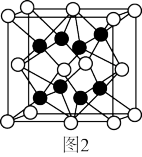
(5)K2S晶体具有反萤石型的立方结构(萤石的晶胞结构如图2所示)。晶体中S2-的配位数为_______ 。
(1)基态S原子中,占据最高能级的核外电子的电子云轮廓图形状为
(2)KNO3中所含元素的第一电离能由大到小的顺序为
(3)相同条件下,CO的沸点高于N2的原因为
(4)化合物M(如图1所示)是合成含硫功能材料的配体。其中C原子的杂化方式为

(5)K2S晶体具有反萤石型的立方结构(萤石的晶胞结构如图2所示)。晶体中S2-的配位数为

您最近一年使用:0次
【推荐2】东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素的基态价电子排布式为_____________ ,3d能级上的未成对的电子数为______ 。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______________ ,提供孤电子对的成键原子是_____________ 。
②氨的沸点_________ (填“高于”或“低于”)膦(PH3),原因是__________________ ;氨是_________ 分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______ 。
(3)单质铜及镍都是由______________ 键形成的晶体。
(4)某镍白铜合金的立方晶胞结构如图所示。
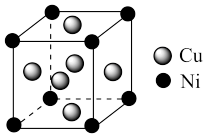
①晶胞中铜原子与镍原子的数量比为___________ 。
②若合金的密度为dg/cm3,晶胞边长a=______________ nm。
(1)镍元素的基态价电子排布式为
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为
②氨的沸点
(3)单质铜及镍都是由
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为
②若合金的密度为dg/cm3,晶胞边长a=
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】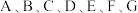 为原子序数依次增大的七种元素,其中
为原子序数依次增大的七种元素,其中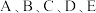 为短周期元素,
为短周期元素,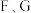 为第四周期元素。已知:基态A原子的电子层数、能级数目和轨道数目均相等;B元素L能层电子数是K能层的2倍;C元素原子核外p电子数比s电子数少1个;D原子的第一至第四电离能为
为第四周期元素。已知:基态A原子的电子层数、能级数目和轨道数目均相等;B元素L能层电子数是K能层的2倍;C元素原子核外p电子数比s电子数少1个;D原子的第一至第四电离能为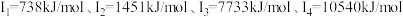 ;基态E原子的最外层p轨道有2个电子的自旋状态与其他电子的自旋状态相反;F元素对应的单质是生活中使用最多的一种金属,其高价氯化物的盐溶液常用于刻蚀铜制印刷电路板;G的未成对电子数在前四周期元素中最多。
;基态E原子的最外层p轨道有2个电子的自旋状态与其他电子的自旋状态相反;F元素对应的单质是生活中使用最多的一种金属,其高价氯化物的盐溶液常用于刻蚀铜制印刷电路板;G的未成对电子数在前四周期元素中最多。
(1)E元素在元素周期表中的位置为_____________ ,其基态原子核外有_____________ 种空间运动状态不同的电子;画出基态G原子的价电子轨道表示式_____________ 。
(2)B、C、D三种元素的第一电离能由大到小的顺序是_____________ (用元素符号表示)。
(3)已知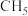 为离子化合物,写出其电子式
为离子化合物,写出其电子式_____________ 。
(4)m是由元素A和B组成的共价四核化合物,共含14个电子,m分子内所含共价键中 键与
键与 键个数比为
键个数比为_____________ 。
(5)F元素可形成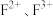 ,离子半径
,离子半径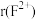
_____________ 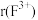 (填“>”、“<”或“=”),其中较稳定的是
(填“>”、“<”或“=”),其中较稳定的是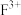 ,原因是
,原因是_____________ 。
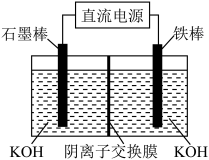
(6)题中F元素与钾和氧元素构成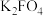 ,被称为“绿色化学”净水剂。电解法可制得
,被称为“绿色化学”净水剂。电解法可制得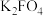 ,装置如图,阳极电极反应式为
,装置如图,阳极电极反应式为_____________ 。
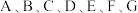 为原子序数依次增大的七种元素,其中
为原子序数依次增大的七种元素,其中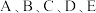 为短周期元素,
为短周期元素,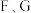 为第四周期元素。已知:基态A原子的电子层数、能级数目和轨道数目均相等;B元素L能层电子数是K能层的2倍;C元素原子核外p电子数比s电子数少1个;D原子的第一至第四电离能为
为第四周期元素。已知:基态A原子的电子层数、能级数目和轨道数目均相等;B元素L能层电子数是K能层的2倍;C元素原子核外p电子数比s电子数少1个;D原子的第一至第四电离能为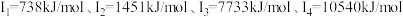 ;基态E原子的最外层p轨道有2个电子的自旋状态与其他电子的自旋状态相反;F元素对应的单质是生活中使用最多的一种金属,其高价氯化物的盐溶液常用于刻蚀铜制印刷电路板;G的未成对电子数在前四周期元素中最多。
;基态E原子的最外层p轨道有2个电子的自旋状态与其他电子的自旋状态相反;F元素对应的单质是生活中使用最多的一种金属,其高价氯化物的盐溶液常用于刻蚀铜制印刷电路板;G的未成对电子数在前四周期元素中最多。(1)E元素在元素周期表中的位置为
(2)B、C、D三种元素的第一电离能由大到小的顺序是
(3)已知
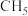 为离子化合物,写出其电子式
为离子化合物,写出其电子式(4)m是由元素A和B组成的共价四核化合物,共含14个电子,m分子内所含共价键中
 键与
键与 键个数比为
键个数比为(5)F元素可形成
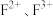 ,离子半径
,离子半径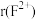
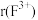 (填“>”、“<”或“=”),其中较稳定的是
(填“>”、“<”或“=”),其中较稳定的是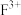 ,原因是
,原因是(6)题中F元素与钾和氧元素构成
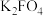 ,被称为“绿色化学”净水剂。电解法可制得
,被称为“绿色化学”净水剂。电解法可制得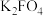 ,装置如图,阳极电极反应式为
,装置如图,阳极电极反应式为
您最近一年使用:0次
【推荐1】(1)下列碳原子最外层电子排布图表示的状态中,能量最低的是_______ 。
A.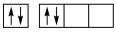 B.
B. 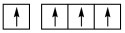 C.
C. 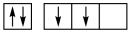 D.
D. 
(2)某一元素的逐级电离能(kJ/mol)数据如下:
该元素原子最外层电子数是____ 。
(3)向胆矾溶液中滴加氨水至过量,最终得到深蓝色的透明溶液,再加入乙醇后析出深蓝色晶体,写出生成深蓝色透明溶液的离子方程式:____ 。该实验可知,与Cu2+结合生成配离子的稳定性:H2O___ NH3(填“>”或“<”)。H2O分子中О原子的杂化方式是____ ,H2O分子中键角∠H-O-H____ NH3分子中键角∠H-N-H(填“>”或“<”),其原因是____ 。
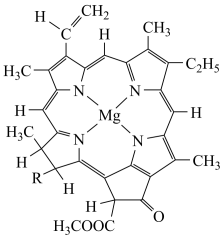
(4)卟啉配合物叶绿素是一种接近平面结构的配合物,其结构如图所示。叶绿素的中心离子无论是Mg2+还是Fe2+,都能形成稳定结构,原因是___ ,其中稳定性相对较高的是___ (填“Mg2+”或“Fe2+”) 。
(5)用质谱仪检测气态乙酸时,谱图中出现质荷比(相对分子质量)为120的峰,原因是_______ 。
A.
 B.
B.  C.
C.  D.
D. 
(2)某一元素的逐级电离能(kJ/mol)数据如下:
第一电离能 | 第二电离能 | 第三电离能 | 第四电离能 | 第五电离能 |
800.6 | 2427.1 | 3659.7 | 25025.8 | 32826.7 |
(3)向胆矾溶液中滴加氨水至过量,最终得到深蓝色的透明溶液,再加入乙醇后析出深蓝色晶体,写出生成深蓝色透明溶液的离子方程式:
(4)卟啉配合物叶绿素是一种接近平面结构的配合物,其结构如图所示。叶绿素的中心离子无论是Mg2+还是Fe2+,都能形成稳定结构,原因是

(5)用质谱仪检测气态乙酸时,谱图中出现质荷比(相对分子质量)为120的峰,原因是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】中国科学技术大学吴长征教授团队通过四烷基铵阳离子的插层及随后对合适氧化还原电位的选择,成功剥离制备出二维非范德华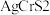 纳米片。
纳米片。
(1)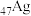 与铜元素同族,其基态原子价电子轨道表达式为
与铜元素同族,其基态原子价电子轨道表达式为___________ 。
(2)N、O、S的第一电离能由小到大的顺序为,___________ ,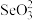 的空间结构为
的空间结构为___________ ,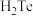 中碲的杂化轨道类型是
中碲的杂化轨道类型是___________ 。
(3)高氧化态 的过氧化物大多不稳定,容易分解,但
的过氧化物大多不稳定,容易分解,但 却是稳定的。这种配合物仍保持
却是稳定的。这种配合物仍保持 的过氧化物的结构特点,具体如图所示,
的过氧化物的结构特点,具体如图所示, 该配合物含有
该配合物含有___________  配位键;该结构中
配位键;该结构中 键角
键角___________  中的
中的 键角(填“大于”、“小于”或“等于”)。
键角(填“大于”、“小于”或“等于”)。 晶胞与
晶胞与 晶胞相似(如图),
晶胞相似(如图), 晶胞中部分原子的分数坐标为:A点
晶胞中部分原子的分数坐标为:A点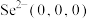 ,从该晶胞中找出距离B点
,从该晶胞中找出距离B点 最远的
最远的 的位置
的位置___________ (用分数坐标表示),晶胞中距离最近的两个 的距离为
的距离为 ,请计算
,请计算 晶胞的密度
晶胞的密度___________  。
。
 纳米片。
纳米片。(1)
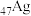 与铜元素同族,其基态原子价电子轨道表达式为
与铜元素同族,其基态原子价电子轨道表达式为(2)N、O、S的第一电离能由小到大的顺序为,
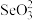 的空间结构为
的空间结构为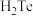 中碲的杂化轨道类型是
中碲的杂化轨道类型是(3)高氧化态
 的过氧化物大多不稳定,容易分解,但
的过氧化物大多不稳定,容易分解,但 却是稳定的。这种配合物仍保持
却是稳定的。这种配合物仍保持 的过氧化物的结构特点,具体如图所示,
的过氧化物的结构特点,具体如图所示, 该配合物含有
该配合物含有 配位键;该结构中
配位键;该结构中 键角
键角 中的
中的 键角(填“大于”、“小于”或“等于”)。
键角(填“大于”、“小于”或“等于”)。
 晶胞与
晶胞与 晶胞相似(如图),
晶胞相似(如图), 晶胞中部分原子的分数坐标为:A点
晶胞中部分原子的分数坐标为:A点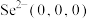 ,从该晶胞中找出距离B点
,从该晶胞中找出距离B点 最远的
最远的 的位置
的位置 的距离为
的距离为 ,请计算
,请计算 晶胞的密度
晶胞的密度 。
。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】三氧化二钴主要用作颜料、釉料及磁性材料,利用铜钴矿石制备 的工艺流程如图所示:
的工艺流程如图所示:
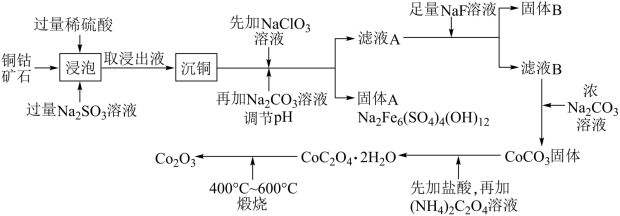
已知:铜钴矿石主要含有 ,其中还含有一定量的
,其中还含有一定量的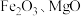 和
和 等。请回答下列问题:
等。请回答下列问题:
(1) 元素的价层电子排布式是
元素的价层电子排布式是___________ ,铁、钴均为第四周期第Ⅷ族元素, 和
和 的第三电离能
的第三电离能
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)“浸泡”过程中,加入 溶液的主要作用是
溶液的主要作用是___________ 。
(3)向“沉铜”后的滤液中加入 溶液,写出滤液中的金属离子与
溶液,写出滤液中的金属离子与 反应的离子方程式:
反应的离子方程式:___________ 。
(4)过滤出的 固体经洗涤后,证明固体已洗净的操作是
固体经洗涤后,证明固体已洗净的操作是___________ 。
(5) 在空气中高温煅烧得到
在空气中高温煅烧得到 的化学方程式是
的化学方程式是___________ 。
(6)一定温度下,向滤液 中加入足量的
中加入足量的 溶液可将
溶液可将 沉淀而除去,若所得滤液
沉淀而除去,若所得滤液 中
中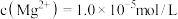 ,则滤液
,则滤液 中
中 为
为___________ [已知该温度下 ,
, ]。
]。
 的工艺流程如图所示:
的工艺流程如图所示:
已知:铜钴矿石主要含有
 ,其中还含有一定量的
,其中还含有一定量的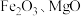 和
和 等。请回答下列问题:
等。请回答下列问题:(1)
 元素的价层电子排布式是
元素的价层电子排布式是 和
和 的第三电离能
的第三电离能
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)“浸泡”过程中,加入
 溶液的主要作用是
溶液的主要作用是(3)向“沉铜”后的滤液中加入
 溶液,写出滤液中的金属离子与
溶液,写出滤液中的金属离子与 反应的离子方程式:
反应的离子方程式:(4)过滤出的
 固体经洗涤后,证明固体已洗净的操作是
固体经洗涤后,证明固体已洗净的操作是(5)
 在空气中高温煅烧得到
在空气中高温煅烧得到 的化学方程式是
的化学方程式是(6)一定温度下,向滤液
 中加入足量的
中加入足量的 溶液可将
溶液可将 沉淀而除去,若所得滤液
沉淀而除去,若所得滤液 中
中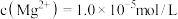 ,则滤液
,则滤液 中
中 为
为 ,
, ]。
]。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】微量元素硼(B)对人体健康有着十分重要的作用,其化合物也应用广泛。请回答下列问题:
(1)B的核外电子排布式为___ ,其第一电离能比Be___ (填“大”或“小”)。
(2)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。NH3BH3分子中,N—B键是配位键,其空轨道由___ 提供(填元素符号)。写出一种与氨硼烷互为等电子体的分子___ (填分子式)。
(3)硼酸晶体是片层结构,图甲中表示的是其中一层的结构,每一层内存在的作用力有___ 。
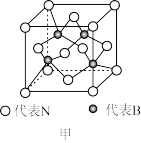
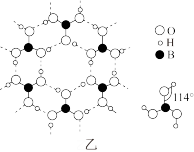
(4)①乙硼烷(B2H6)具有强还原性,它和氢化锂反应生成硼氢化锂(LiBH4),硼氢化锂常用于有机合成。LiBH4由Li+和BH 构成,BH
构成,BH 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为___ ,BH 的空间构型为
的空间构型为___ 。
②B的三卤化物熔点如表所示,自BF3至BI3熔点依次升高的原因是___ 。
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图乙所示。立方氮化硼属于___ 晶体,其中氮原子的配位数为___ 。已知:立方氮化硼密度为ρg·cm-3,B原子半径为anm,N原子半径为bnm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为___ (用含字母的代数式表示)。
(1)B的核外电子排布式为
(2)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。NH3BH3分子中,N—B键是配位键,其空轨道由
(3)硼酸晶体是片层结构,图甲中表示的是其中一层的结构,每一层内存在的作用力有


(4)①乙硼烷(B2H6)具有强还原性,它和氢化锂反应生成硼氢化锂(LiBH4),硼氢化锂常用于有机合成。LiBH4由Li+和BH
 构成,BH
构成,BH 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为 的空间构型为
的空间构型为②B的三卤化物熔点如表所示,自BF3至BI3熔点依次升高的原因是
| 化合物 | BF3 | BCl3 | BBr3 | BI3 |
| 熔点/℃ | -126.8 | -107.3 | -46 | 44.9 |
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图乙所示。立方氮化硼属于
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】ZnO在化学工业中主要用作橡胶和颜料的添加剂,医药上用于制软膏、橡皮膏等。工业上可由菱锌矿(主要成分为ZnCO3,还含有Ni、Cd、Fe、Mn等元素)制备。工艺如图所示:
已知:①“溶浸”后的溶液中金属离子主要有:Zn2+、Fe2+、Cd2+、Mn2+、Ni2+。
②弱酸性溶液中KMnO4能将Mn2+氧化生成MnO2。
③氧化性顺序:Ni2+>Cd2+>Zn2+。
(1)基态Zn原子的核外电子排布式为___________ ,铁在元素周期表中的位置为___________ ,Ni2+和Fe2+可形成如图所示的配合物离子,其中铁的一个配体为茂环阴离子(C5H ),该配体以π电子参与配位,配合物离子中与铁形成配位键的电子共有
),该配体以π电子参与配位,配合物离子中与铁形成配位键的电子共有___________ 个,S元素的杂化方式为___________ 。 ”是向“溶浸”后的溶液中加入少量
”是向“溶浸”后的溶液中加入少量___________ (填化学式)调节至弱酸性(pH为5.5)。此时溶液中 的最大浓度是
的最大浓度是___________ 。
(3)加 “氧化除杂”发生反应的离子方程式分别是
“氧化除杂”发生反应的离子方程式分别是 和
和___________ 。
(4)“还原除杂”除去的离子是___________ 。
(5)生成碱式碳酸锌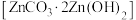 沉淀,写出该步骤的离子方程式
沉淀,写出该步骤的离子方程式___________ 。碱式碳酸锌灼烧后得到ZnO,ZnO的一种晶体的晶胞是立方晶胞(如图所示),晶胞参数为apm,该晶胞的密度为___________ g/cm3,请在图中画出该晶胞沿 轴方向的平面投影图
轴方向的平面投影图___________ 。

| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ | Mn2+ | Ni2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.0 | 7.4 | 8.1 | 6.9 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.0 | 9.4 | 10.1 | 8.9 |
②弱酸性溶液中KMnO4能将Mn2+氧化生成MnO2。
③氧化性顺序:Ni2+>Cd2+>Zn2+。
(1)基态Zn原子的核外电子排布式为
 ),该配体以π电子参与配位,配合物离子中与铁形成配位键的电子共有
),该配体以π电子参与配位,配合物离子中与铁形成配位键的电子共有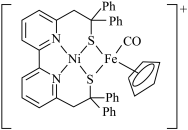
 ”是向“溶浸”后的溶液中加入少量
”是向“溶浸”后的溶液中加入少量 的最大浓度是
的最大浓度是(3)加
 “氧化除杂”发生反应的离子方程式分别是
“氧化除杂”发生反应的离子方程式分别是 和
和(4)“还原除杂”除去的离子是
(5)生成碱式碳酸锌
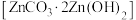 沉淀,写出该步骤的离子方程式
沉淀,写出该步骤的离子方程式 轴方向的平面投影图
轴方向的平面投影图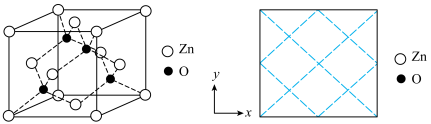
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】硼化物在生产、生活和科研中应用广泛。回答下列问题:
(1)立方氮化硼硬度大,熔点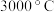 ,其晶体类型为
,其晶体类型为___________ 。
制备氮化硼( )的一种方法为
)的一种方法为 。
。 的空间构型为
的空间构型为___________ ,形成 时,基态B原子价电子层上的电子先进行激发,再进行杂化,激发时B原子的价电子轨道表示式可能为
时,基态B原子价电子层上的电子先进行激发,再进行杂化,激发时B原子的价电子轨道表示式可能为___________ (填标号)。 的球棍模型如图1所示。其中B原子的杂化方式有
的球棍模型如图1所示。其中B原子的杂化方式有___________ ,该阴离子中所存在的化学键类型有___________ (填标号)。
(3) 与B组成的金属硼化物结构如图2所示,硼原子全部组成
与B组成的金属硼化物结构如图2所示,硼原子全部组成 正八面体,各个顶点通过
正八面体,各个顶点通过 键互相连接成三维骨架,具有立方晶系的对称性。该晶体的化学式为
键互相连接成三维骨架,具有立方晶系的对称性。该晶体的化学式为___________ ,晶体中 原子的配位数为
原子的配位数为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如M点原子的分数坐标为 ,已知
,已知 八面体中
八面体中 键的键长为
键的键长为 ,晶胞参数为
,晶胞参数为 ,
, 为阿伏加德罗常数的值,则N点原子的分数坐标为
为阿伏加德罗常数的值,则N点原子的分数坐标为___________ ,该金属硼化物的密度为___________  (列出计算式即可)。
(列出计算式即可)。
(1)立方氮化硼硬度大,熔点
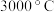 ,其晶体类型为
,其晶体类型为制备氮化硼(
 )的一种方法为
)的一种方法为 。
。 的空间构型为
的空间构型为 时,基态B原子价电子层上的电子先进行激发,再进行杂化,激发时B原子的价电子轨道表示式可能为
时,基态B原子价电子层上的电子先进行激发,再进行杂化,激发时B原子的价电子轨道表示式可能为A. 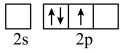 B.
B. 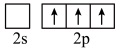 C.
C. 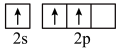 D.
D.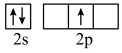
 的球棍模型如图1所示。其中B原子的杂化方式有
的球棍模型如图1所示。其中B原子的杂化方式有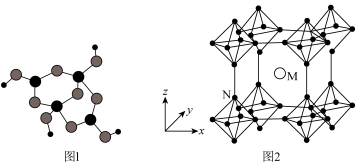
(3)
 与B组成的金属硼化物结构如图2所示,硼原子全部组成
与B组成的金属硼化物结构如图2所示,硼原子全部组成 正八面体,各个顶点通过
正八面体,各个顶点通过 键互相连接成三维骨架,具有立方晶系的对称性。该晶体的化学式为
键互相连接成三维骨架,具有立方晶系的对称性。该晶体的化学式为 原子的配位数为
原子的配位数为 ,已知
,已知 八面体中
八面体中 键的键长为
键的键长为 ,晶胞参数为
,晶胞参数为 ,
, 为阿伏加德罗常数的值,则N点原子的分数坐标为
为阿伏加德罗常数的值,则N点原子的分数坐标为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】Co、Ni的化合物在生产生活中有着广泛的应用。
(1) 元素在周期表中的位置是4周期,
元素在周期表中的位置是4周期,_________ 族。基态Co原子的电子排布式为____________ 。
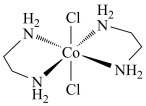
(2)乙二胺NH2-CH2-CH2-NH2(缩写符号en)中N原子的杂化方式为________ 杂化。en可以与Co形成配合物[Co(en)2Cl2]Cl·HCl·2H2O,配离子结构如下图所示,中心离子的配位数为________ ,配合物晶体中可能存在的作用力有___________ 。
A、离子键 B、极性共价键 C、非极性共价键 D、配位键 E、氢键
(3)NiO晶体结构如图1所示,其中离子坐标参数A为(0,0,0),B为(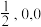 ),则C离子(面心处)坐标参数为
),则C离子(面心处)坐标参数为_______________ 。

(4)天然氧化镍晶体中总是存在晶体缺陷,如图2所示。NiXO晶体中x值为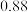 ,若晶体中的Ni分别为
,若晶体中的Ni分别为 、
、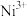 ,此晶体中
,此晶体中 与
与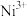 的最简整数比为
的最简整数比为______ 。
(1)
 元素在周期表中的位置是4周期,
元素在周期表中的位置是4周期,(2)乙二胺NH2-CH2-CH2-NH2(缩写符号en)中N原子的杂化方式为
A、离子键 B、极性共价键 C、非极性共价键 D、配位键 E、氢键

(3)NiO晶体结构如图1所示,其中离子坐标参数A为(0,0,0),B为(
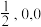 ),则C离子(面心处)坐标参数为
),则C离子(面心处)坐标参数为
(4)天然氧化镍晶体中总是存在晶体缺陷,如图2所示。NiXO晶体中x值为
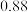 ,若晶体中的Ni分别为
,若晶体中的Ni分别为 、
、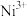 ,此晶体中
,此晶体中 与
与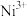 的最简整数比为
的最简整数比为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】钴及其化合物有重要的用途,探究其结构有重要意义。
(1)Co在元素周期表中属于_______ 区(填“d”或“ds”)。
(2)[Co(NH3)5Cl]Cl2是Co3+的一种重要配合物。
①该配合物的一种配体是NH3,NH3的空间结构呈_______ 形, 是_______ ( 填“极性”或“非极性”)分子。
②Co3+的价层电子轨道表示式是:
_______ 。该配合物中 Co3+参与杂化的6个能量相近的空轨道分别是2个3d轨道、1 个4s轨道和3个_______ 轨道。
③涉及实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。实验如下:称取2.51 g该配合物,先加水溶解,再加足量AgNO3溶液,_______ (补全实验操作和数据)。相对分子质量 [Co(NH3)5Cl]Cl2 250.5 AgCl 143.5
(3)某一种氮化硼晶体的立方晶胞结构如下图:

①氮化硼(BN)属于_______ 晶体。
②该种氮化硼的熔点和硬度均高于SiC的原因是:_______ 。
③已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA,则晶胞的边长为_______ cm (列计算式)。
(1)Co在元素周期表中属于
(2)[Co(NH3)5Cl]Cl2是Co3+的一种重要配合物。
①该配合物的一种配体是NH3,NH3的空间结构呈
②Co3+的价层电子轨道表示式是:

③涉及实验证实该配合物溶于水时,离子键发生断裂,配位键没有断裂。实验如下:称取2.51 g该配合物,先加水溶解,再加足量AgNO3溶液,
(3)某一种氮化硼晶体的立方晶胞结构如下图:

①氮化硼(BN)属于
②该种氮化硼的熔点和硬度均高于SiC的原因是:
③已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA,则晶胞的边长为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】利用 (铁氰化钾)可灵敏检验出溶液中的
(铁氰化钾)可灵敏检验出溶液中的 ,产生特征的蓝色沉淀
,产生特征的蓝色沉淀 (滕氏蓝),历史上曾作为颜料而被广泛研究,回答下列问题:
(滕氏蓝),历史上曾作为颜料而被广泛研究,回答下列问题:
(1)基态Fe的简化电子排布式为_______ ,基态 、
、 中未成对电子数之比为
中未成对电子数之比为_______ 。
(2)已知 和
和 均可与
均可与 形成配离子
形成配离子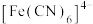 和
和 ,在酸性溶液中
,在酸性溶液中 可使
可使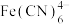 转化为
转化为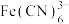 ,写出以上转化的离子方程式
,写出以上转化的离子方程式_______ 。
(3) 中
中 键与
键与 键的个数比为
键的个数比为_______ 。
(4)滕氏蓝晶体的微观结构如图所示。_______ 。
②图2为滕氏蓝的晶胞结构,晶胞中与1个 等距且最近的
等距且最近的 的数目为
的数目为_______ ;以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如A原子的坐标参数为(0,0,0),则C处 的坐标为
的坐标为_______ ,晶胞中 与
与 的核间距为anm,该晶胞密度为
的核间距为anm,该晶胞密度为_______  (列出计算式即可,已知
(列出计算式即可,已知 的摩尔质量为
的摩尔质量为 )。
)。
 (铁氰化钾)可灵敏检验出溶液中的
(铁氰化钾)可灵敏检验出溶液中的 ,产生特征的蓝色沉淀
,产生特征的蓝色沉淀 (滕氏蓝),历史上曾作为颜料而被广泛研究,回答下列问题:
(滕氏蓝),历史上曾作为颜料而被广泛研究,回答下列问题:(1)基态Fe的简化电子排布式为
 、
、 中未成对电子数之比为
中未成对电子数之比为(2)已知
 和
和 均可与
均可与 形成配离子
形成配离子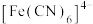 和
和 ,在酸性溶液中
,在酸性溶液中 可使
可使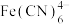 转化为
转化为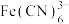 ,写出以上转化的离子方程式
,写出以上转化的离子方程式(3)
 中
中 键与
键与 键的个数比为
键的个数比为(4)滕氏蓝晶体的微观结构如图所示。

②图2为滕氏蓝的晶胞结构,晶胞中与1个
 等距且最近的
等距且最近的 的数目为
的数目为 的坐标为
的坐标为 与
与 的核间距为anm,该晶胞密度为
的核间距为anm,该晶胞密度为 (列出计算式即可,已知
(列出计算式即可,已知 的摩尔质量为
的摩尔质量为 )。
)。
您最近一年使用:0次



