煤和甲烷既是重要的常用燃料,又是重要的化工原料。根据题意,回答下列问题:
Ⅰ.煤制天然气过程中,存在多种化学反应,其中在煤气化装置中发生反应①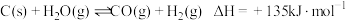 ,而在水气变换装置中发生反应②
,而在水气变换装置中发生反应②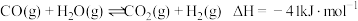 。
。
(1)煤气化前,需要通入一定量的氧气与碳发生燃烧反应,请利用平衡移动原理说明通入氧气的作用:_______ 。
(2)如图表示发生反应①后进入反应②装置的 与反应②中
与反应②中 平衡转化率、温度的变化关系。
平衡转化率、温度的变化关系。
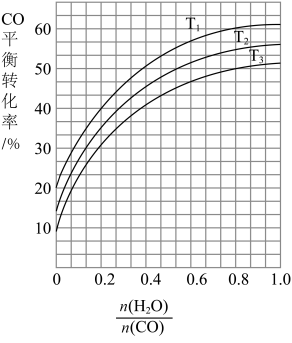
若 为0.8,一定量的煤和水蒸气经反应①和反应②后,得到
为0.8,一定量的煤和水蒸气经反应①和反应②后,得到 与
与 的物质的量之比为1∶3,则反应②所对应的温度是
的物质的量之比为1∶3,则反应②所对应的温度是_______ (填“ ”“
”“ ”或“
”或“ ”)。
”)。
Ⅱ.甲烷重整技术主要是利用甲烷和其他原料来制备合成气( 和
和 的混合气体)。现在常见的重整技术有甲烷—二氧化碳重整、甲烷—水蒸气重整,其反应分别为
的混合气体)。现在常见的重整技术有甲烷—二氧化碳重整、甲烷—水蒸气重整,其反应分别为 、
、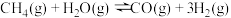 。
。
(3)通过计算机模拟甲烷—水蒸气重整实验测得,在操作压强为 、水碳比
、水碳比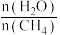 为1.0、温度为
为1.0、温度为 ,反应达到平衡时,
,反应达到平衡时, 的物质的量分数为0.6,已知该反应的速率方程
的物质的量分数为0.6,已知该反应的速率方程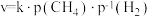 ,式中k为速率常数,p为气体分压(气体分压=总压×气体物质的量分数),则此时该反应速率
,式中k为速率常数,p为气体分压(气体分压=总压×气体物质的量分数),则此时该反应速率
_______ (用含k的式子表示); 时,该反应的压强平衡常数
时,该反应的压强平衡常数
_______ (用平衡分压代替平衡浓度计算)。
Ⅰ.煤制天然气过程中,存在多种化学反应,其中在煤气化装置中发生反应①
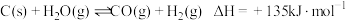 ,而在水气变换装置中发生反应②
,而在水气变换装置中发生反应②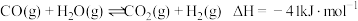 。
。(1)煤气化前,需要通入一定量的氧气与碳发生燃烧反应,请利用平衡移动原理说明通入氧气的作用:
(2)如图表示发生反应①后进入反应②装置的
 与反应②中
与反应②中 平衡转化率、温度的变化关系。
平衡转化率、温度的变化关系。
若
 为0.8,一定量的煤和水蒸气经反应①和反应②后,得到
为0.8,一定量的煤和水蒸气经反应①和反应②后,得到 与
与 的物质的量之比为1∶3,则反应②所对应的温度是
的物质的量之比为1∶3,则反应②所对应的温度是 ”“
”“ ”或“
”或“ ”)。
”)。Ⅱ.甲烷重整技术主要是利用甲烷和其他原料来制备合成气(
 和
和 的混合气体)。现在常见的重整技术有甲烷—二氧化碳重整、甲烷—水蒸气重整,其反应分别为
的混合气体)。现在常见的重整技术有甲烷—二氧化碳重整、甲烷—水蒸气重整,其反应分别为 、
、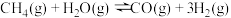 。
。(3)通过计算机模拟甲烷—水蒸气重整实验测得,在操作压强为
 、水碳比
、水碳比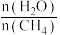 为1.0、温度为
为1.0、温度为 ,反应达到平衡时,
,反应达到平衡时, 的物质的量分数为0.6,已知该反应的速率方程
的物质的量分数为0.6,已知该反应的速率方程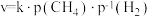 ,式中k为速率常数,p为气体分压(气体分压=总压×气体物质的量分数),则此时该反应速率
,式中k为速率常数,p为气体分压(气体分压=总压×气体物质的量分数),则此时该反应速率
 时,该反应的压强平衡常数
时,该反应的压强平衡常数
2023高三·全国·专题练习 查看更多[1]
(已下线)第七章 化学反应速率与化学平衡 第42练 化学平衡常数及转化率的计算
更新时间:2023-02-13 21:49:17
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
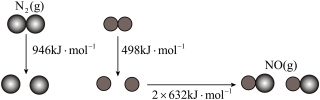
【推荐1】Ⅰ.汽车是重要的交通工具,随着汽车量的激增,汽车尾气造成的环境污染也日益严重。
(1)汽车尾气中 生成过程的能量变化如图所示,1mol
生成过程的能量变化如图所示,1mol 和1mol
和1mol 完全反应生成
完全反应生成 应
应_______ (填“吸收”或“释放”)_______ kJ能量。
(2)实验室在一恒容密闭容器中模拟汽车尾气 和
和 的转化,主要发生的反应是:
的转化,主要发生的反应是: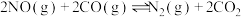
①下列方法能加快化学反应速率的是_______ (填标号)。
a.充入 b.升高温度 c.加入催化剂 d.及时分离出
b.升高温度 c.加入催化剂 d.及时分离出
②若容器为绝热容器,下列能说明反应达到平衡状态的是_______ (填标号)。
a.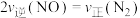 b.容器内的压强保持不变
b.容器内的压强保持不变
c.容器内混合气体密度保持不变 d.容器内温度不再变化
Ⅱ.由 制备甲醇(
制备甲醇( )是实现“双碳”目标的重要途径。已知:
)是实现“双碳”目标的重要途径。已知: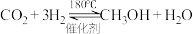 ,在体积为2L的密闭容器中,充入1mol
,在体积为2L的密闭容器中,充入1mol 催化剂和0.5mol
催化剂和0.5mol ,测得部分物质的物质的量随时间变化如下图所示:
,测得部分物质的物质的量随时间变化如下图所示:
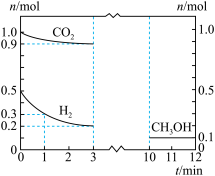
(3)0~1min内,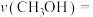
_______ (保留两位有效数字)。
(4)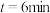 时,
时,
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
Ⅲ.煤燃烧排放的烟气中含有 和
和 ,会污染大气,形成酸雨。
,会污染大气,形成酸雨。
(5)将生石灰与含硫的煤混合后再燃烧,可将 最终转化为
最终转化为 ,写出
,写出 转化为
转化为 的化学方程式
的化学方程式_______ 。
(6)如图是利用原电池原理将 转化为
转化为 的示意图。
的示意图。
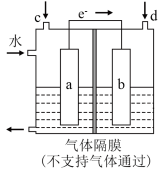
a电极为_______ (填“正极”或“负极”);d口通入的气体是_______ (填“ ”或“
”或“ ”)。
”)。
(1)汽车尾气中
 生成过程的能量变化如图所示,1mol
生成过程的能量变化如图所示,1mol 和1mol
和1mol 完全反应生成
完全反应生成 应
应
(2)实验室在一恒容密闭容器中模拟汽车尾气
 和
和 的转化,主要发生的反应是:
的转化,主要发生的反应是: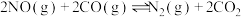
①下列方法能加快化学反应速率的是
a.充入
 b.升高温度 c.加入催化剂 d.及时分离出
b.升高温度 c.加入催化剂 d.及时分离出
②若容器为绝热容器,下列能说明反应达到平衡状态的是
a.
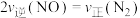 b.容器内的压强保持不变
b.容器内的压强保持不变c.容器内混合气体密度保持不变 d.容器内温度不再变化
Ⅱ.由
 制备甲醇(
制备甲醇( )是实现“双碳”目标的重要途径。已知:
)是实现“双碳”目标的重要途径。已知: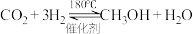 ,在体积为2L的密闭容器中,充入1mol
,在体积为2L的密闭容器中,充入1mol 催化剂和0.5mol
催化剂和0.5mol ,测得部分物质的物质的量随时间变化如下图所示:
,测得部分物质的物质的量随时间变化如下图所示:
(3)0~1min内,
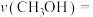
(4)
 时,
时,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。Ⅲ.煤燃烧排放的烟气中含有
 和
和 ,会污染大气,形成酸雨。
,会污染大气,形成酸雨。(5)将生石灰与含硫的煤混合后再燃烧,可将
 最终转化为
最终转化为 ,写出
,写出 转化为
转化为 的化学方程式
的化学方程式(6)如图是利用原电池原理将
 转化为
转化为 的示意图。
的示意图。
a电极为
 ”或“
”或“ ”)。
”)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】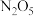 是硝酸的酸酐,溶于水生成
是硝酸的酸酐,溶于水生成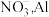 或
或 合金可用于还原脱除水体中的硝态氮
合金可用于还原脱除水体中的硝态氮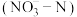 。完成下列填空:
。完成下列填空:
(1) 被
被 脱除,
脱除, 被还原成
被还原成 ,配平下列反应的离子方程式
,配平下列反应的离子方程式___________ 。
_______ _______
_______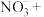 ________
________ ________
________ ________
________ ________
________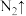
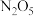 不稳定,时的分解方式如下:
不稳定,时的分解方式如下:
①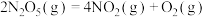
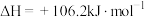 ;
;
②
 。
。
(2) 时,在一个容积不变的容器中加入
时,在一个容积不变的容器中加入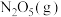 ,气体总浓度
,气体总浓度 与时间
与时间 的变化关系如下表所示:
的变化关系如下表所示:
①在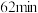 时,测得
时,测得 浓度为
浓度为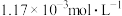 ,此时
,此时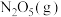 的浓度是
的浓度是___________  。反应达到平衡时,
。反应达到平衡时,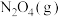 的浓度是
的浓度是___________  。
。
②若升温至 ,平衡时气体总浓度
,平衡时气体总浓度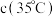
___________ 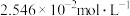 。
。
A.> B.= C.<
③已知:
___________ 。
④ 是一种高效清洁的火箭燃料。
是一种高效清洁的火箭燃料。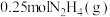 完全燃烧成
完全燃烧成 和
和 时,放出
时,放出 热量。请写出该反应的热化学方程式
热量。请写出该反应的热化学方程式___________ 。
(3)针对反应②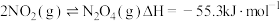 ,如图表示的
,如图表示的 的变化图。可见反应在
的变化图。可见反应在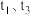 时都达到了平衡,而
时都达到了平衡,而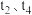 时都改变了个条件。
时都改变了个条件。
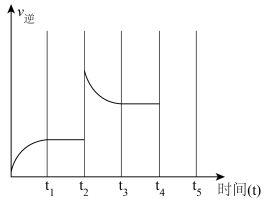
① 时扩大容器的体积,请在图中画出
时扩大容器的体积,请在图中画出 时逆反应的变化趋势
时逆反应的变化趋势___________ 。
②试判断 时可能改变的条件是
时可能改变的条件是___________ 。
(4)针对反应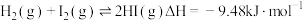
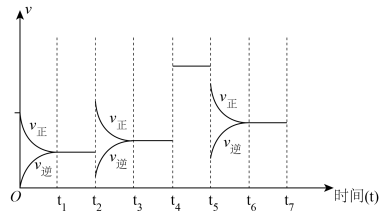
① 时可能改变的条件是
时可能改变的条件是___________ ;
② 时仅改变一个条件,可能是
时仅改变一个条件,可能是___________ 。
③ 时仅降低了反应的温度,可能原因是
时仅降低了反应的温度,可能原因是___________ 。
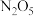 是硝酸的酸酐,溶于水生成
是硝酸的酸酐,溶于水生成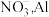 或
或 合金可用于还原脱除水体中的硝态氮
合金可用于还原脱除水体中的硝态氮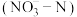 。完成下列填空:
。完成下列填空:(1)
 被
被 脱除,
脱除, 被还原成
被还原成 ,配平下列反应的离子方程式
,配平下列反应的离子方程式_______
 _______
_______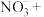 ________
________ ________
________ ________
________ ________
________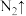
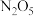 不稳定,时的分解方式如下:
不稳定,时的分解方式如下:①
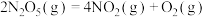
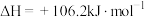 ;
;②

 。
。(2)
 时,在一个容积不变的容器中加入
时,在一个容积不变的容器中加入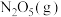 ,气体总浓度
,气体总浓度 与时间
与时间 的变化关系如下表所示:
的变化关系如下表所示: | 0 | 260 |  |
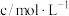 |  |  |  |
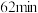 时,测得
时,测得 浓度为
浓度为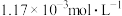 ,此时
,此时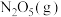 的浓度是
的浓度是 。反应达到平衡时,
。反应达到平衡时,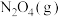 的浓度是
的浓度是 。
。②若升温至
 ,平衡时气体总浓度
,平衡时气体总浓度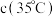
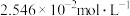 。
。A.> B.= C.<
③已知:

④
 是一种高效清洁的火箭燃料。
是一种高效清洁的火箭燃料。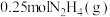 完全燃烧成
完全燃烧成 和
和 时,放出
时,放出 热量。请写出该反应的热化学方程式
热量。请写出该反应的热化学方程式(3)针对反应②
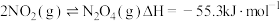 ,如图表示的
,如图表示的 的变化图。可见反应在
的变化图。可见反应在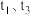 时都达到了平衡,而
时都达到了平衡,而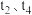 时都改变了个条件。
时都改变了个条件。
①
 时扩大容器的体积,请在图中画出
时扩大容器的体积,请在图中画出 时逆反应的变化趋势
时逆反应的变化趋势②试判断
 时可能改变的条件是
时可能改变的条件是(4)针对反应
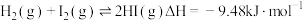

①
 时可能改变的条件是
时可能改变的条件是②
 时仅改变一个条件,可能是
时仅改变一个条件,可能是③
 时仅降低了反应的温度,可能原因是
时仅降低了反应的温度,可能原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01 mol・L-1、0.001 mol・L-1,催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.1 mol・L-1)的用量均为2 mL。
(1)配平化学方程式:KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O,_______ ;
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
(3)在完成探究催化剂对该反应速率影响的实验时发现,未加催化剂的情况下,刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
针对上述实验现象,同学认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快,从影响化学反应速率的因素看,你猜想还可能是因为_______ ,若用实验证明你的猜想。除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是_______ 。
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
(4)某同学对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时):
计算用0.001 mol・L-1KMnO4酸性溶液进行实验时KMnO4的平均反应速率_______ (忽略混合前后溶液体积的变化)。
(1)配平化学方程式:KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O,
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验 编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol・L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (I)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (II)实验①和③探究温度对该反应速率的影响; (III)实验①和④探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ | 298 | 0 | 0.01 |
针对上述实验现象,同学认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快,从影响化学反应速率的因素看,你猜想还可能是因为
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
(4)某同学对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| KMnO4酸性溶液 的浓度/mol・L-1 | 溶液褪色所需时间t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】CO用途广泛,工业应用时离不开平衡思想的指导:
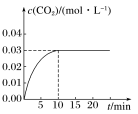
Ⅰ.在某一容积为5 L的体积不变的密闭容器内,加入0.3 mol 的CO和0.3 mol的H2O,在有催化剂存在和800 ℃的条件下加热,发生如下反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图:
(1)若保持温度和容器的体积不变,向上述平衡体系中,再充入0.3 mol的水蒸气,重新达到平衡后,H2O的转化率___________ (填“升高”“降低”或“不变”)。
(2)在催化剂存在和800 ℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09 mol·L-1;c(CO2)=c(H2)=0.13 mol·L-1,则此时正、逆反应速率的大小: 正
正 ___________  逆(填“>”“<”或“=”)。
逆(填“>”“<”或“=”)。
Ⅱ.还原法炼铅,包含反应PbO (s)+CO(g)=Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
(3)该反应的ΔH___________ 0(填“>”“<”或“=”)。
(4)当lg K=1,在恒容密闭容器中加入PbO并通入CO,达平衡时,混合气体中CO的体积分数为___________ (保留两位有效数字);若向容器中充入一定量的CO气体后,平衡发生移动,再次达到平衡时,CO的百分含量___________ (填“增大”“减小”或“不变”)。
Ⅰ.在某一容积为5 L的体积不变的密闭容器内,加入0.3 mol 的CO和0.3 mol的H2O,在有催化剂存在和800 ℃的条件下加热,发生如下反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图:

(1)若保持温度和容器的体积不变,向上述平衡体系中,再充入0.3 mol的水蒸气,重新达到平衡后,H2O的转化率
(2)在催化剂存在和800 ℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09 mol·L-1;c(CO2)=c(H2)=0.13 mol·L-1,则此时正、逆反应速率的大小:
 正
正  逆(填“>”“<”或“=”)。
逆(填“>”“<”或“=”)。Ⅱ.还原法炼铅,包含反应PbO (s)+CO(g)=Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
| 温度/℃ | 300 | 727 | 1 227 |
| lg K | 6.17 | 2.87 | 1.24 |
(4)当lg K=1,在恒容密闭容器中加入PbO并通入CO,达平衡时,混合气体中CO的体积分数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用。工业上以CO和H2为原料生产CH3OCH3和CO2的工艺主要发生三个反应:
① CO(g) + 2H2(g)⇌CH3OH(g) △H1=-91 kJ·mol-1
② 2CH3OH(g)⇌CH3OCH3(g)+ H2O(g) △H2=-24 kJ·mol-1
③ CO(g)+ H2O(g)⇌CO2(g) + H2(g) △H3=-41 kJ·mol-1
回答下列问题:
(1)该工艺生产CH3OCH3和CO2总反应的热化学方程式为:_________ 。
(2)一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是____ 。
A.低温高压 B.加催化剂 C.分离出二甲醚 D.增加H2浓度
(3)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图。
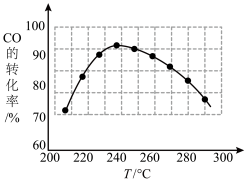
该条件下,温度为_______ 时最合适。高于此温度CO转化率会下降的原因是________ 。
(4)合成二甲醚还可以用另一反应:2CH3OH(g)⇌CH3OCH3(g) + H2O(g)。在某温度下,在1L密闭容器中加入CH3OH ,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
①该反应的平衡常数表达式为_______ 。请计算该温度的平衡常数值为_________ 。
②10 min内平均反应速率v(CH3OH) 为________ 。
① CO(g) + 2H2(g)⇌CH3OH(g) △H1=-91 kJ·mol-1
② 2CH3OH(g)⇌CH3OCH3(g)+ H2O(g) △H2=-24 kJ·mol-1
③ CO(g)+ H2O(g)⇌CO2(g) + H2(g) △H3=-41 kJ·mol-1
回答下列问题:
(1)该工艺生产CH3OCH3和CO2总反应的热化学方程式为:
(2)一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是
A.低温高压 B.加催化剂 C.分离出二甲醚 D.增加H2浓度
(3)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图。

该条件下,温度为
(4)合成二甲醚还可以用另一反应:2CH3OH(g)⇌CH3OCH3(g) + H2O(g)。在某温度下,在1L密闭容器中加入CH3OH ,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
| 物 质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol·L-1 | 0.01 | 0.2 | 0.2 |
②10 min内平均反应速率v(CH3OH) 为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
Ⅰ.用CO2生产甲醇
(1)已知:H2的燃烧热为-285.8kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,
CH3OH(g)=CH3OH(l) ΔH=-37.3kJ/mol
则CO2(g)+3H2(g) CH3OH(g)+H2O(l)ΔH=
CH3OH(g)+H2O(l)ΔH=__ kJ/mol。
(2)将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图1两条曲线分别表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系。

其中a点的平衡常数表达式为:__ 。
②a,b两点化学反应速率分别用Va、Vb表示,则Va__ Vb(填“大于”、“小于”或“等于”)。
(3)在1.0L恒容密闭容器中投入1molCO2和2.75molH2发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是__ 。
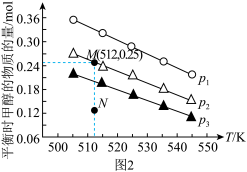
A.该反应的正反应为放热反应
B.压强大小关系为p1<p2<p3
C.M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.用CO生产甲醇
(4)已知:CO(g)+2H2(g) CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。
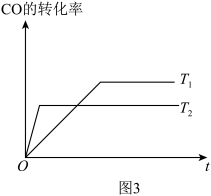
①该反应的焓变ΔH__ 0(填“ ”、“ ”或“ ”)。
②T1和T2温度下的平衡常数大小关系是K1___ K2(填“>”、“<”或“=”)。
Ⅲ.甲醇的应用
(5)甲醇制氢气。甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49kJ/mol。某温度下,将[n(H2O):n(CH3OH)]=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为___ 。
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图4所示。阳极的电极反应式为__ 。
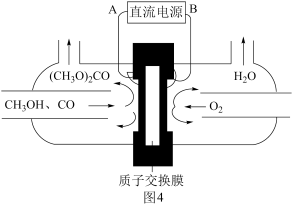
Ⅰ.用CO2生产甲醇
(1)已知:H2的燃烧热为-285.8kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,
CH3OH(g)=CH3OH(l) ΔH=-37.3kJ/mol
则CO2(g)+3H2(g)
 CH3OH(g)+H2O(l)ΔH=
CH3OH(g)+H2O(l)ΔH=(2)将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图1两条曲线分别表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系。

其中a点的平衡常数表达式为:
②a,b两点化学反应速率分别用Va、Vb表示,则Va
(3)在1.0L恒容密闭容器中投入1molCO2和2.75molH2发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是
A.该反应的正反应为放热反应
B.压强大小关系为p1<p2<p3
C.M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.用CO生产甲醇
(4)已知:CO(g)+2H2(g)
 CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图3是该反应在不同温度下CO的转化率随时间变化的曲线。
①该反应的焓变ΔH
②T1和T2温度下的平衡常数大小关系是K1
Ⅲ.甲醇的应用
(5)甲醇制氢气。甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49kJ/mol。某温度下,将[n(H2O):n(CH3OH)]=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图4所示。阳极的电极反应式为

您最近一年使用:0次



