稀土元素是指钪(Sc)、钇(Y)和镧系元素,共17种,位于元素周期表中第III B族,均为金属元素,在工业生产中有重要的作用。回答下列问题:
(1)基态钪( Sc)元素的原子核外电子占据的轨道数目共___________ 个 , 钇(Y)位于元素周期表中钪(Sc)的下一周期,钇( Y)的价电子排布式为___________ 。
(2)稀土元素常常能和许多配位体形成配合物。若一个配位体含有两个或两个以上的能提供孤电子对的原子,这种配位体就叫多齿配位体,有一个能提供孤电子对的原子为一齿,(羰基中的氧原子不能提供孤对电子),EDTA(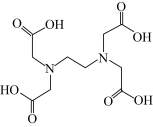 )是
)是___________ 齿配位体,它的配位原子为___________ ,其中 C原子的杂化方式为___________ 。
(3)钪(Sc)离子在水中以稳定对称的[ Sc(H2O)6]3+存在,其中O−Sc−O的键角只有90度和180度两种,其空间构型为___________ 。
(4)铈(Ce)属于镧系元素,氧化铈是一种重要的光催化材料。
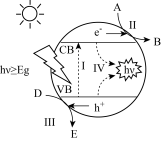
①铈具有三价和四价两种价态,三价和四价间的可逆转换会造成氧空位的生成和消除。其光催化的基本原理如下图所示,当光照能量( hv )等于或大于氧化铈催化剂的能量时,氧化铈VB上的电子(e-)会受到激发跃迁至CB,留下带正电荷的空穴(h+ ) ,形成光生电子−空穴对,与所吸附的物质发生氧化还原反应。则在氧化还原反应中,空穴可视为___________ (填“氧化剂”或“还原剂”),图中A发生___________ (填“氧化”或“还原”)反应。
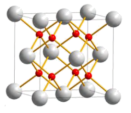
②氧化铈的晶体结构如下图所示,其中铈原子和氧原子的数量之比为___________ ,若 晶体密度为d g∙cm−3,阿伏加德罗常数为NA,晶胞参数a=___________ cm( 写出表达式)。
(1)基态钪( Sc)元素的原子核外电子占据的轨道数目共
(2)稀土元素常常能和许多配位体形成配合物。若一个配位体含有两个或两个以上的能提供孤电子对的原子,这种配位体就叫多齿配位体,有一个能提供孤电子对的原子为一齿,(羰基中的氧原子不能提供孤对电子),EDTA(
 )是
)是(3)钪(Sc)离子在水中以稳定对称的[ Sc(H2O)6]3+存在,其中O−Sc−O的键角只有90度和180度两种,其空间构型为
(4)铈(Ce)属于镧系元素,氧化铈是一种重要的光催化材料。
①铈具有三价和四价两种价态,三价和四价间的可逆转换会造成氧空位的生成和消除。其光催化的基本原理如下图所示,当光照能量( hv )等于或大于氧化铈催化剂的能量时,氧化铈VB上的电子(e-)会受到激发跃迁至CB,留下带正电荷的空穴(h+ ) ,形成光生电子−空穴对,与所吸附的物质发生氧化还原反应。则在氧化还原反应中,空穴可视为

②氧化铈的晶体结构如下图所示,其中铈原子和氧原子的数量之比为

2023·新疆·一模 查看更多[2]
更新时间:2023-03-13 14:35:38
|
相似题推荐
解答题-无机推断题
|
较易
(0.85)
【推荐1】某校化学社2019年1月3日一吨多重的嫦娥四号探测器首次实现人类飞行器在月球背面的软着陆,它所搭载的“玉兔二号”月球车通过砷化镓(GaAs)太阳能电池提供能量开展工作。
Ⅰ.如图是As、Ga等元素所在元素周期表中的一部分
(1)上表中,原子半径最小的是___________ 元素,元素周期表中砷的位置是___________
(2)GaN、GaAs、GaP都是良好的半导体材料,晶体类型与晶体硅相同,它们的熔点如下表:
解释它们熔点变化的原因___________
(3)亚磷酸(H3PO3)与NaOH反应只能生成Na2HPO3和NaH2PO3两种盐,这两种盐溶液均呈碱性。根据以上信息判断,亚磷酸应属于___________ 酸(几元+强\弱酸),Na2HPO3溶液中阴离子浓度由大到小的次序为___________
Ⅱ.现有W、X、Y、Z、Q、R六种短周期主族元素,它们的原子序数依次增大,Z与Q同主族,且Z的氢化物常温时为液态。W、X的最外层电子数之和与Y的最外层电子数相等,W分别与X、Y、Z形成电子总数相等的分子。
(4)写出XZ2的电子式___________ ,元素R在周期表中的位置___________ 。
(5)X、Z、Q元素的氢化物的沸点最低的是___________ (用化学式表示)。
(6)Y4气态分子结构如图所示,已知断裂1molY-Y吸收167kJ的热量,生成1molY≡Y放出942kJ热量。试写出由Y4气态分子变成Y2态分子的热化学方程式___________ 。
Ⅲ.下图是金字塔式元素周期表的一部分(元素周期表的另一种画法),图上标有第VIA族和几种元素的位置。请回答下列问题:
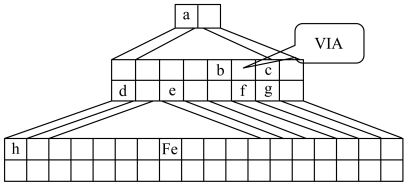
(7)请在上图中描出金属与非金属的分界线,并将铁元素所在族的位置全部涂黑___________ 。
(8)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第VIIA族,理由是:氢的最外层电子“饱和缺一”。请用电子式表示LiH:___________ 。
(9)下列叙述正确的是___________
A.f与d形成离子化合物为电解质,故该晶体能导电。
B.c、f、g电负性强弱顺序为:g>f>c。
C.第一电离能:f>g>h>d
D.c与h形成化合物的水溶液显中性。
E.硒化氢的稳定性强于f的氢化物的稳定性。
F.h的最高价氧化物对应的水化物是一种强碱。
Ⅰ.如图是As、Ga等元素所在元素周期表中的一部分
| Al | Si | P |
| Ga | Ge | As |
(1)上表中,原子半径最小的是
(2)GaN、GaAs、GaP都是良好的半导体材料,晶体类型与晶体硅相同,它们的熔点如下表:
| 晶体 | GaN | GaAs | GaP |
| 熔点/℃ | 1700 | 1238 | 1480 |
(3)亚磷酸(H3PO3)与NaOH反应只能生成Na2HPO3和NaH2PO3两种盐,这两种盐溶液均呈碱性。根据以上信息判断,亚磷酸应属于
Ⅱ.现有W、X、Y、Z、Q、R六种短周期主族元素,它们的原子序数依次增大,Z与Q同主族,且Z的氢化物常温时为液态。W、X的最外层电子数之和与Y的最外层电子数相等,W分别与X、Y、Z形成电子总数相等的分子。
(4)写出XZ2的电子式
(5)X、Z、Q元素的氢化物的沸点最低的是
(6)Y4气态分子结构如图所示,已知断裂1molY-Y吸收167kJ的热量,生成1molY≡Y放出942kJ热量。试写出由Y4气态分子变成Y2态分子的热化学方程式
Ⅲ.下图是金字塔式元素周期表的一部分(元素周期表的另一种画法),图上标有第VIA族和几种元素的位置。请回答下列问题:

(7)请在上图中描出金属与非金属的分界线,并将铁元素所在族的位置全部涂黑
(8)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第VIIA族,理由是:氢的最外层电子“饱和缺一”。请用电子式表示LiH:
(9)下列叙述正确的是
A.f与d形成离子化合物为电解质,故该晶体能导电。
B.c、f、g电负性强弱顺序为:g>f>c。
C.第一电离能:f>g>h>d
D.c与h形成化合物的水溶液显中性。
E.硒化氢的稳定性强于f的氢化物的稳定性。
F.h的最高价氧化物对应的水化物是一种强碱。
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】磷是人体含量较多的元素之一,磷的化合物在药物生产和农药制造等方面用途非常广泛。回答下列问题:
(1)基态磷原子的核外电子排布式为_______ 。
(2) 可用于制造火柴,其分子结构如图所示。
可用于制造火柴,其分子结构如图所示。_______ 硫;电负性:磷_______ 硫(填“>”或“<”,上同)。
② 分子中硫原子的杂化轨道类型为
分子中硫原子的杂化轨道类型为_______ 。
(3)如图为 晶胞,
晶胞, 的配位数为为
的配位数为为_______ ,该晶体的密度为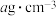 ,则晶胞的体积是
,则晶胞的体积是_______ (只要求列出算式)。
(1)基态磷原子的核外电子排布式为
(2)
 可用于制造火柴,其分子结构如图所示。
可用于制造火柴,其分子结构如图所示。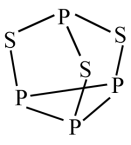
②
 分子中硫原子的杂化轨道类型为
分子中硫原子的杂化轨道类型为(3)如图为
 晶胞,
晶胞, 的配位数为为
的配位数为为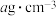 ,则晶胞的体积是
,则晶胞的体积是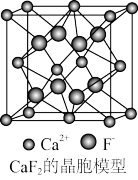
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】金属元素及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)锰元素在周期表中的位置是___ ,基态锰原子的最外层电子排布式为___ 。
(2)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220℃。Cr(CO)6的晶体类型是___ ,Cr(CO)6中σ键与π键的个数比为___ 。
(3)[Ag(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是___ 。
(4)多数配离子显示颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用∆表示),它与中心离子的结构、电荷、配体有关。试判断分裂能△[Fe(H2O)6]2+__ △[Fe(H2O)6]3+(填<”或“=”),理由___ 。
(5)已知Pb(CH2CH3)4晶体的堆积方式如图。
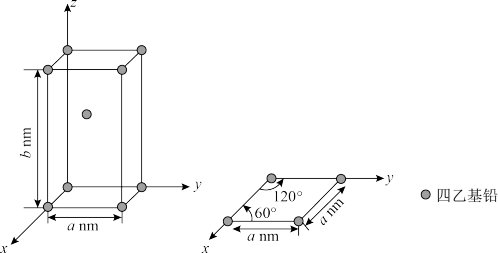
Pb(CH2CH3)4在晶体结构中的配位数是___ 。设阿伏加德罗常数为NAmol-1,Pb(CH2CH3)4的摩尔质量为Mg/mol,则Pb(CH2CH3)4晶体的密度是___ g/cm3(列出计算式即可)。
(1)锰元素在周期表中的位置是
(2)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220℃。Cr(CO)6的晶体类型是
(3)[Ag(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是
(4)多数配离子显示颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用∆表示),它与中心离子的结构、电荷、配体有关。试判断分裂能△[Fe(H2O)6]2+
(5)已知Pb(CH2CH3)4晶体的堆积方式如图。

Pb(CH2CH3)4在晶体结构中的配位数是
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐1】三明清流“天芳悦潭”温泉富含珍稀“锗”元素。其中锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等30多种对人体有益的微量元素。回答下列问题:
(1)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠: ;二锗酸钠:
;二锗酸钠: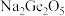 等),也能形成类似于烷烃的锗烷(
等),也能形成类似于烷烃的锗烷( )。
)。
① 中锗原子的杂化方式是
中锗原子的杂化方式是_______ 。
②推测1mol 中含有的σ键的数目是
中含有的σ键的数目是_______ (用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(2)利用离子液体 可电沉积还原金属Ge,其熔点只有7℃,其中
可电沉积还原金属Ge,其熔点只有7℃,其中 结构如图所示。
结构如图所示。

①该物质的晶体类型是_______ 。
② 中组成元素的电负性由小到大的顺序是
中组成元素的电负性由小到大的顺序是_______ 。
(3)独立的 分子中H−N−H的键角约为
分子中H−N−H的键角约为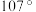 ,
, 中H−N−H的键角
中H−N−H的键角_______ 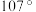 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
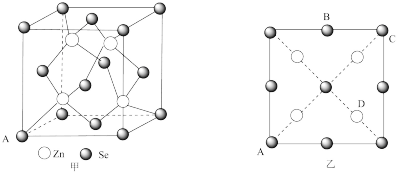
(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,该晶胞中硒原子的配位数是_______ ;已知晶胞边长为apm,乙图为甲图的俯视图,A点坐标为(0,0,0),B点坐标为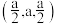 ,则D点坐标为
,则D点坐标为_______ ;若该晶胞密度为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值 为
为_______ (只列出计算式)。
(1)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠:
 ;二锗酸钠:
;二锗酸钠: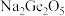 等),也能形成类似于烷烃的锗烷(
等),也能形成类似于烷烃的锗烷( )。
)。①
 中锗原子的杂化方式是
中锗原子的杂化方式是②推测1mol
 中含有的σ键的数目是
中含有的σ键的数目是 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。(2)利用离子液体
 可电沉积还原金属Ge,其熔点只有7℃,其中
可电沉积还原金属Ge,其熔点只有7℃,其中 结构如图所示。
结构如图所示。
①该物质的晶体类型是
②
 中组成元素的电负性由小到大的顺序是
中组成元素的电负性由小到大的顺序是(3)独立的
 分子中H−N−H的键角约为
分子中H−N−H的键角约为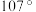 ,
, 中H−N−H的键角
中H−N−H的键角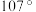 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,该晶胞中硒原子的配位数是
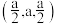 ,则D点坐标为
,则D点坐标为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值 为
为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐2】新冠肺炎疫情防控,消毒用品必不可少。试回答下列问题:
(1)过氧乙酸(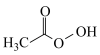 )也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有
)也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有___________ ,分子中 键和
键和 键的个数比为
键的个数比为___________ 。
(2)生活中常用的手消毒凝胶,其主要有效成分是三氮羟基二苯醚和乙醇,其中三氯羟基二苯醚是一种广谱抗菌剂,高效、安全。三氯羟基二苯醚的结构简式如图所示。

①组成三氯羟基二苯醚的四种元素H、C、O、Cl的电负性从大到小的顺序为___________ ;基态氯原子的价电子排布图为___________ ,最高能级的原子轨道电子云轮廓图形状为___________ 。
②三氯羟基二苯醚的熔点:55~57℃,沸点:120℃,常态为白色或灰白色晶状粉末,稍有酚臭味,不溶于水,易溶于碱液和有机溶剂,三氯羟基二苯醚属于___________ 晶体。
③乙醇与甲醚 的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是
的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是___________ 。
(3)Na、K等活泼金属在 中燃烧得到的
中燃烧得到的 、
、 具有强氧化性,也常做消毒剂。已知
具有强氧化性,也常做消毒剂。已知 的晶胞如图所示:
的晶胞如图所示:
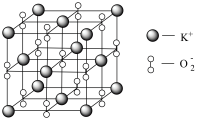
设阿伏加德罗常数的值为 ,晶胞的参数为a nm。晶胞的密度为
,晶胞的参数为a nm。晶胞的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
(1)过氧乙酸(
 )也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有
)也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有 键和
键和 键的个数比为
键的个数比为(2)生活中常用的手消毒凝胶,其主要有效成分是三氮羟基二苯醚和乙醇,其中三氯羟基二苯醚是一种广谱抗菌剂,高效、安全。三氯羟基二苯醚的结构简式如图所示。

①组成三氯羟基二苯醚的四种元素H、C、O、Cl的电负性从大到小的顺序为
②三氯羟基二苯醚的熔点:55~57℃,沸点:120℃,常态为白色或灰白色晶状粉末,稍有酚臭味,不溶于水,易溶于碱液和有机溶剂,三氯羟基二苯醚属于
③乙醇与甲醚
 的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是
的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是(3)Na、K等活泼金属在
 中燃烧得到的
中燃烧得到的 、
、 具有强氧化性,也常做消毒剂。已知
具有强氧化性,也常做消毒剂。已知 的晶胞如图所示:
的晶胞如图所示:
设阿伏加德罗常数的值为
 ,晶胞的参数为a nm。晶胞的密度为
,晶胞的参数为a nm。晶胞的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐3】(1)O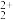 与N2互为等电子体, O22+的电子式可表示为
与N2互为等电子体, O22+的电子式可表示为_______ ; O22+中δ键数目和 键数目之比为
键数目之比为_______ 。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成红棕色沉淀Cu2C2。Cu+基态核外电子排布式为_______ ; Cu+的配位数为_______ 。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH—C≡N)。丙烯腈分子中碳原子轨道杂化类型是_______ 。
(4)在合成氨反应中,催化剂铁表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比为_______ 。

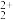 与N2互为等电子体, O22+的电子式可表示为
与N2互为等电子体, O22+的电子式可表示为 键数目之比为
键数目之比为(2)将乙炔通入[Cu(NH3)2]Cl溶液生成红棕色沉淀Cu2C2。Cu+基态核外电子排布式为
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH—C≡N)。丙烯腈分子中碳原子轨道杂化类型是
(4)在合成氨反应中,催化剂铁表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比为

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】材料是人类文明进步的阶梯,第ⅢA族、ⅣA族、VA族及Ⅷ族元素是组成特殊材料的重要元素。回答下列问题:
(1)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态氮原子的未成对电子数相同,则其基态原子的核外电子数为___________ 。
(2)经测定发现,N2O5固体由NO 和NO
和NO 两种离子组成,该固体中N原子杂化类型有
两种离子组成,该固体中N原子杂化类型有___________ 。
(3)K4[Fe(CN)6]溶液可以检验铁陨石中铁元素的价态。1mol K4[Fe(CN)6]含σ键的物质的量为___________ ,化合物K4[Fe(CN)6]中存在的作用力有___________ (填字母)。
a.离子键 b.极性键 c.非极性键 d.配位键 e.氢键
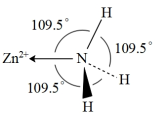
(4)NH3分子在独立存在时H−N−H键角为107°。如图是[Zn(NH3)6]2+离子的部分结构以及H−N−H键角的测量值。解释NH3形成如图配合物后H−N−H键角变大的原因:___________ 。
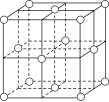
(5)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中位置如图所示,其堆积方式为___________ (填“简单立方”、“体心立方”、“六方最密”或“面心立方最密”)Li+占据阴离子组成的所有正四面体中心,该化合物的化学式为___________ (用最简整数比表示)。假设晶胞边长为anm,NA代表阿伏加德罗常数的值,则该晶胞的密度为___________ g/cm3。
(1)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态氮原子的未成对电子数相同,则其基态原子的核外电子数为
(2)经测定发现,N2O5固体由NO
 和NO
和NO 两种离子组成,该固体中N原子杂化类型有
两种离子组成,该固体中N原子杂化类型有(3)K4[Fe(CN)6]溶液可以检验铁陨石中铁元素的价态。1mol K4[Fe(CN)6]含σ键的物质的量为
a.离子键 b.极性键 c.非极性键 d.配位键 e.氢键
(4)NH3分子在独立存在时H−N−H键角为107°。如图是[Zn(NH3)6]2+离子的部分结构以及H−N−H键角的测量值。解释NH3形成如图配合物后H−N−H键角变大的原因:

(5)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中位置如图所示,其堆积方式为

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】硼单质及其化合物有重要的应用。阅读下列材料,回答问题:
硼晶体熔点为2076℃。乙硼烷(B2H6)具有还原性,易水解生成 (一元弱酸);乙硼烷可与
(一元弱酸);乙硼烷可与 反应生成氨硼烷(
反应生成氨硼烷( ,其在一定条件下可以脱氢,最终得到氮化硼;乙硼烷也可与NaH反应生成
,其在一定条件下可以脱氢,最终得到氮化硼;乙硼烷也可与NaH反应生成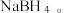
(1)下列说法正确的是_______(填字母)。
(2)根据对角线规则,B的一些化学性质与元素_______ 的相似;B 的空间结构是
的空间结构是_______ 。
(3)硼酸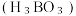 是一种片层状结构的白色晶体(如图),有油腻感,可做润滑剂。
是一种片层状结构的白色晶体(如图),有油腻感,可做润滑剂。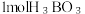 晶体中含有
晶体中含有_______ mol氢键;加热时,硼酸在水中溶解度增大,从结构角度分析,可能的原因为_______ 。
② 与NaOH溶液反应可以制备硼砂
与NaOH溶液反应可以制备硼砂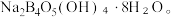 常温下,
常温下, 可以水解生成等物质的量浓度的
可以水解生成等物质的量浓度的 和
和 该水解反应的离子方程式为
该水解反应的离子方程式为_______ 。
(4)氮化硼(BN)晶体有多种相结构。一种立方BN晶体与金刚石结构相似,其晶胞结构如图: 则晶胞中含有BN的个数为
则晶胞中含有BN的个数为_______ (列出计算式,阿伏加德罗常数的数值为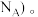
硼晶体熔点为2076℃。乙硼烷(B2H6)具有还原性,易水解生成
 (一元弱酸);乙硼烷可与
(一元弱酸);乙硼烷可与 反应生成氨硼烷(
反应生成氨硼烷( ,其在一定条件下可以脱氢,最终得到氮化硼;乙硼烷也可与NaH反应生成
,其在一定条件下可以脱氢,最终得到氮化硼;乙硼烷也可与NaH反应生成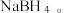
(1)下列说法正确的是_______(填字母)。
| A.元素的电负性大小顺序是O>N>B>H |
B.乙硼烷水解方程式为 |
| C.氨硼烷分子中N提供孤电子对,B提供空轨道形成配位键 |
D.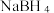 晶体中存在的相互作用有离子键、共价键、氢键 晶体中存在的相互作用有离子键、共价键、氢键 |
 的空间结构是
的空间结构是(3)硼酸
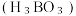 是一种片层状结构的白色晶体(如图),有油腻感,可做润滑剂。
是一种片层状结构的白色晶体(如图),有油腻感,可做润滑剂。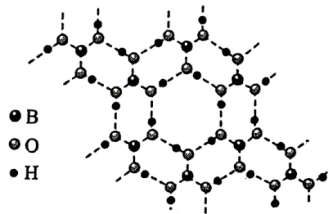
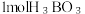 晶体中含有
晶体中含有②
 与NaOH溶液反应可以制备硼砂
与NaOH溶液反应可以制备硼砂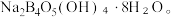 常温下,
常温下, 可以水解生成等物质的量浓度的
可以水解生成等物质的量浓度的 和
和 该水解反应的离子方程式为
该水解反应的离子方程式为(4)氮化硼(BN)晶体有多种相结构。一种立方BN晶体与金刚石结构相似,其晶胞结构如图:
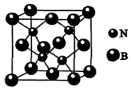
 则晶胞中含有BN的个数为
则晶胞中含有BN的个数为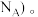
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐3】新材料的研制与应用是科技发展的主要方向之一,下列按提供信息填空:
(1)某太阳能吸热涂层以镍为吸收剂,镍(Ni)原子在周期表中的位置______ 。
(2)有机太阳能固体电池材料含有高纯度C60,C60的晶胞与干冰的晶胞相似,C60能溶于二硫化碳而不溶于水的原因是______ 。
(3)航母螺旋桨主要用铜合金制造。含铜废液可以利用铜萃取剂M,通过如图反应实现铜离子的富集,进行回收。
Cu2++2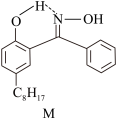

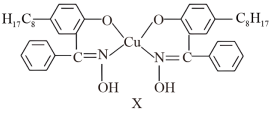 +2H+
+2H+
①上述物质M中含有的作用力有______ 。
A.离子键 B.金属键 C.共价键 D.氢键 E.配位键
②X难溶于水、易溶于有机溶剂,则X晶体中铜元素与氮原子之间的共价键类型为______ 。
(4)我国首艘国产航母的成功下水,标志着我国自主设计建造航空母舰取得重大阶段性成果。航母舰艇底部涂有含Cu2O的防腐蚀涂料。已知Cu2O的晶胞结构如图1所示。
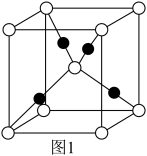
该晶胞结构中铜原子的配位数是______ 。
(5)CdSnAs2是一种高迁移率的新型热电材料,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图2所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如表所示。

找出距离Cd(0,0,0)最近的Sn______ (用分数坐标表示)。(写1个分数坐标即可)
(1)某太阳能吸热涂层以镍为吸收剂,镍(Ni)原子在周期表中的位置
(2)有机太阳能固体电池材料含有高纯度C60,C60的晶胞与干冰的晶胞相似,C60能溶于二硫化碳而不溶于水的原因是
(3)航母螺旋桨主要用铜合金制造。含铜废液可以利用铜萃取剂M,通过如图反应实现铜离子的富集,进行回收。
Cu2++2


 +2H+
+2H+①上述物质M中含有的作用力有
A.离子键 B.金属键 C.共价键 D.氢键 E.配位键
②X难溶于水、易溶于有机溶剂,则X晶体中铜元素与氮原子之间的共价键类型为
(4)我国首艘国产航母的成功下水,标志着我国自主设计建造航空母舰取得重大阶段性成果。航母舰艇底部涂有含Cu2O的防腐蚀涂料。已知Cu2O的晶胞结构如图1所示。

该晶胞结构中铜原子的配位数是
(5)CdSnAs2是一种高迁移率的新型热电材料,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图2所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如表所示。

| 坐标原子 | x | y | z |
| Cd | 0 | 0 | 0 |
| Sn | 0 | 0 | 0.5 |
| As | 0.25 | 0.25 | 0.125 |
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】回答下列问题:
(1) 常温下是一种无色气体,可与一定量的水形成
常温下是一种无色气体,可与一定量的水形成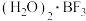 ,在一定条件下
,在一定条件下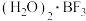 可发生如图所示转化:
可发生如图所示转化:

①H、O、B中电负性最强的元素是_______ ;基态B原子核外能量最高的电子,其电子云的轮廓图形状为_______ 。
②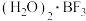 中含有的化学键为
中含有的化学键为_______ ; 与
与 形成
形成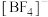 ,则
,则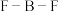 键的键角将变小,原因是
键的键角将变小,原因是_______ 。
(2)B可以与金属 形成
形成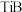 、
、 、
、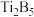 等多种硼化物,金属
等多种硼化物,金属 位于周期表中的位置为
位于周期表中的位置为_______ ,其基态原子的外围电子排布式为_______ 。
(3)三价B易形成 、
、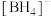 等配离子,
等配离子, 的空间立体构型为
的空间立体构型为_______ ,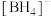 的一种阳离子等电子体为
的一种阳离子等电子体为_______ 。
(4)以天然硼砂为原料,经过一系列反应可以制得 :
:

请写出由 制得
制得 的化学方程式
的化学方程式_______ ; 有一种晶胞结构与金刚石的晶胞(如图)相似,称为立方
有一种晶胞结构与金刚石的晶胞(如图)相似,称为立方 ,可用作耐磨材料的新型无机材料。若晶胞的边长为
,可用作耐磨材料的新型无机材料。若晶胞的边长为 ,则晶胞的密度为
,则晶胞的密度为_______  (用含a、
(用含a、 的计算式表示)。
的计算式表示)。
(1)
 常温下是一种无色气体,可与一定量的水形成
常温下是一种无色气体,可与一定量的水形成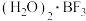 ,在一定条件下
,在一定条件下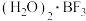 可发生如图所示转化:
可发生如图所示转化:
①H、O、B中电负性最强的元素是
②
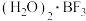 中含有的化学键为
中含有的化学键为 与
与 形成
形成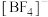 ,则
,则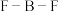 键的键角将变小,原因是
键的键角将变小,原因是(2)B可以与金属
 形成
形成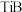 、
、 、
、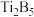 等多种硼化物,金属
等多种硼化物,金属 位于周期表中的位置为
位于周期表中的位置为(3)三价B易形成
 、
、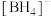 等配离子,
等配离子, 的空间立体构型为
的空间立体构型为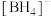 的一种阳离子等电子体为
的一种阳离子等电子体为(4)以天然硼砂为原料,经过一系列反应可以制得
 :
:
请写出由
 制得
制得 的化学方程式
的化学方程式 有一种晶胞结构与金刚石的晶胞(如图)相似,称为立方
有一种晶胞结构与金刚石的晶胞(如图)相似,称为立方 ,可用作耐磨材料的新型无机材料。若晶胞的边长为
,可用作耐磨材料的新型无机材料。若晶胞的边长为 ,则晶胞的密度为
,则晶胞的密度为 (用含a、
(用含a、 的计算式表示)。
的计算式表示)。
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】硼单质及其化合物有重要的应用。阅读下列材料,回答问题:
硼晶体熔点为2076℃。乙硼烷(B2H6)具有还原性,易水解生成 (一元弱酸);乙硼烷可与
(一元弱酸);乙硼烷可与 反应生成氨硼烷(
反应生成氨硼烷( ,其在一定条件下可以脱氢,最终得到氮化硼;乙硼烷也可与NaH反应生成
,其在一定条件下可以脱氢,最终得到氮化硼;乙硼烷也可与NaH反应生成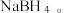
(1)下列说法正确的是_______(填字母)。
(2)根据对角线规则,B的一些化学性质与元素_______ 的相似;B 的空间结构是
的空间结构是_______ 。
(3)硼酸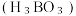 是一种片层状结构的白色晶体(如图),有油腻感,可做润滑剂。
是一种片层状结构的白色晶体(如图),有油腻感,可做润滑剂。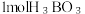 晶体中含有
晶体中含有_______ mol氢键;加热时,硼酸在水中溶解度增大,从结构角度分析,可能的原因为_______ 。
② 与NaOH溶液反应可以制备硼砂
与NaOH溶液反应可以制备硼砂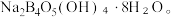 常温下,
常温下, 可以水解生成等物质的量浓度的
可以水解生成等物质的量浓度的 和
和 该水解反应的离子方程式为
该水解反应的离子方程式为_______ 。
(4)氮化硼(BN)晶体有多种相结构。一种立方BN晶体与金刚石结构相似,其晶胞结构如图: 则晶胞中含有BN的个数为
则晶胞中含有BN的个数为_______ (列出计算式,阿伏加德罗常数的数值为
硼晶体熔点为2076℃。乙硼烷(B2H6)具有还原性,易水解生成
 (一元弱酸);乙硼烷可与
(一元弱酸);乙硼烷可与 反应生成氨硼烷(
反应生成氨硼烷( ,其在一定条件下可以脱氢,最终得到氮化硼;乙硼烷也可与NaH反应生成
,其在一定条件下可以脱氢,最终得到氮化硼;乙硼烷也可与NaH反应生成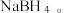
(1)下列说法正确的是_______(填字母)。
| A.元素的电负性大小顺序是O>N>B>H |
B.乙硼烷水解方程式为 |
| C.氨硼烷分子中N提供孤电子对,B提供空轨道形成配位键 |
D.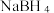 晶体中存在的相互作用有离子键、共价键、氢键 晶体中存在的相互作用有离子键、共价键、氢键 |
 的空间结构是
的空间结构是(3)硼酸
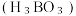 是一种片层状结构的白色晶体(如图),有油腻感,可做润滑剂。
是一种片层状结构的白色晶体(如图),有油腻感,可做润滑剂。
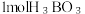 晶体中含有
晶体中含有②
 与NaOH溶液反应可以制备硼砂
与NaOH溶液反应可以制备硼砂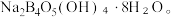 常温下,
常温下, 可以水解生成等物质的量浓度的
可以水解生成等物质的量浓度的 和
和 该水解反应的离子方程式为
该水解反应的离子方程式为(4)氮化硼(BN)晶体有多种相结构。一种立方BN晶体与金刚石结构相似,其晶胞结构如图:

 则晶胞中含有BN的个数为
则晶胞中含有BN的个数为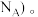
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
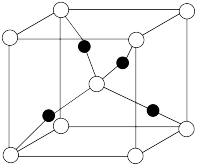
【推荐3】用 、
、 可以制备含有
可以制备含有 的
的 悬浊液,该悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米
悬浊液,该悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米 。
。
(1)基态 的核外电子排布式为
的核外电子排布式为__________ 。
(2)与 互为等电子体的一种分子为
互为等电子体的一种分子为________ (填化学式)。
(3) 与
与 反应能生成
反应能生成 ,
, 中的配位原子为
中的配位原子为________ (填元素符号)。
(4)乙醛( )中碳原子的轨道杂化类型是
)中碳原子的轨道杂化类型是_________ ;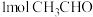 中含有
中含有 键的数目为
键的数目为________  。
。
(5)一个 晶胞(见图)中,
晶胞(见图)中, 原子的数目为
原子的数目为________ 。
 、
、 可以制备含有
可以制备含有 的
的 悬浊液,该悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米
悬浊液,该悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米 。
。
(1)基态
 的核外电子排布式为
的核外电子排布式为(2)与
 互为等电子体的一种分子为
互为等电子体的一种分子为(3)
 与
与 反应能生成
反应能生成 ,
, 中的配位原子为
中的配位原子为(4)乙醛(
 )中碳原子的轨道杂化类型是
)中碳原子的轨道杂化类型是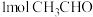 中含有
中含有 键的数目为
键的数目为 。
。(5)一个
 晶胞(见图)中,
晶胞(见图)中, 原子的数目为
原子的数目为
您最近一年使用:0次



