铁在史前就为人们所用。在人类文明发展过程中,铁所起的作用是其他任何元素都不能比拟的。请回答下列问题:
(1)基态铁原子中,价电子电子云的伸展方向有_______ 种。
(2)五羰基合铁[Fe(CO)5]分解制铁晶体,反应过程中断裂和形成的化学键有_________ ( 填序号);
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是___________________ 。
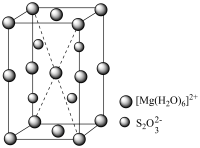
(3)绿矾(FeSO4·7H2O)结构如图。

①H2O分别与Fe2+、 的相互作用分别为
的相互作用分别为_______________ 、_____________ 。
②比较 中的键角∠O−S−O
中的键角∠O−S−O________ H2O中的键角∠H−O−H。 (填“<” “>”或“=”)
(4)铁的化合物种类众多,其中FeF3的熔点高于1000°C,而FeBr3的熔点只有200°C,原因是___________ 。
(5)铁的一种配位化合物(普鲁士蓝)中铁氰骨架结构如图(a)所所示,骨架为正六面体,K+位于骨架的正六面体的空穴中,以平衡铁氰骨架的负电荷,则该钾盐的化学式为_____________________ 。

(6)一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm=____________ cm3·mol−1 (已知阿伏加德罗常数为NA,晶体的摩尔体积是指单位物质的量晶体所占的体积)。
(1)基态铁原子中,价电子电子云的伸展方向有
(2)五羰基合铁[Fe(CO)5]分解制铁晶体,反应过程中断裂和形成的化学键有
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是
(3)绿矾(FeSO4·7H2O)结构如图。

①H2O分别与Fe2+、
 的相互作用分别为
的相互作用分别为②比较
 中的键角∠O−S−O
中的键角∠O−S−O(4)铁的化合物种类众多,其中FeF3的熔点高于1000°C,而FeBr3的熔点只有200°C,原因是
(5)铁的一种配位化合物(普鲁士蓝)中铁氰骨架结构如图(a)所所示,骨架为正六面体,K+位于骨架的正六面体的空穴中,以平衡铁氰骨架的负电荷,则该钾盐的化学式为

(6)一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm=
2023·陕西·模拟预测 查看更多[3]
(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)广东省深圳市龙华中学2022-2023学年高二下学期5月期中考试化学试题陕西省“高考研究831重点课题项目”联盟学校2023届高三第二次大联考理科综合化学试题
更新时间:2023-04-14 15:05:35
|
相似题推荐
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐1】X、Y、Z、W、R为原子序数依次增大的前四周期元素。基态X原子的价电子排布式为nsnnpn+1;Y的+2价阳离子核外电子排布与氖原子相同;Z元素的第一至第四电离能分别是:I1=578kJ∙mol-1、I2=1817kJ∙mol-1、I3=2745kJ∙mol-1、I4=11575kJ∙mol-1;W的最高正价与最低负价的代数和为6:基态R2+的M层有5个未成对电子。
回答下列问题:
(1)R元素在元素周期表中的位置为___________ ,原子序数比R少1的元素原子基态核外排布式为:___________ 。
(2)元素的气态原子得到一个电子所放出的能量称为第一电子亲合能。气态原子结合电子越容易,电子亲合能越大。X和W的第一电子亲合能X___________ W(填“>”或“<”),利用原子结构知识解释原因___________ 。
(3)X、Z、W的简单离子半径由大到小的顺序是___________ (填离子符号)。
(4)Z单质与NaOH反应的离子反应方程式为___________ 。
回答下列问题:
(1)R元素在元素周期表中的位置为
(2)元素的气态原子得到一个电子所放出的能量称为第一电子亲合能。气态原子结合电子越容易,电子亲合能越大。X和W的第一电子亲合能X
(3)X、Z、W的简单离子半径由大到小的顺序是
(4)Z单质与NaOH反应的离子反应方程式为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐2】由于铁氮化合物具有非常优异的磁性能、机械性能和耐腐蚀性,受到研究人员的广泛关注。γˊ−Fe4N是一种性能优异的铁氮化合物,其可由氨气与羰基铁粉[Fe(CO)5]反应得到。
(1)Fe变为Fe2+时是失去___________ 轨道电子,Fe3+价层电子排布图为___________ 。
(2)氨气中N的杂化类型是___________ ,NH3中H−N−H的键角比NH4+中H−N−H的键角___________ (填“大”或“小”),理由是___________ 。
(3) 与CO中均存在化学键的类型有
与CO中均存在化学键的类型有___________ (填标号)。
A.离子键 B.氢键 C.配位键 D.共价键 E.金属键
(4)羰基铁粉[Fe(CO)5]中铁元素的配位数是___________ ,配位原子为___________ 。
(5)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为___________ 。
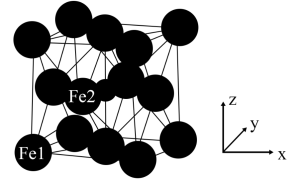
(6)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为( ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为___________ 。已知该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则晶胞参数a为___________ nm(用含d和NA的代数式表示)。
(1)Fe变为Fe2+时是失去
(2)氨气中N的杂化类型是
(3)
 与CO中均存在化学键的类型有
与CO中均存在化学键的类型有A.离子键 B.氢键 C.配位键 D.共价键 E.金属键
(4)羰基铁粉[Fe(CO)5]中铁元素的配位数是
(5)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为
(6)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为(
 ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐3】硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下: 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为_______ 。
(2) 的沸点低于
的沸点低于 ,其原因是
,其原因是_______ 。
(3)关于I~III三种反应物,下列说法正确的有_______ 。
A.I中仅有 键
键
B.I中的 键为非极性共价键
键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有 与
与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有_______ 。
(5)硒的两种含氧酸的酸性强弱为
_______  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为_______ 。
(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。_______ 。
②设X的最简式的式量为 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为_______  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下: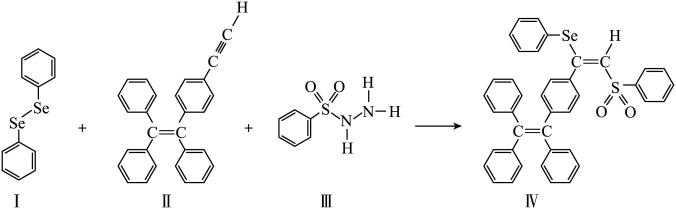
 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为(2)
 的沸点低于
的沸点低于 ,其原因是
,其原因是(3)关于I~III三种反应物,下列说法正确的有
A.I中仅有
 键
键B.I中的
 键为非极性共价键
键为非极性共价键C.II易溶于水
D.II中原子的杂化轨道类型只有
 与
与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有
(5)硒的两种含氧酸的酸性强弱为

 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
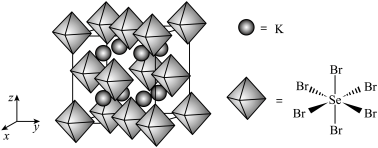
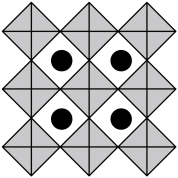
②设X的最简式的式量为
 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐1】A、B、C、D都是元素周期表中的短周期元素,它们的核电荷数依次增大.A是元素周期表中原子半径最小的元素,非金属元素B原子的核外电子数是未成对电子数的3倍,C原子的最外层p轨道的电子为半充满结构,D是地壳中含量最多的元素,E位于第4周期,其基态原子的内层轨道全部排满电子,且最外层电子数与A相同。回答下列问题:
⑴E的基态原子价电子排布图______ 。
⑵B、C、D的第一电离能由小到大的顺序为______ 。 用元素符号表示
用元素符号表示
⑶CA3物质能与很多化合物通过配位键发生相互作用,CA3与第2周期中的另一种元素的氢化物相互作用得到的化合物X是科学家潜心研究的一种储氢原料,X是乙烷的等电子体;加热X会缓慢释放H2,转变为化合物Y,Y是乙烯的等电子体。
 化合物CA3的分子空间构型为
化合物CA3的分子空间构型为 ______ ,X的结构式为 ______  必须标明配位键
必须标明配位键 。
。
 形成CA3物质的中心原子在X、Y分子中的杂化方式分别是
形成CA3物质的中心原子在X、Y分子中的杂化方式分别是 ___ ,Y分子中δ键和π键数目之比为 ____ 。
⑷E能与类卤素(SCN)2反应生成E(SCN)2,类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H—S—C N)的沸点低于异硫氰酸(H—N
N)的沸点低于异硫氰酸(H—N C
C S)的沸点,其原因是
S)的沸点,其原因是 ______ 。
⑴E的基态原子价电子排布图
⑵B、C、D的第一电离能由小到大的顺序为
 用元素符号表示
用元素符号表示
⑶CA3物质能与很多化合物通过配位键发生相互作用,CA3与第2周期中的另一种元素的氢化物相互作用得到的化合物X是科学家潜心研究的一种储氢原料,X是乙烷的等电子体;加热X会缓慢释放H2,转变为化合物Y,Y是乙烯的等电子体。
 化合物CA3的分子空间构型为
化合物CA3的分子空间构型为  必须标明配位键
必须标明配位键 。
。 形成CA3物质的中心原子在X、Y分子中的杂化方式分别是
形成CA3物质的中心原子在X、Y分子中的杂化方式分别是 ⑷E能与类卤素(SCN)2反应生成E(SCN)2,类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H—S—C
 N)的沸点低于异硫氰酸(H—N
N)的沸点低于异硫氰酸(H—N C
C S)的沸点,其原因是
S)的沸点,其原因是
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐2】X、Y、Z、W、Q是前四周期元素且原子序数依次增大。X的基态原子核外有8种运动状态不同的电子,Y的基态原子的逐级电离能如图1所示,Z的电负性在同周期元素中最大,W是第26号元素,Q是同周期主族元素中未成对电子最多的元素。
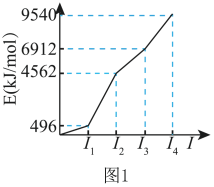
(1)W在周期表中的位置是________ ,W2+的价层电子排布式为________ 。
(2)Q的基态电子排布式为________ 。QZ3分子的空间构型为________ 。
(3)与X同周期且第一电离能大于X的元素有________ (填对应元素的符号,下同)。
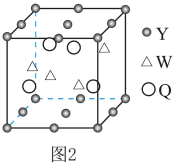
(4)如图2是某晶体的晶胞结构(W和Q均位于晶胞内部),该晶体的化学式为________ 。

(1)W在周期表中的位置是
(2)Q的基态电子排布式为
(3)与X同周期且第一电离能大于X的元素有
(4)如图2是某晶体的晶胞结构(W和Q均位于晶胞内部),该晶体的化学式为

您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】已知X、Y、Z、W、R是元素周期表前四周期中原子序数依次增大的常见元素,相关信息如下表:
(1)X基态原子中能量最高的电子,其电子云在空间有___________ 个方向,原子轨道呈___________ 形。
(2) 是动物和人体所必需的微量元素之一,也是重要的工业原料,与Y同族。Se的原子结构示意图为
是动物和人体所必需的微量元素之一,也是重要的工业原料,与Y同族。Se的原子结构示意图为___________ 。
(3)Z的基态原子的电子排布式为___________ 。
(4)H2Y的中心原子采取___________ 杂化,VSEPR模型为___________ ,分子构型为___________ 。
| 元素 | 相关信息 |
| X | 元素原子的核外p电子数比s电子数少1 |
| Y | 地壳中含量最多的元素 |
| Z | 第一电离能至第四电离能分别是: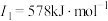 , , , ,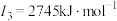 , ,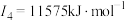 |
| W | 前四周期中电负性最小的元素 |
| R | 在周期表的第十一列 |
(2)
 是动物和人体所必需的微量元素之一,也是重要的工业原料,与Y同族。Se的原子结构示意图为
是动物和人体所必需的微量元素之一,也是重要的工业原料,与Y同族。Se的原子结构示意图为(3)Z的基态原子的电子排布式为
(4)H2Y的中心原子采取
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐1】回答下列小题:
(1)在四水合铜离子 中,配体是
中,配体是______ ;配位数是______ ;配位原子是______ ;该微粒中存在的化学键有______ 。
(2)有同学书写基态碳原子的核外电子排布图为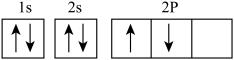 ,这样的书写不正确,违背了
,这样的书写不正确,违背了______ 。
(3) 是一种无色液体,沸点为43℃,熔点为
是一种无色液体,沸点为43℃,熔点为 ℃,
℃, 的晶体类型是
的晶体类型是______ 。
(4)氧化物MgO是优良的耐高温材料,其晶体结构与NaCl晶体相似,MgO的熔点比CaO的高,其原因是______ 。
(5)金刚石、石墨、 都是碳的同素异形体
都是碳的同素异形体
①石墨晶体存在作用力有______ 。
② 的熔点比金刚石、石墨熔点低的原因是
的熔点比金刚石、石墨熔点低的原因是______ 。
③石墨中碳原子的杂化轨道类型为______ ;碳原子和碳碳键的个数比是______ 。
(1)在四水合铜离子
 中,配体是
中,配体是(2)有同学书写基态碳原子的核外电子排布图为
 ,这样的书写不正确,违背了
,这样的书写不正确,违背了(3)
 是一种无色液体,沸点为43℃,熔点为
是一种无色液体,沸点为43℃,熔点为 ℃,
℃, 的晶体类型是
的晶体类型是(4)氧化物MgO是优良的耐高温材料,其晶体结构与NaCl晶体相似,MgO的熔点比CaO的高,其原因是
(5)金刚石、石墨、
 都是碳的同素异形体
都是碳的同素异形体①石墨晶体存在作用力有
②
 的熔点比金刚石、石墨熔点低的原因是
的熔点比金刚石、石墨熔点低的原因是③石墨中碳原子的杂化轨道类型为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐2】一种含Se的新型AIE分子(IV)的合成路线如图:_______ 。
(2)IV中具有孤电子对的原子有_______ 。
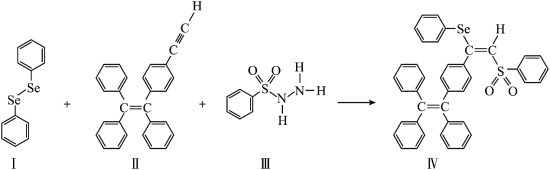
| A.I中仅有σ键 |
| B.I中的Se-Se为非极性共价键 |
| C.II易溶于水 |
| D.II中原子的杂化轨道类型只有sp、sp2、sp3 |
| A.C | B.O | C.S | D.Se |
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐3】含硅和硫元素的化合物种类繁多,应用广泛。请回答:
Ⅰ. 是生产多晶硅的副产物。
是生产多晶硅的副产物。
(1)基态硅原子的价层电子排布式为___________ 。
(2)已知 比
比 更易水解,导致
更易水解,导致 更易水解的因素有
更易水解的因素有___________ (填标号)。
a. 键极性更大 b.
键极性更大 b. 的原子半径更大
的原子半径更大
c. 键键能更大 d.
键键能更大 d. 有更多的价层轨道
有更多的价层轨道
Ⅱ.硫代硫酸盐可用在银盐照相中做定影液。
已知硫代硫酸根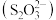 可看作是
可看作是 中的一个原子被
中的一个原子被 原子取代的产物。
原子取代的产物。
(3)基态 原子的价层电子排布式不能表示为
原子的价层电子排布式不能表示为 ,因为违背了
,因为违背了___________
(4)能确定晶体中各原子的位置(坐标),从而得出分子空间结构的一种方法是___________ 。
a.质谱法 b. 射线衍射 c.核磁共振氢谱 d.红外光谱
射线衍射 c.核磁共振氢谱 d.红外光谱
(5)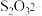 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成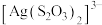 。分析判断
。分析判断 中的中心
中的中心 原子和端基
原子和端基 原子能否做配位原子并说明理由:
原子能否做配位原子并说明理由:___________ 。
(6)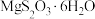 的晶胞如图,该晶胞中
的晶胞如图,该晶胞中 个数为
个数为___________ 。假设晶胞边长分别为 ,其摩尔质量为
,其摩尔质量为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,该晶体的密度为
,该晶体的密度为___________  (用相应字母表示)。
(用相应字母表示)。
Ⅰ.
 是生产多晶硅的副产物。
是生产多晶硅的副产物。(1)基态硅原子的价层电子排布式为
(2)已知
 比
比 更易水解,导致
更易水解,导致 更易水解的因素有
更易水解的因素有a.
 键极性更大 b.
键极性更大 b. 的原子半径更大
的原子半径更大c.
 键键能更大 d.
键键能更大 d. 有更多的价层轨道
有更多的价层轨道Ⅱ.硫代硫酸盐可用在银盐照相中做定影液。
已知硫代硫酸根
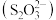 可看作是
可看作是 中的一个原子被
中的一个原子被 原子取代的产物。
原子取代的产物。(3)基态
 原子的价层电子排布式不能表示为
原子的价层电子排布式不能表示为 ,因为违背了
,因为违背了(4)能确定晶体中各原子的位置(坐标),从而得出分子空间结构的一种方法是
a.质谱法 b.
 射线衍射 c.核磁共振氢谱 d.红外光谱
射线衍射 c.核磁共振氢谱 d.红外光谱(5)
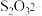 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成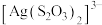 。分析判断
。分析判断 中的中心
中的中心 原子和端基
原子和端基 原子能否做配位原子并说明理由:
原子能否做配位原子并说明理由:(6)
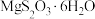 的晶胞如图,该晶胞中
的晶胞如图,该晶胞中 个数为
个数为 ,其摩尔质量为
,其摩尔质量为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,该晶体的密度为
,该晶体的密度为 (用相应字母表示)。
(用相应字母表示)。
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐1】Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)键角:
______ 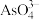 ,与
,与 互为等电子体的分子为
互为等电子体的分子为_______ (填化学式,任写一种即可)。
(2)浓磷酸在常温下呈粘稠状,原因_______ ,多聚磷酸由磷酸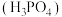 加热脱水缩合而成。链状多聚磷酸是多个磷酸通过脱水后共有部分氧原子连接起来的,多聚磷酸根离子的部分结构投影图如图所示(由于P、O原子的半径大小不同,投影图中P与O之间存在部分或全部遮掩关系),则其化学式为
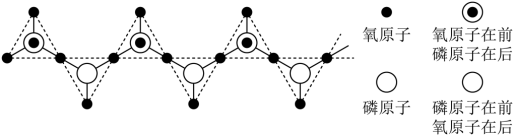
加热脱水缩合而成。链状多聚磷酸是多个磷酸通过脱水后共有部分氧原子连接起来的,多聚磷酸根离子的部分结构投影图如图所示(由于P、O原子的半径大小不同,投影图中P与O之间存在部分或全部遮掩关系),则其化学式为_______ 。
(3) 的晶胞结构示意图如(a)所示。其中О围绕Fe和Р分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有
的晶胞结构示意图如(a)所示。其中О围绕Fe和Р分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有 的单元数有
的单元数有_______ 个。
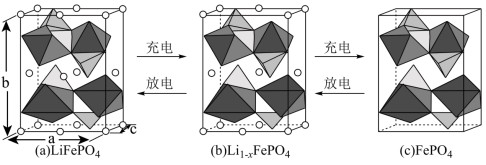
电池充电时, 脱出部分
脱出部分 ,形成
,形成 ,结构示意图如(b)所示,则x=
,结构示意图如(b)所示,则x=_______ ,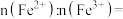
_______ 。
(1)键角:

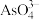 ,与
,与 互为等电子体的分子为
互为等电子体的分子为(2)浓磷酸在常温下呈粘稠状,原因
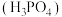 加热脱水缩合而成。链状多聚磷酸是多个磷酸通过脱水后共有部分氧原子连接起来的,多聚磷酸根离子的部分结构投影图如图所示(由于P、O原子的半径大小不同,投影图中P与O之间存在部分或全部遮掩关系),则其化学式为
加热脱水缩合而成。链状多聚磷酸是多个磷酸通过脱水后共有部分氧原子连接起来的,多聚磷酸根离子的部分结构投影图如图所示(由于P、O原子的半径大小不同,投影图中P与O之间存在部分或全部遮掩关系),则其化学式为
(3)
 的晶胞结构示意图如(a)所示。其中О围绕Fe和Р分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有
的晶胞结构示意图如(a)所示。其中О围绕Fe和Р分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有 的单元数有
的单元数有
电池充电时,
 脱出部分
脱出部分 ,形成
,形成 ,结构示意图如(b)所示,则x=
,结构示意图如(b)所示,则x=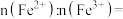
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】已发现的高温超导材料按成分分为含铜的和不含铜的。含铜超导材料有铋锶钙铜氧体系、铅锶钇铜氧体系等,不含铜超导体主要是钡镓铋氧体系等。回答下列问题:
(1)钇(Y)的原子序数比 大
大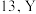 位于元素周期表的第
位于元素周期表的第___________ 族。
(2)基态铜原子的价电子排布式为___________ 。
(3)第一电离能: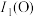
___________ (填“>”“<”或“=”)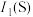 ,其原因是
,其原因是___________ 。
(4) 能与
能与 和
和 形成络合物
形成络合物 。键角:
。键角:
___________ (填“>”或“<”) ,
, 的配位数为
的配位数为___________ , 的空间构型为
的空间构型为___________ , 的杂化方式为
的杂化方式为___________ 。
(5)一种高温超导材料的晶胞结构如图所示,该立方晶胞参数为 。阿伏加德罗常数的值为NA。
。阿伏加德罗常数的值为NA。___________ 。
②晶体中与 最近且距离相等的
最近且距离相等的 有
有___________ 个。
③该晶体的密度为___________  。
。
(1)钇(Y)的原子序数比
 大
大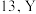 位于元素周期表的第
位于元素周期表的第(2)基态铜原子的价电子排布式为
(3)第一电离能:
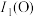
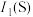 ,其原因是
,其原因是(4)
 能与
能与 和
和 形成络合物
形成络合物 。键角:
。键角:
 ,
, 的配位数为
的配位数为 的空间构型为
的空间构型为 的杂化方式为
的杂化方式为(5)一种高温超导材料的晶胞结构如图所示,该立方晶胞参数为
 。阿伏加德罗常数的值为NA。
。阿伏加德罗常数的值为NA。
②晶体中与
 最近且距离相等的
最近且距离相等的 有
有③该晶体的密度为
 。
。
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐3】配合物在许多尖端领域如激光材料、超导材料、抗癌药物、催化剂、自组装超分子等方面有广泛的应用。回答下列问题:
(1)Ni与CO形成的配合物Ni(CO)4为无色液体,易溶于CCl4、CS2等有机溶剂。碳原子的核外电子排布式为___________ 。CO的结构式为C≡O,则Ni(CO)4分子中σ键与π键个数之比为___________ 。
(2)胆矾溶于水后可得蓝色的水合铜离子,其中 的配位数是
的配位数是___________ 。胆矾晶体的结构如下图所示,其存在的化学键有___________ (填字母)。

A.离子键 B.极性键 C.范德华力 D.氢键 E.配位键
(3)金属Ni可以与Mg、C形成一种新型超导体,它的临界温度为8K,由C、Mg、Ni形成的某物质的晶胞为正六面体,结构如图所示。
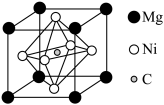
①该物质的化学式为___________ 。
②每个Mg原子距离最近的Ni原子的个数是___________ 。
③若用NA表示阿伏伽德罗常数的值,如果晶体的密度为ρg/cm3,则该晶胞的体积为___________ nm3(用含ρ、NA的代数式表示)。
(1)Ni与CO形成的配合物Ni(CO)4为无色液体,易溶于CCl4、CS2等有机溶剂。碳原子的核外电子排布式为
(2)胆矾溶于水后可得蓝色的水合铜离子,其中
 的配位数是
的配位数是
A.离子键 B.极性键 C.范德华力 D.氢键 E.配位键
(3)金属Ni可以与Mg、C形成一种新型超导体,它的临界温度为8K,由C、Mg、Ni形成的某物质的晶胞为正六面体,结构如图所示。

①该物质的化学式为
②每个Mg原子距离最近的Ni原子的个数是
③若用NA表示阿伏伽德罗常数的值,如果晶体的密度为ρg/cm3,则该晶胞的体积为
您最近一年使用:0次



