亚铁氰化钾{ }又称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为
}又称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为 ,回答问题:
,回答问题:
(1)写出基态 的核外电子排布式:
的核外电子排布式:___________ 。
(2) 中的作用力除共价键外,还有
中的作用力除共价键外,还有___________ 和___________ 。含有12molσ键的 的物质的量为1mol。
的物质的量为1mol。
(3)黄血盐中C原子的杂化方式为sp;C、N、O的第一电离能由大到小的排序为___________ ,电负性由大到小的排序为___________ 。
(4)Fe、Na、K的晶体结构如图所示:
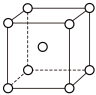
①钠的熔点比钾更高,原因是___________ 。
②Fe原子半径是rcm,阿伏加德罗常数为 ,铁的相对原子质量为a,则铁单质的密度是
,铁的相对原子质量为a,则铁单质的密度是___________  。
。
 }又称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为
}又称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为 ,回答问题:
,回答问题:(1)写出基态
 的核外电子排布式:
的核外电子排布式:(2)
 中的作用力除共价键外,还有
中的作用力除共价键外,还有 的物质的量为1mol。
的物质的量为1mol。(3)黄血盐中C原子的杂化方式为sp;C、N、O的第一电离能由大到小的排序为
(4)Fe、Na、K的晶体结构如图所示:

①钠的熔点比钾更高,原因是
②Fe原子半径是rcm,阿伏加德罗常数为
 ,铁的相对原子质量为a,则铁单质的密度是
,铁的相对原子质量为a,则铁单质的密度是 。
。
更新时间:2023-04-25 09:40:47
|
相似题推荐
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
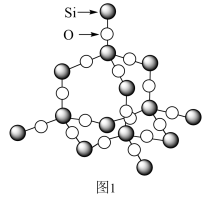
【推荐1】硅因为具有半导体的性质被认为是一种比较特殊的非金属元素,它的单质是硬度较大的非金属单质。铬单质为钢灰色金属,是自然界硬度最大的金属。
(1)若铬的一种同位素原子核内有28个中子,试写出该同位素原子的原子符号,写出基态铬原子的核外电子排布_______ 。
(2)与硅同周期的金属第一电离能由大到小排列:_______ 。与硅同周期的非金属电负性由小到大排列:_______ 。
(3)图2为二氧化硅的晶胞示意图,由图可知,二氧化硅是_______ (选填“原子晶体”、“分子晶体”或“离子晶体”,下同)。与硅同主族的元素碳的氧化物干冰是_______ 。1mol二氧化硅晶体所含有的σ键个数为_______ 。1mol的乙炔含有π键的个数为_______ 。
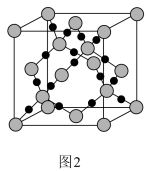
(4)已知二氧化硅的晶胞参数为anm,计算SiO2的密度_______ g/cm3。(列出计算式)

(1)若铬的一种同位素原子核内有28个中子,试写出该同位素原子的原子符号,写出基态铬原子的核外电子排布
(2)与硅同周期的金属第一电离能由大到小排列:
(3)图2为二氧化硅的晶胞示意图,由图可知,二氧化硅是

(4)已知二氧化硅的晶胞参数为anm,计算SiO2的密度
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐2】元素周期表前四周期 、
、 、
、 、
、 、
、 五种元素,
五种元素, 元素的原子最外层电子排布式为
元素的原子最外层电子排布式为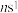 ;
; 元素的原子价电子排布式为
元素的原子价电子排布式为 ;
; 元素位于第二周期且原子中
元素位于第二周期且原子中 能级与
能级与 能级电子总数相等;
能级电子总数相等; 元素原子的
元素原子的 能层的
能层的 能级中有3个未成对电子;
能级中有3个未成对电子; 元素原子有5个未成对电子。
元素原子有5个未成对电子。
(1)写出元素名称:
_______ ;
_______ ;
_______ 。
(2) 基态原子的电子排布图为
基态原子的电子排布图为_______ 。
(3)当 时,
时, 的最简单气态氢化物的电子式为
的最简单气态氢化物的电子式为_______ , 分子的结构式是
分子的结构式是_______ ;当 时,
时, 与
与 形成的化合物与氢氧化钠溶液反应的离子方程式是
形成的化合物与氢氧化钠溶液反应的离子方程式是_______ 。
(4)若 元素的原子最外层电子排布式为
元素的原子最外层电子排布式为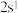 ,
, 元素的原子价电子排布式为
元素的原子价电子排布式为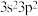 ,
, 、
、 、
、 、
、 四种元素的第一电离能由大到小的顺序是
四种元素的第一电离能由大到小的顺序是_______ (用元素符号表示)。
(5) 元素原子的价电子排布式是
元素原子的价电子排布式是_______ ,在元素周期表中的位置是_______ ,其最高价氧化物的化学式_______ 。
 、
、 、
、 、
、 、
、 五种元素,
五种元素, 元素的原子最外层电子排布式为
元素的原子最外层电子排布式为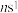 ;
; 元素的原子价电子排布式为
元素的原子价电子排布式为 ;
; 元素位于第二周期且原子中
元素位于第二周期且原子中 能级与
能级与 能级电子总数相等;
能级电子总数相等; 元素原子的
元素原子的 能层的
能层的 能级中有3个未成对电子;
能级中有3个未成对电子; 元素原子有5个未成对电子。
元素原子有5个未成对电子。(1)写出元素名称:



(2)
 基态原子的电子排布图为
基态原子的电子排布图为(3)当
 时,
时, 的最简单气态氢化物的电子式为
的最简单气态氢化物的电子式为 分子的结构式是
分子的结构式是 时,
时, 与
与 形成的化合物与氢氧化钠溶液反应的离子方程式是
形成的化合物与氢氧化钠溶液反应的离子方程式是(4)若
 元素的原子最外层电子排布式为
元素的原子最外层电子排布式为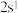 ,
, 元素的原子价电子排布式为
元素的原子价电子排布式为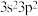 ,
, 、
、 、
、 、
、 四种元素的第一电离能由大到小的顺序是
四种元素的第一电离能由大到小的顺序是(5)
 元素原子的价电子排布式是
元素原子的价电子排布式是
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐3】铜是重要的过渡金属元素,铜被广泛应用于电子工业和航天领域中。回答下列问题:
(1)基态铜原子的核外电子排布式为___________ ,同周期与铜原子未成对电子数相同的p区元素原子为___________ (填符号)。
(2)向CuSO4溶液中滴加氨水可以得到1∶1型离子化合物,其阳离子结构如图所示,阴离子为正四面体结构。________ (填序号)。
A.离子键 B.极性键 C.非极性键 D.σ键 E.π键 F.配位键 G.氢键
②H2O与NH3中键角较大的是________ ,原因是________ 。
③该化合物加热时首先失去的组分是H2O,原因是________ 。
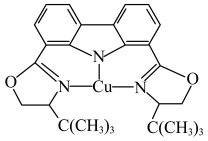
(3)我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素的第一电离能由大到小的顺序是_________ (填元素符号),配合物中sp2 杂化的碳原子与sp3 杂化的碳原子个数比为___________ 。___________ (用含r、ρ、NA的代数式表示)。
(1)基态铜原子的核外电子排布式为
(2)向CuSO4溶液中滴加氨水可以得到1∶1型离子化合物,其阳离子结构如图所示,阴离子为正四面体结构。

A.离子键 B.极性键 C.非极性键 D.σ键 E.π键 F.配位键 G.氢键
②H2O与NH3中键角较大的是
③该化合物加热时首先失去的组分是H2O,原因是
(3)我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素的第一电离能由大到小的顺序是

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学方程式为(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac。请回答下列问题:
(1)C、N、O的电负性由大到小的顺序为________ 。
(2)写出Cu的核外电子排布式________ 。
(3)化合物Cu(NH3)3(CO)Ac中,金属元素的化合价为________ 。
(4)在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为________ ;1mol尿素分子中,σ 键的数目为________ 。
(1)C、N、O的电负性由大到小的顺序为
(2)写出Cu的核外电子排布式
(3)化合物Cu(NH3)3(CO)Ac中,金属元素的化合价为
(4)在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】单晶边缘纳米催化剂技术为工业上有效利用二氧化碳提供了一条经济可行的途径,其中单品氧化镁负载镍催化剂表现出优异的抗积碳和抗烧结性能。
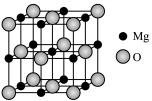
(1)基态镁原子的核外电子排布式为_______ 。
(2)氧化镁载体及镍催化反应中涉及到 和
和 等物质。元素
等物质。元素 、O和C的第一电离能由小到大排序为
、O和C的第一电离能由小到大排序为_______ ;在上述三种物质的分子中碳原子杂化类型不同于其他两种的是_______ (填化学式),三种物质中沸点最高的是 ,其原因是
,其原因是_______ 。
(3)氟元素在有机晶体化学领域的研究和应用中有重要价值。
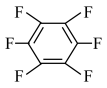
苯环上的电子云密度:苯_______ 六氟苯(填“>”或“<”),依据电负性解释其原因:_______ 。
(4)已知 具有
具有 型晶体结构,其结构如图所示。则每个
型晶体结构,其结构如图所示。则每个 周围距离最近的
周围距离最近的 个数为
个数为_______ 。已知 晶胞边长为
晶胞边长为 ,则
,则 的密度为
的密度为_______  。
。
(1)基态镁原子的核外电子排布式为
(2)氧化镁载体及镍催化反应中涉及到
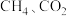 和
和 等物质。元素
等物质。元素 、O和C的第一电离能由小到大排序为
、O和C的第一电离能由小到大排序为 ,其原因是
,其原因是(3)氟元素在有机晶体化学领域的研究和应用中有重要价值。

苯环上的电子云密度:苯
(4)已知
 具有
具有 型晶体结构,其结构如图所示。则每个
型晶体结构,其结构如图所示。则每个 周围距离最近的
周围距离最近的 个数为
个数为 晶胞边长为
晶胞边长为 ,则
,则 的密度为
的密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】金属铬及其化合物广泛应用于工业生产中。
(1)烟酸铬是铬的一种化合物,可促进生物体内的蛋白质合成,提高生物体的免疫力,其合成过程如图:
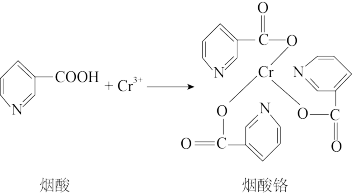
①H、C、N、O的电负性由大到小的顺序是____ 。
②烟酸中碳原子的杂化方式为____ 。
(2)基态铬原子的核外电子排布式为____ ,有____ 个未成对电子。
(3)铬元素的一种配合物[Cr(H2O)4Cl2]Cl•2H2O,配离子中提供孤电子对的原子为____ ,配位数为____ 。
(4)Cr2O3晶体的熔点为2435℃,而CrCl3晶体易升华,其主要原因是____ 。
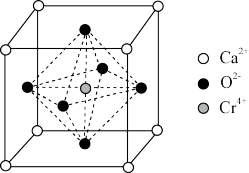
(5)铬、钙和氧组成一种特殊的导电材料(复合氧化物),其晶胞如图所示。该晶体的化学式为____ 。
(1)烟酸铬是铬的一种化合物,可促进生物体内的蛋白质合成,提高生物体的免疫力,其合成过程如图:

①H、C、N、O的电负性由大到小的顺序是
②烟酸中碳原子的杂化方式为
(2)基态铬原子的核外电子排布式为
(3)铬元素的一种配合物[Cr(H2O)4Cl2]Cl•2H2O,配离子中提供孤电子对的原子为
(4)Cr2O3晶体的熔点为2435℃,而CrCl3晶体易升华,其主要原因是
(5)铬、钙和氧组成一种特殊的导电材料(复合氧化物),其晶胞如图所示。该晶体的化学式为

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐1】铁系元素是第一过渡系列第VIII族的三个相邻元素——Fe、Co、Ni,它们是人体必需的微量元素,也是现代工业和高新技术的重要材料。
(1)基态Ni的轨道中未成对电子有___________ 个。
(2)如图,Co的羰基配合物在工业上常用作有机物偶联和羰基引入的试制。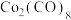 常温下为橙红色固体,不溶于水,易溶于有机溶剂。推测
常温下为橙红色固体,不溶于水,易溶于有机溶剂。推测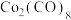 是
是___________ (填“极性”或“非极性”)分子;写出CO的结构式:___________ 。
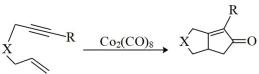
(3)已知,金属离子的电荷越高,极化能力越强,水解能力越强。故 在酸性溶液中常发生水解:
在酸性溶液中常发生水解: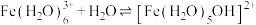 (配离子)
(配离子)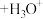 。则配离子中
。则配离子中 的配位数为
的配位数为___________ ,1mol该配离子所含σ键的数目为___________ (设 为阿伏伽德罗常数)。
为阿伏伽德罗常数)。
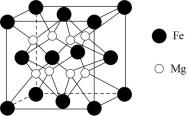
(4)Fe-Mg是一种高效储氢材料,其晶胞结构如图。储氢时,H2分子在晶胞的体心和棱的中点位置,则晶体吸附H2后的化学式为___________ 。
(1)基态Ni的轨道中未成对电子有
(2)如图,Co的羰基配合物在工业上常用作有机物偶联和羰基引入的试制。
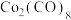 常温下为橙红色固体,不溶于水,易溶于有机溶剂。推测
常温下为橙红色固体,不溶于水,易溶于有机溶剂。推测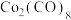 是
是
(3)已知,金属离子的电荷越高,极化能力越强,水解能力越强。故
 在酸性溶液中常发生水解:
在酸性溶液中常发生水解: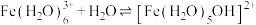 (配离子)
(配离子)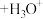 。则配离子中
。则配离子中 的配位数为
的配位数为 为阿伏伽德罗常数)。
为阿伏伽德罗常数)。(4)Fe-Mg是一种高效储氢材料,其晶胞结构如图。储氢时,H2分子在晶胞的体心和棱的中点位置,则晶体吸附H2后的化学式为

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】金属铬及其化合物广泛应用于工业生产中。
(1)烟酸铬是铬的一种化合物,可促进生物体内的蛋白质合成,提高生物体的免疫力,其合成过程如图:

①H、C、N、O的电负性由大到小的顺序是____ 。
②烟酸中碳原子的杂化方式为____ 。
(2)基态铬原子的核外电子排布式为____ ,有____ 个未成对电子。
(3)铬元素的一种配合物[Cr(H2O)4Cl2]Cl•2H2O,配离子中提供孤电子对的原子为____ ,配位数为____ 。
(4)Cr2O3晶体的熔点为2435℃,而CrCl3晶体易升华,其主要原因是____ 。
(5)铬、钙和氧组成一种特殊的导电材料(复合氧化物),其晶胞如图所示。该晶体的化学式为____ 。

(1)烟酸铬是铬的一种化合物,可促进生物体内的蛋白质合成,提高生物体的免疫力,其合成过程如图:

①H、C、N、O的电负性由大到小的顺序是
②烟酸中碳原子的杂化方式为
(2)基态铬原子的核外电子排布式为
(3)铬元素的一种配合物[Cr(H2O)4Cl2]Cl•2H2O,配离子中提供孤电子对的原子为
(4)Cr2O3晶体的熔点为2435℃,而CrCl3晶体易升华,其主要原因是
(5)铬、钙和氧组成一种特殊的导电材料(复合氧化物),其晶胞如图所示。该晶体的化学式为

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】Fe、Co、Ni是几种重要的金属元素。请回答下列问题。
(1)基态Co原子的价电子轨道表示式为___________ 。
(2)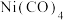 常温下为无色液体,沸点为42.1℃,熔点为-19.3℃,难溶于水,易溶于有机溶剂。推测
常温下为无色液体,沸点为42.1℃,熔点为-19.3℃,难溶于水,易溶于有机溶剂。推测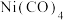 是
是___________ 分子(填“极性”或“非极性”)。
(3)实验室常用KSCN溶液或苯酚(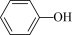 )检验
)检验 。第一电离能:N
。第一电离能:N___________ O(填“>”或“<”),KSCN的配位原子有___________ 。苯酚中碳原子和氧原子的杂化类型分别为___________ ;___________ 。
(4)配位化合物 中心原子Co的配位数为
中心原子Co的配位数为___________ ,配体为___________ 。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,S原子的配位数是___________ ,其晶胞边长为540.0pm,密度为___________ (列式并计算)。Zn:65 S:32
(1)基态Co原子的价电子轨道表示式为
(2)
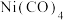 常温下为无色液体,沸点为42.1℃,熔点为-19.3℃,难溶于水,易溶于有机溶剂。推测
常温下为无色液体,沸点为42.1℃,熔点为-19.3℃,难溶于水,易溶于有机溶剂。推测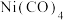 是
是(3)实验室常用KSCN溶液或苯酚(
 )检验
)检验 。第一电离能:N
。第一电离能:N(4)配位化合物
 中心原子Co的配位数为
中心原子Co的配位数为(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,S原子的配位数是
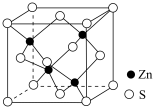
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】铁、钴、镍都属于第Ⅷ族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
⑴基态Fe2+的核外电子排布式为____ 。结合电子排布式分析Fe3+比Co3+氧化性弱的原因:_____ 。
⑵BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为________ 。
②CTCN的化学式为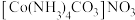 ,与Co3+形成配位键的原子是
,与Co3+形成配位键的原子是________ 。(已知CO32−的结构式为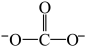 )
)
③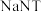 可以
可以 (双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为________ ,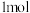
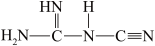 中含有σ键的物质的量为
中含有σ键的物质的量为________ 。
④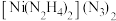 是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为
是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为_____ 。
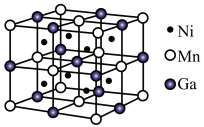
⑶一种新型的功能材料的晶胞结构如图所示,Mn在面心和顶点,它的化学式可表示为________ 。
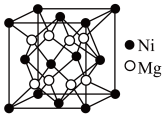
⑷镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm。则镍镁晶体未储氢时的密度为________ (列出计算表达式,NA表示阿伏加 德罗常数的数值) g∙cm-3。
⑴基态Fe2+的核外电子排布式为
⑵BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为
②CTCN的化学式为
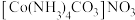 ,与Co3+形成配位键的原子是
,与Co3+形成配位键的原子是 )
)③
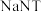 可以
可以 (双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为
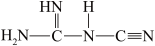 中含有σ键的物质的量为
中含有σ键的物质的量为④
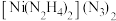 是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为
是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为⑶一种新型的功能材料的晶胞结构如图所示,Mn在面心和顶点,它的化学式可表示为

⑷镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm。则镍镁晶体未储氢时的密度为

您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
【推荐2】湿法炼锌综合回收系统产出的萃余液中含有Na2SO4、ZnSO4、H2SO4,还含有Mn2+、Co2+、Ni2+、Cd2+、Fe2+、Al3+等,一种将萃余液中有价离子分步分离、富集回收的工艺流程如下:
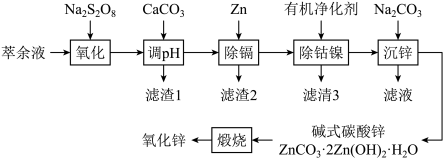
回答下列问题:
(1)“氧化”时,Mn2+、Fe2+均发生反应。后者发生反应时,氧化剂与还原剂的物质的量之比为_______ 。
(2)“调pH”时,所得“滤渣1”中除含有MnO2和 外,还有
外,还有_______ 。
(3)“除镉”时,发生反应的类型为_______ 。
(4)“除钴镍”时,有机净化剂的基本组分为大分子立体网格结构的聚合物。其净化原理可表示为:
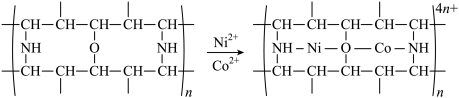
反应时,接受电子对的一方是_______ ;Ni2+价电子排布式为_______ 。
(5)“沉锌”时有气体生成,则生成碱式碳酸锌的离子方程式为_______ 。
(6)“沉锌”时,所得滤液经硫酸酸化后,用惰性电极电解可制备Na2S2O8,从而实现原料的循环利用,该电解过程中总反应的化学方程式为_______ 。
(7)氧化锌有多种晶体结构,其中一种晶胞结构及晶胞参数如图所示。已知阿伏加德罗常数的值为NA,则该氧化锌晶体的密度为_______ g⋅cm-3(列出计算式即可)。


回答下列问题:
(1)“氧化”时,Mn2+、Fe2+均发生反应。后者发生反应时,氧化剂与还原剂的物质的量之比为
(2)“调pH”时,所得“滤渣1”中除含有MnO2和
 外,还有
外,还有(3)“除镉”时,发生反应的类型为
(4)“除钴镍”时,有机净化剂的基本组分为大分子立体网格结构的聚合物。其净化原理可表示为:

反应时,接受电子对的一方是
(5)“沉锌”时有气体生成,则生成碱式碳酸锌的离子方程式为
(6)“沉锌”时,所得滤液经硫酸酸化后,用惰性电极电解可制备Na2S2O8,从而实现原料的循环利用,该电解过程中总反应的化学方程式为
(7)氧化锌有多种晶体结构,其中一种晶胞结构及晶胞参数如图所示。已知阿伏加德罗常数的值为NA,则该氧化锌晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】ⅤA族元素原子核外电子排布有着特殊性,能与其他元素组成结构、性质各异的化合物。回答下列问题:
(1)氮原子可以提供孤电子对与氧原子形成配位键,基态氧原子的价层电子发生重排提供一个空轨道,则重排后的氧原子价电子排布图(轨道表达式)为___________ ,基态氧原子的价层电子不是重排结构,原因是不符合___________ 。
(2)沸点:
___________  (填“>”或“<”,下同),键角:
(填“>”或“<”,下同),键角:
___________  。
。
(3)As、Ge、Se三种元素的第一电离能由大到小的顺序是___________ 。
(4)基态As原子的价层电子排布式为___________ ,与 互为等电子体的分子为
互为等电子体的分子为___________ (任写一种)。
(5)雌黄( )中As原子的杂化方式为
)中As原子的杂化方式为___________ 。
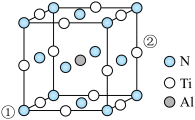
(6)根据下图所示晶胞中,写出该晶体的化学式___________ 。
(1)氮原子可以提供孤电子对与氧原子形成配位键,基态氧原子的价层电子发生重排提供一个空轨道,则重排后的氧原子价电子排布图(轨道表达式)为
(2)沸点:

 (填“>”或“<”,下同),键角:
(填“>”或“<”,下同),键角:
 。
。(3)As、Ge、Se三种元素的第一电离能由大到小的顺序是
(4)基态As原子的价层电子排布式为
 互为等电子体的分子为
互为等电子体的分子为(5)雌黄(
 )中As原子的杂化方式为
)中As原子的杂化方式为(6)根据下图所示晶胞中,写出该晶体的化学式

您最近一年使用:0次



