湿法炼锌综合回收系统产出的萃余液中含有Na2SO4、ZnSO4、H2SO4,还含有Mn2+、Co2+、Ni2+、Cd2+、Fe2+、Al3+等,一种将萃余液中有价离子分步分离、富集回收的工艺流程如下:
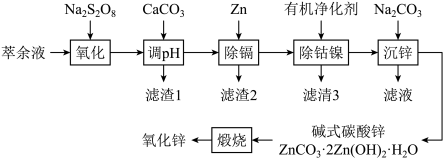
回答下列问题:
(1)“氧化”时,Mn2+、Fe2+均发生反应。后者发生反应时,氧化剂与还原剂的物质的量之比为_______ 。
(2)“调pH”时,所得“滤渣1”中除含有MnO2和 外,还有
外,还有_______ 。
(3)“除镉”时,发生反应的类型为_______ 。
(4)“除钴镍”时,有机净化剂的基本组分为大分子立体网格结构的聚合物。其净化原理可表示为:
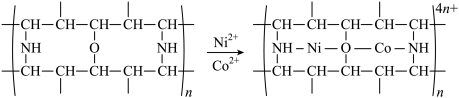
反应时,接受电子对的一方是_______ ;Ni2+价电子排布式为_______ 。
(5)“沉锌”时有气体生成,则生成碱式碳酸锌的离子方程式为_______ 。
(6)“沉锌”时,所得滤液经硫酸酸化后,用惰性电极电解可制备Na2S2O8,从而实现原料的循环利用,该电解过程中总反应的化学方程式为_______ 。
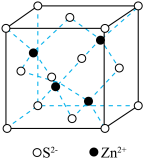
(7)氧化锌有多种晶体结构,其中一种晶胞结构及晶胞参数如图所示。已知阿伏加德罗常数的值为NA,则该氧化锌晶体的密度为_______ g⋅cm-3(列出计算式即可)。


回答下列问题:
(1)“氧化”时,Mn2+、Fe2+均发生反应。后者发生反应时,氧化剂与还原剂的物质的量之比为
(2)“调pH”时,所得“滤渣1”中除含有MnO2和
 外,还有
外,还有(3)“除镉”时,发生反应的类型为
(4)“除钴镍”时,有机净化剂的基本组分为大分子立体网格结构的聚合物。其净化原理可表示为:

反应时,接受电子对的一方是
(5)“沉锌”时有气体生成,则生成碱式碳酸锌的离子方程式为
(6)“沉锌”时,所得滤液经硫酸酸化后,用惰性电极电解可制备Na2S2O8,从而实现原料的循环利用,该电解过程中总反应的化学方程式为
(7)氧化锌有多种晶体结构,其中一种晶胞结构及晶胞参数如图所示。已知阿伏加德罗常数的值为NA,则该氧化锌晶体的密度为

更新时间:2024/03/12 20:16:08
|
相似题推荐
解答题-工业流程题
|
较易
(0.85)
【推荐1】稀土金属元素钪在国防、航天、核能等领域具有重要应用。从某工业废料“赤泥”(含有Fe2O3、Fe3O4、Al2O3、SiO2、Sc2O3、TiO2等)中回收Sc2O3的工艺流程如下:

已知:该条件下,Ksp[Fe(OH)3]=1.0×10−38,Ksp[Al(OH)3]=1.0×10−33,Kw=1.0×10−14。
请回答下列问题:
(1)稀土元素Y为第五周期Sc的同族元素,基态Y原子的d能级和s能级电子个数比为___________ 。
(2)“滤渣”的成分为TiO2和________ (填化学式,下同)。
(3)“氢氧化物沉淀”的成分为________ ;为使杂质离子沉淀完全,“调pH”范围应调节为_______ ~6之间。
(4)“氧化”时反应离子方程式为___________ 。
(5)“沉钪”时,将K2CO3固体加入草酸(H2C2O4)溶液[配料比n(K2CO3):n(H2C2O4)=2:3],制得KHC2O4和K2C2O4混合溶液。K2CO3需分批缓慢加入的原因是_______ ;发生反应的离子方程式为______ 。
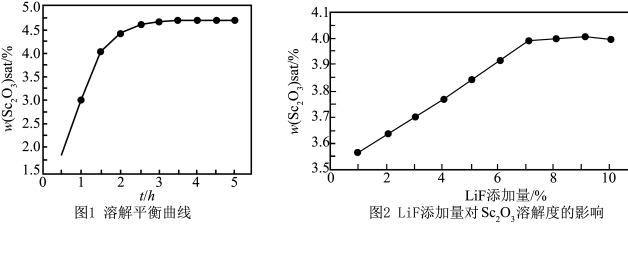
(6)Al-Sc合金是新一代航天结构材料,制备该合金的熔盐电解法涉及原料Sc2O3在熔盐体系中的溶解问题。950℃下部分条件对Sc2O3的溶解影响如图1、图2所示,则应采取的最佳溶解时间和LiF添加量分别为___________ 。

已知:该条件下,Ksp[Fe(OH)3]=1.0×10−38,Ksp[Al(OH)3]=1.0×10−33,Kw=1.0×10−14。
请回答下列问题:
(1)稀土元素Y为第五周期Sc的同族元素,基态Y原子的d能级和s能级电子个数比为
(2)“滤渣”的成分为TiO2和
(3)“氢氧化物沉淀”的成分为
(4)“氧化”时反应离子方程式为
(5)“沉钪”时,将K2CO3固体加入草酸(H2C2O4)溶液[配料比n(K2CO3):n(H2C2O4)=2:3],制得KHC2O4和K2C2O4混合溶液。K2CO3需分批缓慢加入的原因是
(6)Al-Sc合金是新一代航天结构材料,制备该合金的熔盐电解法涉及原料Sc2O3在熔盐体系中的溶解问题。950℃下部分条件对Sc2O3的溶解影响如图1、图2所示,则应采取的最佳溶解时间和LiF添加量分别为

您最近一年使用:0次
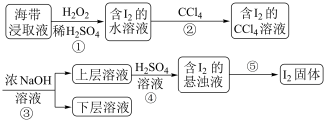
【推荐2】为了从海带浸取液中提取碘,某同学设计了如图实验方案,解答下列问题: 被称作绿色氧化剂的两个原因
被称作绿色氧化剂的两个原因_______ ;_______
(2)实验操作②的名称为_______ ,操作②需要的仪器除烧杯、玻璃棒外,尚缺少的玻璃仪器有_______ ,碘的 溶液位于
溶液位于_______ 层(填“上”或“下”),呈_______ 色。检验水层是否仍含碘单质的方法是_______ 。
(3)③是将富集在 中的碘单质利用化学转化重新富集在水中,称为反萃取,方程式为
中的碘单质利用化学转化重新富集在水中,称为反萃取,方程式为 ,接下来④发生的反应方程式为
,接下来④发生的反应方程式为_______ 。
(4)本实验中可以循环利用的物质是_______ 。
 被称作绿色氧化剂的两个原因
被称作绿色氧化剂的两个原因(2)实验操作②的名称为
 溶液位于
溶液位于(3)③是将富集在
 中的碘单质利用化学转化重新富集在水中,称为反萃取,方程式为
中的碘单质利用化学转化重新富集在水中,称为反萃取,方程式为 ,接下来④发生的反应方程式为
,接下来④发生的反应方程式为(4)本实验中可以循环利用的物质是
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐3】碳酸锶(SrCO3)是一种重要的工业原料,广泛用于生产锶铁氧体磁性材料。一种以菱锶矿(含80~90% SrCO3,少量MgCO3、CaCO3、BaCO3等)制备高纯碳酸锶的工艺流程如下:
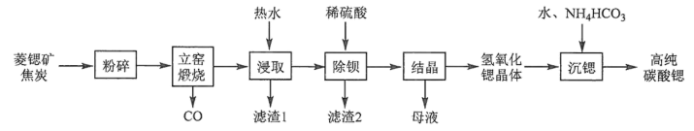
Sr(OH)2在水中的溶解度
(1)元素Sr位于元素周期表第_______ 周期第_______ 族。
(2)菱锶矿、焦炭混合粉碎的目的是_______ 。
(3)“立窑煅烧”中SrCO3与焦炭反应的化学方程式为_______ 。进行煅烧反应的立窑衬里应选择_______ (填“石英砂砖”或“碱性耐火砖”)。

Sr(OH)2在水中的溶解度
| 温度/℃ | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
| 溶解度/(g/100g) | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(1)元素Sr位于元素周期表第
(2)菱锶矿、焦炭混合粉碎的目的是
(3)“立窑煅烧”中SrCO3与焦炭反应的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐1】前四周期元素A、B、C、D、E原子序数依次增大,其相关性质如表所示:
请根据以上情况,回答下列问题:
(1)E元素基态原子核外有_______ 种能量不同的电子,其价电子排布式为__________ 。
(2)B和C可形成一种同时含有共价键和离子键的化合物,写出此化合物与水反应的化学方程式_______ 。
(3)B、C、D三种元素的简单离子的半径由大到小的顺序为_______ (用离子符号表示)。
(4)A的简单氢化物与最高价氧化物对应的水化物可以发生反应,则生成物中阳离子的结构式为_______ 。
(5)检测元素C的常见方法是____________ 。
| A | 2p能级电子半充满 |
| B | 与A同周期,且原子核外有2个未成对电子 |
| C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
| D | 其基态原子外围电子排布式为nsn-1npn+1 |
| E | 前四周期元素中,E元素基态原子未成对电子数最多 |
(1)E元素基态原子核外有
(2)B和C可形成一种同时含有共价键和离子键的化合物,写出此化合物与水反应的化学方程式
(3)B、C、D三种元素的简单离子的半径由大到小的顺序为
(4)A的简单氢化物与最高价氧化物对应的水化物可以发生反应,则生成物中阳离子的结构式为
(5)检测元素C的常见方法是
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐2】铁、钴、镍都属于第Ⅷ族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
⑴基态Fe2+的核外电子排布式为____ 。结合电子排布式分析Fe3+比Co3+氧化性弱的原因:_____ 。
⑵BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为________ 。
②CTCN的化学式为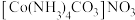 ,与Co3+形成配位键的原子是
,与Co3+形成配位键的原子是________ 。(已知CO32−的结构式为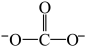 )
)
③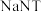 可以
可以 (双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为________ ,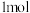
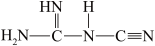 中含有σ键的物质的量为
中含有σ键的物质的量为________ 。
④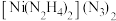 是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为
是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为_____ 。
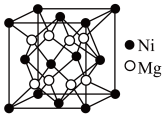
⑶一种新型的功能材料的晶胞结构如图所示,Mn在面心和顶点,它的化学式可表示为________ 。
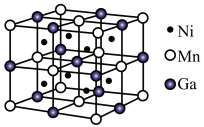
⑷镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm。则镍镁晶体未储氢时的密度为________ (列出计算表达式,NA表示阿伏加 德罗常数的数值) g∙cm-3。
⑴基态Fe2+的核外电子排布式为
⑵BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为
②CTCN的化学式为
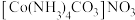 ,与Co3+形成配位键的原子是
,与Co3+形成配位键的原子是 )
)③
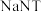 可以
可以 (双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为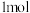
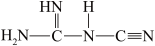 中含有σ键的物质的量为
中含有σ键的物质的量为④
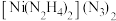 是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为
是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为⑶一种新型的功能材料的晶胞结构如图所示,Mn在面心和顶点,它的化学式可表示为

⑷镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm。则镍镁晶体未储氢时的密度为

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】如图所示是s能级和p能级的原子轨道图:
(1)s电子的原子轨道呈___________ 形,每个s能级有___________ 个原子轨道;p电子的原子轨道呈___________ 形,每个p能级有___________ 个原子轨道。
(2)元素X的基态原子最外层电子排布式为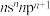 ,其p电子云在空间有3个互相
,其p电子云在空间有3个互相___________ (填“垂直”或“平行”)的伸展方向;元素X的名称是___________ ,它的最低价氢化物的电子式是___________ 。
(3)元素Y的基态原子最外层电子排布式为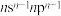 ,那么Y的元素符号应为
,那么Y的元素符号应为___________ ,其基态原子的轨道表示式为___________ 。

(1)s电子的原子轨道呈
(2)元素X的基态原子最外层电子排布式为
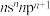 ,其p电子云在空间有3个互相
,其p电子云在空间有3个互相(3)元素Y的基态原子最外层电子排布式为
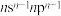 ,那么Y的元素符号应为
,那么Y的元素符号应为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】晶体世界丰富多彩,复杂多样,各类晶体具有不同的结构特点,决定着他具有不同的性质和用途,回答下列问题:
(1) 可写成
可写成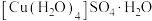 ,其结构示意图如下图,则硫酸铜晶体中
,其结构示意图如下图,则硫酸铜晶体中 的配位数为
的配位数为___________ ,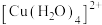 中配位原子是
中配位原子是___________ 。 原子立方晶格的八面体空隙中,晶胞结构如图所示。
原子立方晶格的八面体空隙中,晶胞结构如图所示。___________ , 原子周围与之等距离的
原子周围与之等距离的 原子个数为
原子个数为___________ 。
(3)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞(如图1)内部的碳原子被N原子代替,顶点和面心的碳原子被 原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。下图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为
原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。下图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为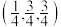 ,则原子2和4的原子分数坐标为
,则原子2和4的原子分数坐标为___________ 、___________ 。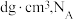 代表阿伏加德罗常数的值,则
代表阿伏加德罗常数的值,则 的晶胞中
的晶胞中 的配位数为
的配位数为___________ ; 和
和 之间的最短核间距(x)为
之间的最短核间距(x)为___________  (用代数式表示)。
(用代数式表示)。
(1)
 可写成
可写成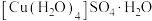 ,其结构示意图如下图,则硫酸铜晶体中
,其结构示意图如下图,则硫酸铜晶体中 的配位数为
的配位数为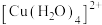 中配位原子是
中配位原子是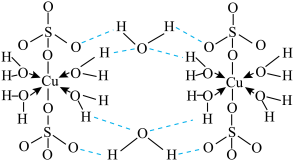
 原子立方晶格的八面体空隙中,晶胞结构如图所示。
原子立方晶格的八面体空隙中,晶胞结构如图所示。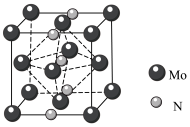
 原子周围与之等距离的
原子周围与之等距离的 原子个数为
原子个数为(3)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞(如图1)内部的碳原子被N原子代替,顶点和面心的碳原子被
 原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。下图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为
原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。下图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为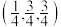 ,则原子2和4的原子分数坐标为
,则原子2和4的原子分数坐标为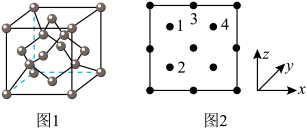
 代表阿伏加德罗常数的值,则
代表阿伏加德罗常数的值,则 的晶胞中
的晶胞中 的配位数为
的配位数为 和
和 之间的最短核间距(x)为
之间的最短核间距(x)为 (用代数式表示)。
(用代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)K和 属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属
属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属 低,试解释原因。
低,试解释原因。_____
(2) 晶体是一种性能良好的光学材料,其晶胞为立方体,棱长为
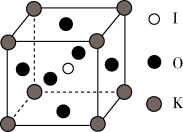
晶体是一种性能良好的光学材料,其晶胞为立方体,棱长为 ,晶胞中K、I、O分别处于顶点、体心、面心位置,如图所示。与K紧邻的O有
,晶胞中K、I、O分别处于顶点、体心、面心位置,如图所示。与K紧邻的O有_____ 个?试说明分析思路。_____
(3)计算K与O间的最短距离_____ 。
(1)K和
 属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属
属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属 低,试解释原因。
低,试解释原因。(2)
 晶体是一种性能良好的光学材料,其晶胞为立方体,棱长为
晶体是一种性能良好的光学材料,其晶胞为立方体,棱长为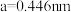 ,晶胞中K、I、O分别处于顶点、体心、面心位置,如图所示。与K紧邻的O有
,晶胞中K、I、O分别处于顶点、体心、面心位置,如图所示。与K紧邻的O有
(3)计算K与O间的最短距离
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】硼氮氢化合物在有机合成、储氢材料等方面备受关注。硼氮氢化合物之一氨硼烷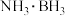 的一种制备方法如下:
的一种制备方法如下:
ⅰ.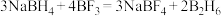 (乙硼烷)
(乙硼烷)
(1) 中硼元素的化合价为
中硼元素的化合价为___________ 。
(2)分析解释 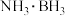 中N与B原子之间的作用
中N与B原子之间的作用___________ 。
(3)比较 与
与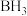 键角大小:
键角大小: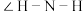
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(4)新型储氢材料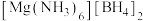 的晶胞为边长anm的立方体,如下图所示。
的晶胞为边长anm的立方体,如下图所示。 距离最近且等距的
距离最近且等距的 有
有___________ 个。
②已知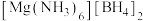 的摩尔质量为M
的摩尔质量为M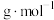 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,此晶体的密度为
,此晶体的密度为___________  。(
。(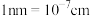 )
)
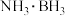 的一种制备方法如下:
的一种制备方法如下:ⅰ.
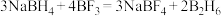 (乙硼烷)
(乙硼烷)ⅱ.

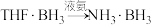
(1)
 中硼元素的化合价为
中硼元素的化合价为(2)
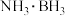 中N与B原子之间的作用
中N与B原子之间的作用(3)比较
 与
与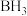 键角大小:
键角大小: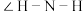
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(4)新型储氢材料
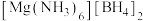 的晶胞为边长anm的立方体,如下图所示。
的晶胞为边长anm的立方体,如下图所示。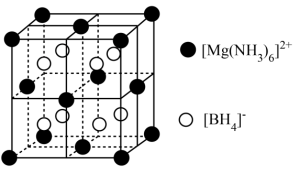
 距离最近且等距的
距离最近且等距的 有
有②已知
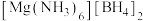 的摩尔质量为M
的摩尔质量为M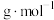 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,此晶体的密度为
,此晶体的密度为 。(
。(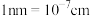 )
)
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐1】为将混有K2SO4、MgSO4的KNO3固体提纯并获得KNO3溶液,方案如下:
(1)实验操作①为___________ ,为提高该操作速度通常采用的方法是___________ 。
(2)若操作②加入的试剂为KOH溶液,则③④步加入试剂依次发生反应的化学方程式为:___________ 、___________ 。
(3)该同学设计的实验方案不严密,请纠正并说明理由___________ 。
(4)如何判断SO 已除尽,简述实验操作
已除尽,简述实验操作___________ 。

(1)实验操作①为
(2)若操作②加入的试剂为KOH溶液,则③④步加入试剂依次发生反应的化学方程式为:
(3)该同学设计的实验方案不严密,请纠正并说明理由
(4)如何判断SO
 已除尽,简述实验操作
已除尽,简述实验操作
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
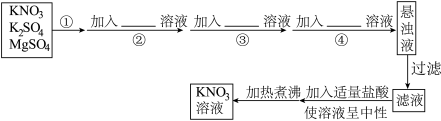
【推荐2】Co3O4(Co为+2和+3价)可应用于磁性材料等领域。实验室利用乙酸钴晶体[Co(CH3COO)2·4H2O]制备Co3O4的实验步骤如下:
Ⅰ. 将乙酸钴晶体配成溶液X,缓慢滴加(NH4)2CO3溶液,30 ℃水浴一段时间;
Ⅱ. 将混合液高压密封加热到160 ℃,得到含碱式碳酸钴晶体[2CoCO3·3Co(OH)2·H2O]的浊液;
Ⅲ. 制备碱式碳酸钴晶体;
Ⅳ. 将碱式碳酸钴晶体在空气中煅烧得Co3O4产品。
已知:碱式碳酸钴晶体不溶于冷水和乙醇,可溶于温水,常压下高于30 ℃开始分解。
(1) 乙酸钻晶体中钴含量可用配位滴定法测定,下列说法正确的是________ (填字母)。
a. 滴定前,锥形瓶和滴定管均须用标准溶液润洗

b. 读数前,需排除滴定管尖嘴处的气泡
c. 滴定时,眼睛注视锥形瓶中颜色变化
(2) “步骤Ⅰ”30 ℃水浴的装置如右图所示,温度计应置于________ (填“a”或“b”)处。
(3) “步骤Ⅱ”采用高压密封加热的目的是________ 。
(4) “步骤Ⅳ”中,在实验室煅烧碱式碳酸钴晶体所需的仪器除酒精灯、三脚架以外,还需要的硅酸盐质仪器有____________ ,煅烧时发生反应的化学方程式为________ 。
(5) “步骤Ⅲ”中,设计由“步骤Ⅱ”的浊液制备碱式碳酸钴晶体的实验方案:________________________ 。(实验须使用的试剂:蒸馏水、乙醇)
Ⅰ. 将乙酸钴晶体配成溶液X,缓慢滴加(NH4)2CO3溶液,30 ℃水浴一段时间;
Ⅱ. 将混合液高压密封加热到160 ℃,得到含碱式碳酸钴晶体[2CoCO3·3Co(OH)2·H2O]的浊液;
Ⅲ. 制备碱式碳酸钴晶体;
Ⅳ. 将碱式碳酸钴晶体在空气中煅烧得Co3O4产品。
已知:碱式碳酸钴晶体不溶于冷水和乙醇,可溶于温水,常压下高于30 ℃开始分解。
(1) 乙酸钻晶体中钴含量可用配位滴定法测定,下列说法正确的是
a. 滴定前,锥形瓶和滴定管均须用标准溶液润洗

b. 读数前,需排除滴定管尖嘴处的气泡
c. 滴定时,眼睛注视锥形瓶中颜色变化
(2) “步骤Ⅰ”30 ℃水浴的装置如右图所示,温度计应置于
(3) “步骤Ⅱ”采用高压密封加热的目的是
(4) “步骤Ⅳ”中,在实验室煅烧碱式碳酸钴晶体所需的仪器除酒精灯、三脚架以外,还需要的硅酸盐质仪器有
(5) “步骤Ⅲ”中,设计由“步骤Ⅱ”的浊液制备碱式碳酸钴晶体的实验方案:
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐3】已知下列数据:
下图为实验室制取乙酸乙酯的装置图。
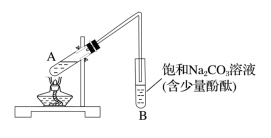
(1)当饱和碳酸钠溶液上方收集到较多液体时,停止加热,取下小试管B,充分振荡,静置。振荡前后的实验现象是_______。
(2)为分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离:
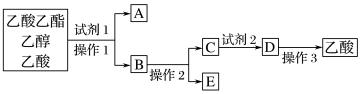
①试剂1最好选用_______ ;
②操作1是_______ ,所用的主要仪器名称是_______ ;
③试剂2最好选用_______ ;
④操作2是_______ ;
⑤操作3中温度计水银球的位置应为如图中_______ (填a、b、c、d)所示,在该操作中,除蒸馏烧瓶、温度计外,还需要的玻璃仪器有酒精灯、牛角管、锥形瓶、和______ ,收集乙酸的适宜温度是_______ 。

| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g·cm-3) |
| 乙醇 | -144 | 78.0 | 0.789 |
| 乙酸 | 16.6 | 118 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓硫酸(98%) | - | 338 | 1.84 |

(1)当饱和碳酸钠溶液上方收集到较多液体时,停止加热,取下小试管B,充分振荡,静置。振荡前后的实验现象是_______。
| A.溶液分层 | B.下层液体红色变浅或变为无色 | C.有气体产生 | D.有果香味 |

①试剂1最好选用
②操作1是
③试剂2最好选用
④操作2是
⑤操作3中温度计水银球的位置应为如图中

您最近一年使用:0次



