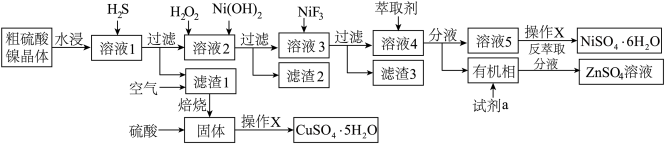
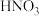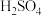从铜电解液(主要含Cu2+、Ni2+、Fe2+、Fe3+、Ca2+、Zn2+等)中提纯可得到粗硫酸镍晶体,某课题小组为了进一步精制纯化并回收胆矾晶体,设计了如图流程:
已知:相关离子浓度为0.1 mol· L-1时,形成氢氧化物沉淀的pH范围如下:
(1)为加快“水浸”时的浸出率,可采取的措施有 _______ ,“滤渣1”的主要成份是_______ 。
(2)为了使“溶液1”中的反应充分进行,需要通入稍过量的H2S,写出Fe3+与H2S发生反应的离子方程式______ 。
(3)解释向“溶液2”中加入Ni(OH)2的原因_______ 。
(4)“操作X”为在_______ (填仪器名称)中加热至_______ 冷却结晶过滤、洗涤、干燥后得到结晶水合物晶体。
(5)若“溶液3”中Ca2+的浓度为0.001 mol·L-1,取等体积的NiF2溶液与该溶液混合,要使反应结束时c(Ca2+)<10-5 mol· L-1,则所加NiF2溶液的浓度至少为_______ mol · L-1。[已知室温下Ksp(CaF2)=4×10-11]
(6)室温下选择萃取剂P204(二乙基已基磷酸,用HR表示),其萃取原理为nHR +Mn+ MRn +nH+,试剂a为
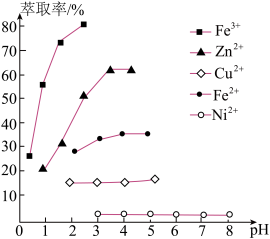
MRn +nH+,试剂a为_____ (填化学式)。溶液pH对几种离子的萃取率的影响如图,则萃取锌时,应控制pH的范围为3~4,请解释原因_______ 。

已知:相关离子浓度为0.1 mol· L-1时,形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Cu2+ | Fe2+ | Fe3+ | Ca2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 4.2 | 6.3 | 1.5 | 11.8 | 6.2 | 6.9 |
| 沉淀完全的pH | 6.7 | 8.3 | 2.8 | 13.8 | 8.2 | 8.9 |
(2)为了使“溶液1”中的反应充分进行,需要通入稍过量的H2S,写出Fe3+与H2S发生反应的离子方程式
(3)解释向“溶液2”中加入Ni(OH)2的原因
(4)“操作X”为在
(5)若“溶液3”中Ca2+的浓度为0.001 mol·L-1,取等体积的NiF2溶液与该溶液混合,要使反应结束时c(Ca2+)<10-5 mol· L-1,则所加NiF2溶液的浓度至少为
(6)室温下选择萃取剂P204(二乙基已基磷酸,用HR表示),其萃取原理为nHR +Mn+
 MRn +nH+,试剂a为
MRn +nH+,试剂a为
2023·内蒙古乌兰察布·二模 查看更多[2]
更新时间:2023-05-04 22:57:32
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】亚氯酸钠(NaClO2)主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如图:
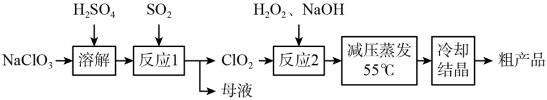
已知:①亚氯酸钠(NaClO2)受热易分解;
②高浓度的ClO2易爆炸。
(1)Cl2与ClO2因有强氧化性而用作常用消毒剂,消毒时均被还原为Cl-,则ClO2的消毒能力是等质量的Cl2的____ 倍(保留小数点后一位)。
(2)反应1涉及的反应方程式为:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4反应中生成的氧化产物与还原产物的物质的量之比为____ ;“反应1”需要鼓入空气,空气的作用是____ 。
(3)“反应2”发生反应的化学方程式:____ 。“反应2”需要控制反应温度不能过高,温度过高可能导致____ 。
(4)为探究NaClO2的氧化性,可以选择下列试剂____ 。根据选择的试剂,描述能体现NaClO2氧化性的实验现象是____ 。
A.淀粉-KI溶液 B.酸性高锰酸钾溶液 C.氯水 D.Na2SO4溶液

已知:①亚氯酸钠(NaClO2)受热易分解;
②高浓度的ClO2易爆炸。
(1)Cl2与ClO2因有强氧化性而用作常用消毒剂,消毒时均被还原为Cl-,则ClO2的消毒能力是等质量的Cl2的
(2)反应1涉及的反应方程式为:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4反应中生成的氧化产物与还原产物的物质的量之比为
(3)“反应2”发生反应的化学方程式:
(4)为探究NaClO2的氧化性,可以选择下列试剂
A.淀粉-KI溶液 B.酸性高锰酸钾溶液 C.氯水 D.Na2SO4溶液
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】黑木耳富含蛋白质、铁、具有还原性的维生素C等,每100 g黑木耳含铁量高达185 mg。
I.为了确定黑木耳中含有铁元素,甲同学设计实验方案如下。
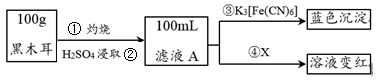
(1)步骤②得到滤液A的操作是_______ 。
(2)步骤④检验Fe3+所用试剂是_______ (填化学式)溶液。
(3)已知:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,则滤液A中大量含有的离子的离子符号为_______ 。
II.紫色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。本实验用KMnO4酸性溶液来测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
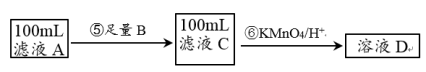
(4)可选做试剂B的物质是_______ (填序号)。
a.Na b.Cu c.Fe
(5)步骤⑥的离子方程式为_______ 。
(6)若乙同学实验操作规范,但测得含铁量远远偏高,其可能的原因是_______ 。
I.为了确定黑木耳中含有铁元素,甲同学设计实验方案如下。

(1)步骤②得到滤液A的操作是
(2)步骤④检验Fe3+所用试剂是
(3)已知:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,则滤液A中大量含有的离子的离子符号为
II.紫色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。本实验用KMnO4酸性溶液来测定黑木耳中铁元素的含量,乙同学设计实验方案如下。

(4)可选做试剂B的物质是
a.Na b.Cu c.Fe
(5)步骤⑥的离子方程式为
(6)若乙同学实验操作规范,但测得含铁量远远偏高,其可能的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
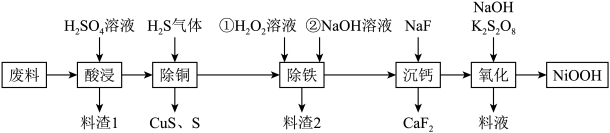
【推荐1】氢氧化氧镍( )有良好的电化学活性,是合成锂离子电池材料的前驱体。某化工厂用含镍废料(主要成分为
)有良好的电化学活性,是合成锂离子电池材料的前驱体。某化工厂用含镍废料(主要成分为 ,杂质为
,杂质为 、
、 、
、 )制备
)制备 的工艺流程如图。
的工艺流程如图。
已知几种金属离子沉淀的 如表:
如表:
(1)为了提高“酸浸”中原料的浸出效率,采取的措施不合理的有_______。
(2)料渣1的主要成分是_______ (填化学式)。
(3)“除铁”时需要控制溶液的 范围为
范围为_______ 。
(4)“除铁”在40~50°C下进行,加入 的作用是
的作用是_______ ,温度不能过高,也不能过低的原因是_______ 。
(5) 中
中 的化合价为
的化合价为_______ 。 中有一个
中有一个 结构,1
结构,1
 完全转化为
完全转化为 转移的电子数目为
转移的电子数目为_______ 。
 )有良好的电化学活性,是合成锂离子电池材料的前驱体。某化工厂用含镍废料(主要成分为
)有良好的电化学活性,是合成锂离子电池材料的前驱体。某化工厂用含镍废料(主要成分为 ,杂质为
,杂质为 、
、 、
、 )制备
)制备 的工艺流程如图。
的工艺流程如图。
已知几种金属离子沉淀的
 如表:
如表:| 金属离子 |  |  |  |
开始沉淀的 | 1.5 | 6.5 | 7.2 |
沉淀完全的 | 3.2 | 9.7 | 9.2 |
| A.研磨废料 | B.加入大量水 | C.搅拌 | D.适当升高温度 |
(3)“除铁”时需要控制溶液的
 范围为
范围为(4)“除铁”在40~50°C下进行,加入
 的作用是
的作用是(5)
 中
中 的化合价为
的化合价为 中有一个
中有一个 结构,1
结构,1
 完全转化为
完全转化为 转移的电子数目为
转移的电子数目为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备难溶于水的碱式碳酸铜的流程如下:
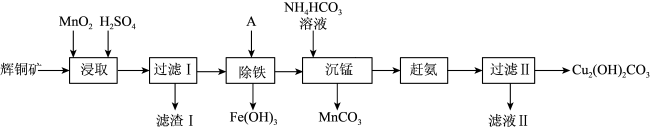
(1)下列措施能加快浸取速率的是___________ 。(填字母)
A.适当增大硫酸浓度 B.将辉铜矿粉碎 C.延长浸取时间
(2)滤渣I中的主要成分是MnO2、S、SiO2,写出“浸取”反应中生成S的离子方程式:___________ 。
(3)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A最好是___________。
(4)“沉锰”(除Mn2+)过程中有关反应的离子方程式为___________ 。
(5)滤液Ⅱ所含溶质主要是___________ (填化学式)。

(1)下列措施能加快浸取速率的是
A.适当增大硫酸浓度 B.将辉铜矿粉碎 C.延长浸取时间
(2)滤渣I中的主要成分是MnO2、S、SiO2,写出“浸取”反应中生成S的离子方程式:
(3)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A最好是___________。
| A.CO2 | B.CuO | C.氨水 | D.HCl |
(4)“沉锰”(除Mn2+)过程中有关反应的离子方程式为
(5)滤液Ⅱ所含溶质主要是
您最近一年使用:0次
【推荐3】二硫化钨(WS2,WS2中W的化合价为+4)可用作润滑剂及石油化工领域中的催化剂。由钨铁矿(其主要成分是FeWO4,还含少量Al2O3)制备二硫化钨的工艺流程如下:
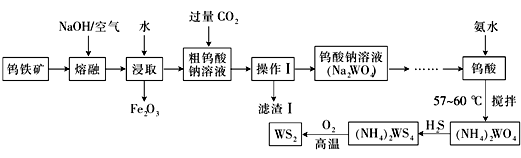
请回答下列问题:
(1)已知:W元素的原子序数是74,请写出W元素在周期表中的位置:_________________
(2)操作Ⅰ中用到的玻璃仪器有________________________________
(3)写出FeWO4在碱熔过程中发生反应的化学方程式:_________________________________
(4)滤渣Ⅰ中主要成分的形成可用离子方程式表示为:_________________________________
(5)钨丝灯管中的W在使用过程中缓慢挥发而使灯丝变细,加入碘单质可以延长使用寿命,其原理为:W(s)+2I2(g) WI4(g)下列说法正确的有_______
WI4(g)下列说法正确的有_______
(6)已知常温下,Ksp(CaWO4) =1×10-10,浓度为x mol/L的Na2WO4溶液与浓度为1×10-4 mol/L的CaCl2溶液按体积比2:1混合,产生CaWO4沉淀,则x≥___________
(7)已知生成二硫化钨的化学方程式为:2(NH4)2WS4+3O2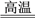 2WS2+4NH3+2S+2SO2+2H2O,若生成124克WS2,则反应所转移的电子数目为
2WS2+4NH3+2S+2SO2+2H2O,若生成124克WS2,则反应所转移的电子数目为________________

请回答下列问题:
(1)已知:W元素的原子序数是74,请写出W元素在周期表中的位置:
(2)操作Ⅰ中用到的玻璃仪器有
(3)写出FeWO4在碱熔过程中发生反应的化学方程式:
(4)滤渣Ⅰ中主要成分的形成可用离子方程式表示为:
(5)钨丝灯管中的W在使用过程中缓慢挥发而使灯丝变细,加入碘单质可以延长使用寿命,其原理为:W(s)+2I2(g)
 WI4(g)下列说法正确的有_______
WI4(g)下列说法正确的有_______| A.灯管内的I2可以循环使用 |
| B.WI4在灯丝上分解,产生的W又在灯丝上沉积 |
| C.温度升高时,WI4的分解速率加快,而W和I2的合成速率减慢 |
| D.WI4在灯管壁上分解,使灯管寿命延长 |
(7)已知生成二硫化钨的化学方程式为:2(NH4)2WS4+3O2
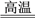 2WS2+4NH3+2S+2SO2+2H2O,若生成124克WS2,则反应所转移的电子数目为
2WS2+4NH3+2S+2SO2+2H2O,若生成124克WS2,则反应所转移的电子数目为
您最近一年使用:0次
【推荐1】硒化铋(Bi2Se3)可用作半导体材料和温差电材料。用辉铋矿(主要成分为Bi2S3,含有SiO2、Cu2S、FeS2杂质)制备硒化铋的一种工艺流程如图所示。
已知:Ksp[Bi(OH)3]=3.0×10-7、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Cu(OH)2]=2.0×10-20、 =1.6。
=1.6。
(1)NaOH的电子式为________ 。
(2)辉铋矿粉碎的目的是__________ 。
(3)可循环再利用物质的化学式为____________ 。
(4)“酸浸”中浸出Bi3+反应的化学方程式为Bi2S3+NaClO3+6HCl=2BiCl3+3S+NaCl+3H2O,反应中每生成16gS,转移电子数目为____ ,写出“酸浸”中浸出Fe3+的反应的离子方程式:____ 。
(5)若溶液中Fe3+、Cu2+的物质的量浓度均为0.01mol∙L-1,则当Fe3+沉淀完全时,Cu2+是否沉淀?_____________ 。(通过计算说明,当离子浓度小于1×10-5mol·L-1时,认为沉淀完全)

已知:Ksp[Bi(OH)3]=3.0×10-7、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Cu(OH)2]=2.0×10-20、
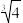 =1.6。
=1.6。(1)NaOH的电子式为
(2)辉铋矿粉碎的目的是
(3)可循环再利用物质的化学式为
(4)“酸浸”中浸出Bi3+反应的化学方程式为Bi2S3+NaClO3+6HCl=2BiCl3+3S+NaCl+3H2O,反应中每生成16gS,转移电子数目为
(5)若溶液中Fe3+、Cu2+的物质的量浓度均为0.01mol∙L-1,则当Fe3+沉淀完全时,Cu2+是否沉淀?
您最近一年使用:0次
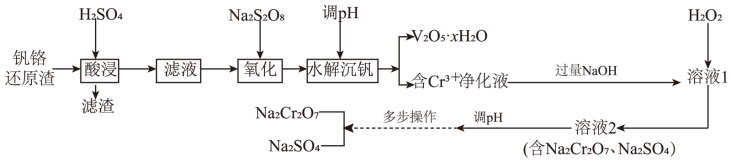
【推荐2】钒铬还原渣主要成分为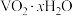 、
、 及少量的
及少量的 。一种初步分离钒铬还原渣中钒铬并获得
。一种初步分离钒铬还原渣中钒铬并获得 的工艺流程如图:
的工艺流程如图:
已知:①“酸浸”后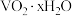 转化为
转化为 ;
;
② 的
的 近似为
近似为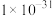 ;
;
③有关物质的溶解度(g/100g )如下表所示:
)如下表所示:
(1)“滤渣”为___________ (填化学式)。
(2)“氧化”后溶液中大量存在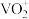 ,请写出相应的离子方程式:
,请写出相应的离子方程式:___________ 。
(3)常温下,若“含 净化液”中
净化液”中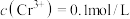 ,则“水解沉钒”调pH的范围是2.5≤pH<
,则“水解沉钒”调pH的范围是2.5≤pH<___________ 。
(4)向“溶液1”中加入 时温度不能过高的原因是
时温度不能过高的原因是___________ 。
(5)在“溶液2”中加入过盘稀硫酸调节pH后,采用石墨电极电解制备金属铬,请写出阴极电极反应程式:___________ 。
(6)“多步操作”包括___________ 、___________ 、冷却结晶、过滤、洗涤等步骤。
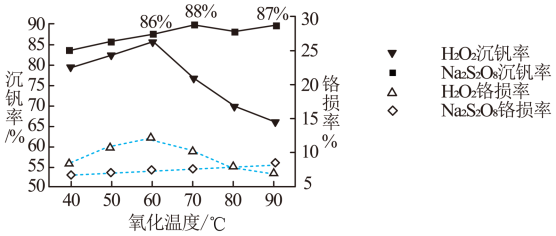
(7)研究温度对 与
与 的氧化—水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在90℃左右,降低温度能耗增加。由图可知,分别采用
的氧化—水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在90℃左右,降低温度能耗增加。由图可知,分别采用 、
、 进行“氧化”时,应选择的适宜温度是
进行“氧化”时,应选择的适宜温度是___________ 、___________ 。
(8)在工业生产中,钒铬还原渣中 含量为83%,采用本题中的最优工艺操作(过程中损失不计),则每吨钒铬还原渣可以制得
含量为83%,采用本题中的最优工艺操作(过程中损失不计),则每吨钒铬还原渣可以制得 的质量为
的质量为___________ kg(用含x的式子表示)。
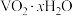 、
、 及少量的
及少量的 。一种初步分离钒铬还原渣中钒铬并获得
。一种初步分离钒铬还原渣中钒铬并获得 的工艺流程如图:
的工艺流程如图:
已知:①“酸浸”后
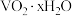 转化为
转化为 ;
;②
 的
的 近似为
近似为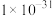 ;
;③有关物质的溶解度(g/100g
 )如下表所示:
)如下表所示:| 温度/℃ | 20 | 40 | 60 | 80 | 100 |
 | 183.6 | 215.1 | 269.2 | 376.4 | 415.0 |
 | 19.5 | 48.8 | 45.3 | 43.7 | 42.5 |
(1)“滤渣”为
(2)“氧化”后溶液中大量存在
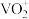 ,请写出相应的离子方程式:
,请写出相应的离子方程式:(3)常温下,若“含
 净化液”中
净化液”中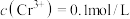 ,则“水解沉钒”调pH的范围是2.5≤pH<
,则“水解沉钒”调pH的范围是2.5≤pH<(4)向“溶液1”中加入
 时温度不能过高的原因是
时温度不能过高的原因是(5)在“溶液2”中加入过盘稀硫酸调节pH后,采用石墨电极电解制备金属铬,请写出阴极电极反应程式:
(6)“多步操作”包括
(7)研究温度对
 与
与 的氧化—水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在90℃左右,降低温度能耗增加。由图可知,分别采用
的氧化—水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在90℃左右,降低温度能耗增加。由图可知,分别采用 、
、 进行“氧化”时,应选择的适宜温度是
进行“氧化”时,应选择的适宜温度是
(8)在工业生产中,钒铬还原渣中
 含量为83%,采用本题中的最优工艺操作(过程中损失不计),则每吨钒铬还原渣可以制得
含量为83%,采用本题中的最优工艺操作(过程中损失不计),则每吨钒铬还原渣可以制得 的质量为
的质量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体( ):
):
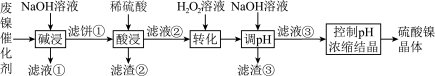
某温度下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“碱浸”中 的作用除了去除催化剂表面的油脂外,还具有作用是
的作用除了去除催化剂表面的油脂外,还具有作用是___________ (写一个化学方程式就可以)。为回收金属,通常用稀硫酸将“滤液①”调为中性,生成沉淀,该沉淀的化学式为___________ 。
(2)“滤液②”中含有的金属离子除了“ ”,还有
”,还有___________ 。
(3)“转化”中加入 的主要作用是
的主要作用是___________ (用离子方程式表示)。
(4)利用上述表格数据,计算 的
的
___________ (列出计算式即可,不用化简)。如果“转化”后的溶液中 浓度为
浓度为 ,则“调pH”应控制pH范围:
,则“调pH”应控制pH范围:___________ (填数值)。
 ):
):
某温度下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
开始沉淀时( )的pH )的pH | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时( )的pH )的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“碱浸”中
 的作用除了去除催化剂表面的油脂外,还具有作用是
的作用除了去除催化剂表面的油脂外,还具有作用是(2)“滤液②”中含有的金属离子除了“
 ”,还有
”,还有(3)“转化”中加入
 的主要作用是
的主要作用是(4)利用上述表格数据,计算
 的
的
 浓度为
浓度为 ,则“调pH”应控制pH范围:
,则“调pH”应控制pH范围:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】磁性氧化铁是生产颜料、抛光剂、录音磁带和电讯器材的重要原料。以高硫铝土矿(主要含Al2O3、Fe2O3、SiO2和少量的FeS2等)提取氧化铝和磁性氧化铁的流程如图:
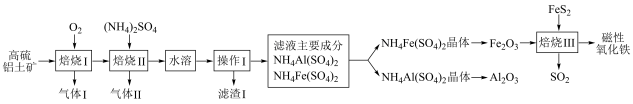
(1)基态Fe原子价层电子的轨道表示式(电子排布图)为______ ;基态Al原子电子占据最高能级的电子云轮廓图为______ 形;
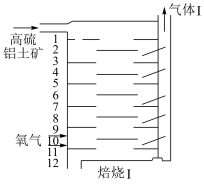
(2)“焙烧Ⅰ”过程中采用如图所示的“多层逆流焙烧”,“多层逆流焙烧”的优点是:______ (任答一点)。
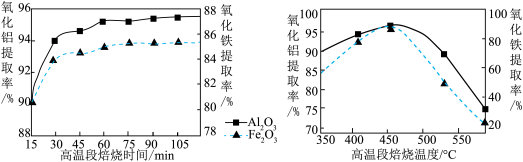
(3)焙烧Ⅱ由氧化铝、氧化铁制得可溶性的NH4Al(SO4)2、NH4Fe(SO4)2.提取率随温度、时间变化曲线如图所示,最佳的焙烧时间与温度是______ 。写出由氧化铝制得可溶性的NH4Al(SO4)2相关的化学反应方程式为______ 。
(4)写出“滤渣I”主要成分的一种用途______ 。
(5)“焙烧Ⅲ”在隔绝空气的条件下进行反应,理论上完全反应时参加反应的n(FeS2):n(Fe2O3)=______ 。
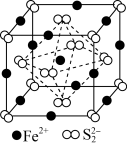
(6)FeS2晶体的晶胞结构如图所示。晶胞参数为apm,FeS2晶体的密度为ρg•cm−3,阿伏加德罗常数的值为NA,则FeS2的摩尔质量M=______ g⋅mol﹣1(用含a、ρ、NA的代数式表示)。

(1)基态Fe原子价层电子的轨道表示式(电子排布图)为
(2)“焙烧Ⅰ”过程中采用如图所示的“多层逆流焙烧”,“多层逆流焙烧”的优点是:

(3)焙烧Ⅱ由氧化铝、氧化铁制得可溶性的NH4Al(SO4)2、NH4Fe(SO4)2.提取率随温度、时间变化曲线如图所示,最佳的焙烧时间与温度是

(4)写出“滤渣I”主要成分的一种用途
(5)“焙烧Ⅲ”在隔绝空气的条件下进行反应,理论上完全反应时参加反应的n(FeS2):n(Fe2O3)=
(6)FeS2晶体的晶胞结构如图所示。晶胞参数为apm,FeS2晶体的密度为ρg•cm−3,阿伏加德罗常数的值为NA,则FeS2的摩尔质量M=

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】铁是目前用途最广、用量最大的金属。请回答下列问题。
(1)Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是____ ;分离提纯混有NaCl的Fe(OH)3胶体的方法是____ 。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:____ 。
(3)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如图方案:
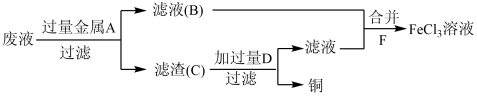
①滤渣C的化学式为____ 。
②试剂F宜选用____ (填选项序号),加入F的目的是____ 。
A.酸性KMnO4溶液 B.氯水 C.溴水
(4)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是____ 。
②实验证明溶液中含Fe3+,请进一步设计方案证明溶液中还含Fe2+____ (选用药品:酸性KMnO4溶液、氯水、KSCN溶液)。
③溶液组成的测定:取30.0 mL待测溶液,加入足量的AgNO3溶液,得25.83 g白色沉淀。则溶液中c(Cl-)=____ 。
(1)Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
(3)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如图方案:

①滤渣C的化学式为
②试剂F宜选用
A.酸性KMnO4溶液 B.氯水 C.溴水
(4)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是
②实验证明溶液中含Fe3+,请进一步设计方案证明溶液中还含Fe2+
③溶液组成的测定:取30.0 mL待测溶液,加入足量的AgNO3溶液,得25.83 g白色沉淀。则溶液中c(Cl-)=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】 的制取工艺及综合实验探究。
的制取工艺及综合实验探究。
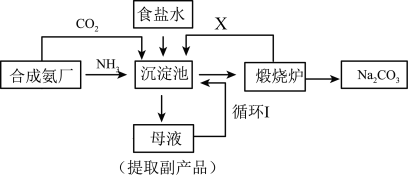
(1)我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下:
①往饱和食盐水中通入足量的 、足量的
、足量的 的先后顺序是
的先后顺序是___________________ 。
②沉淀池中和煅烧炉中所发生反应的化学方程式为____________________________________ ;____________________________________ 。
③从生产流程图可知,可循环利用的物质是________________ 。(写化学式)
(2)测定所得产品的组成和纯度
①检验纯碱样品中是否混有 :将样品溶于水,逐滴加入盐酸,产生气体的体积
:将样品溶于水,逐滴加入盐酸,产生气体的体积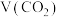 与加入盐酸的体积
与加入盐酸的体积 的关系如图所示(不计
的关系如图所示(不计 溶解)。回答以下问题:
溶解)。回答以下问题:
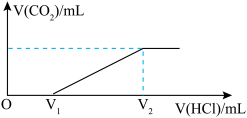
经测定,消耗盐酸的体积
____________ 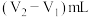 (填“>”、“<”、“=”),可以说明纯碱样品中确实混有
(填“>”、“<”、“=”),可以说明纯碱样品中确实混有 ;其中消耗盐酸的体积
;其中消耗盐酸的体积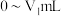 的过程中,所发生反应的离子方程式为
的过程中,所发生反应的离子方程式为______________________________ 。
②测定该纯碱样品的纯度:称取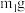 样品,置于小烧杯中,加水溶解,滴加足量
样品,置于小烧杯中,加水溶解,滴加足量 溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为
溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为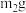 。则该纯碱样品的纯度(以
。则该纯碱样品的纯度(以 的质量分数进行计算)为
的质量分数进行计算)为_______________ 。(用含%的式子表示)
 的制取工艺及综合实验探究。
的制取工艺及综合实验探究。
(1)我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下:
①往饱和食盐水中通入足量的
 、足量的
、足量的 的先后顺序是
的先后顺序是②沉淀池中和煅烧炉中所发生反应的化学方程式为
③从生产流程图可知,可循环利用的物质是
(2)测定所得产品的组成和纯度
①检验纯碱样品中是否混有
 :将样品溶于水,逐滴加入盐酸,产生气体的体积
:将样品溶于水,逐滴加入盐酸,产生气体的体积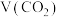 与加入盐酸的体积
与加入盐酸的体积 的关系如图所示(不计
的关系如图所示(不计 溶解)。回答以下问题:
溶解)。回答以下问题:
经测定,消耗盐酸的体积

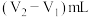 (填“>”、“<”、“=”),可以说明纯碱样品中确实混有
(填“>”、“<”、“=”),可以说明纯碱样品中确实混有 ;其中消耗盐酸的体积
;其中消耗盐酸的体积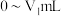 的过程中,所发生反应的离子方程式为
的过程中,所发生反应的离子方程式为②测定该纯碱样品的纯度:称取
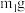 样品,置于小烧杯中,加水溶解,滴加足量
样品,置于小烧杯中,加水溶解,滴加足量 溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为
溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为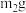 。则该纯碱样品的纯度(以
。则该纯碱样品的纯度(以 的质量分数进行计算)为
的质量分数进行计算)为
您最近一年使用:0次

 某兴趣小组研究
某兴趣小组研究 气体还原
气体还原 、
、 ,他们使用的药品和装置如图所示:
,他们使用的药品和装置如图所示: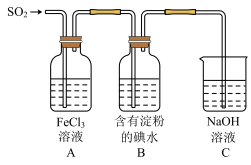
 填离子符号
填离子符号
 溶液与
溶液与