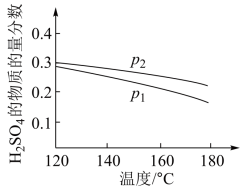
对反应:3SO2(g)+2H2O (g)=2H2SO4 (l)+S(s) ΔH2=−254 kJ·mol−1,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。p2___________ p 1(填“>”或“<”),得出该结论的理由是___________

2023高三·全国·专题练习 查看更多[1]
(已下线)04 常考题空4 平衡图像原因解释之温度、压强对平衡的影响 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
更新时间:2023-05-06 23:49:25
|
【知识点】 压强对化学平衡移动的影响解读
相似题推荐
填空题
|
适中
(0.65)
【推荐1】硫酸在国民经济中占有极其重要的地位,工业上常用黄铁矿为原料接触法制硫酸。
(1)写出黄铁矿(FeS2)在沸腾炉中与氧气发生反应的化学方程式_______ 。
(2)硫酸的生产中,下列说法不正确的是_______ 。
A.把黄铁矿磨成细粉末在“沸腾”状态下燃烧,可以提高原料的利用率
B.气体在进接触室前要先净化,可防止催化剂中毒
C.接触室中反应采用400-500°C,主要是因为提高原料的平衡转化率
D.吸收塔中操作采取逆的形式,SO3从下而上,水从上而喷下
(3)分别将1mol的SO2(g)、1.45mol的O2(g)通入p1、p2和p3恒压容器中发生反应: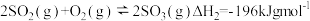 ,相同时间内测得SO2的转化率α随温度的变化如图所示。(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp如p(B)=px(B),p为平衡总压强,x(B为平衡系统中B的物质的量分数)。
,相同时间内测得SO2的转化率α随温度的变化如图所示。(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp如p(B)=px(B),p为平衡总压强,x(B为平衡系统中B的物质的量分数)。
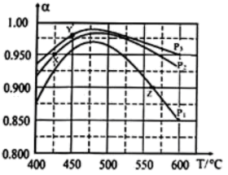
请回答:
①据图判断p1、p2、p3的大小关系_______ 。
②判断X、Y、Z中属于平衡点的是_______ (填“X”、 “Y”、 “Z”),并计算该温度下平衡的Kp=_______ 。(用含p1或p2或p3的式子表示)。
(4)为减少SO2的排放,工业上常将SO2转化为CaSO4固定,但存在CO又会同时发生以下两个反应:
①恒容、恒温(T1)条件下,反应体系中c(SO2)随时间t变化的总趋势如图。结合已知信息分析c(SO2)浓度随时间t变化的原因_______ 。
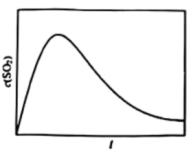
②恒容、恒温(T2,T2>T1)条件下,请在图中画出T2条件下c(SO2)浓度随时间t变化图_______ 。
(1)写出黄铁矿(FeS2)在沸腾炉中与氧气发生反应的化学方程式
(2)硫酸的生产中,下列说法不正确的是
A.把黄铁矿磨成细粉末在“沸腾”状态下燃烧,可以提高原料的利用率
B.气体在进接触室前要先净化,可防止催化剂中毒
C.接触室中反应采用400-500°C,主要是因为提高原料的平衡转化率
D.吸收塔中操作采取逆的形式,SO3从下而上,水从上而喷下
(3)分别将1mol的SO2(g)、1.45mol的O2(g)通入p1、p2和p3恒压容器中发生反应:
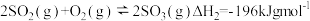 ,相同时间内测得SO2的转化率α随温度的变化如图所示。(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp如p(B)=px(B),p为平衡总压强,x(B为平衡系统中B的物质的量分数)。
,相同时间内测得SO2的转化率α随温度的变化如图所示。(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp如p(B)=px(B),p为平衡总压强,x(B为平衡系统中B的物质的量分数)。
请回答:
①据图判断p1、p2、p3的大小关系
②判断X、Y、Z中属于平衡点的是
(4)为减少SO2的排放,工业上常将SO2转化为CaSO4固定,但存在CO又会同时发生以下两个反应:
| 反应 | 活化能 | 平衡常数 | |
| I | 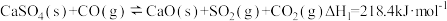 | EaI | KI |
| II | 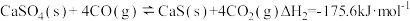 | EaII(EaII>EaI) | KII(KI>KII) |

②恒容、恒温(T2,T2>T1)条件下,请在图中画出T2条件下c(SO2)浓度随时间t变化图
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】(1)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入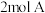 和
和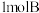 ,乙中充入
,乙中充入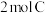 和
和 ,此时K停在0处。在一定条件下发生可逆反应:
,此时K停在0处。在一定条件下发生可逆反应: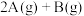

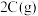 ;反应达到平衡后,再恢复至原温度。
;反应达到平衡后,再恢复至原温度。
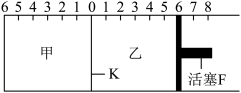
回答下列问题:
①可根据________ 现象来判断甲、乙中反应都已达到平衡。
②达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是_________ 。
(2)若一开始就将K、F固定,其它条件均同(1),则达到平衡时:
①甲、乙中C的物质的量的关系是甲__________ 乙(填“>”、“<”或“=” )。
②如果测得甲中A的转化率为b,则乙中C的转化率为____________ 。
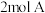 和
和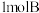 ,乙中充入
,乙中充入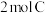 和
和 ,此时K停在0处。在一定条件下发生可逆反应:
,此时K停在0处。在一定条件下发生可逆反应: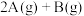

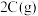 ;反应达到平衡后,再恢复至原温度。
;反应达到平衡后,再恢复至原温度。
回答下列问题:
①可根据
②达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是
(2)若一开始就将K、F固定,其它条件均同(1),则达到平衡时:
①甲、乙中C的物质的量的关系是甲
②如果测得甲中A的转化率为b,则乙中C的转化率为
您最近一年使用:0次

 Fe3O4(s)+4H2(g)在一可变的容积的密闭容器中进行,试回答:①增加Fe的量,其正反应速率的变化是
Fe3O4(s)+4H2(g)在一可变的容积的密闭容器中进行,试回答:①增加Fe的量,其正反应速率的变化是

