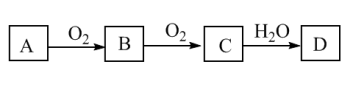
Ⅰ.非金属以其最低化合价与氢元素结合的化合物在常温常压下大多为气态,因此被称为气态氢化物。 、
、 、
、 都是我们学习过的常见气态氢化物。
都是我们学习过的常见气态氢化物。
(1)写出下列物质的电子式和结构式。
(2) 溶于水呈
溶于水呈___________ 性(填“酸”、“碱”或“中”),其电离方程式为___________ 。
(3)NH3可以使湿润的红色石蕊试纸变色,用化学方程式解释其原因:___________ 。请写出检验溶液中 的实验方法:
的实验方法:___________ 。
Ⅱ.1909年化学家哈伯在实验室首次用单质合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖。
(4)用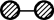 、
、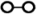 、
、 分别表示
分别表示 、
、 、
、 。观察下图,判断符合在催化剂表面合成氨反应过程的顺序为___________。
。观察下图,判断符合在催化剂表面合成氨反应过程的顺序为___________。

(5)氨是重要的工业产品和原料,如制取硝酸。请写出氨催化氧化的反应方程式:___________ 。
(6)中学化学实验室利用复分解反应来制备氨气,写出该反应的化学方程式:___________ 。
 、
、 、
、 都是我们学习过的常见气态氢化物。
都是我们学习过的常见气态氢化物。(1)写出下列物质的电子式和结构式。
| 物质 | N2 | H2S | NH3 |
| 电子式 | |||
| 结构式 |
(2)
 溶于水呈
溶于水呈(3)NH3可以使湿润的红色石蕊试纸变色,用化学方程式解释其原因:
 的实验方法:
的实验方法:Ⅱ.1909年化学家哈伯在实验室首次用单质合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖。
(4)用
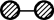 、
、 、
、 分别表示
分别表示 、
、 、
、 。观察下图,判断符合在催化剂表面合成氨反应过程的顺序为___________。
。观察下图,判断符合在催化剂表面合成氨反应过程的顺序为___________。
| A.②③④①⑤ | B.③②①④⑤ | C.③②④①⑤ | D.⑤④①②③ |
(6)中学化学实验室利用复分解反应来制备氨气,写出该反应的化学方程式:
更新时间:2023-05-26 10:06:56
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。请回答:
(1)软锰矿制备K2MnO4的化学方程式是_______________________ ;
(2)K2MnO4制备KMnO4的离子方程式是_______________ ;
(3)若用2.5g软锰矿(含MnO280%)进行上述实验,KMnO4的理论产量为_______________ ;
(4)KMnO4能与热的经硫酸酸化的Na2C2O4溶液反应生成Mn2+和CO2,该反应的化学方程式是________________________ ;
(5)上述制得KMnO4产品0.165g,恰好与0.335gNa2C2O4反应完全,该KMnO4的纯度为___________ 。
(1)软锰矿制备K2MnO4的化学方程式是
(2)K2MnO4制备KMnO4的离子方程式是
(3)若用2.5g软锰矿(含MnO280%)进行上述实验,KMnO4的理论产量为
(4)KMnO4能与热的经硫酸酸化的Na2C2O4溶液反应生成Mn2+和CO2,该反应的化学方程式是
(5)上述制得KMnO4产品0.165g,恰好与0.335gNa2C2O4反应完全,该KMnO4的纯度为
您最近一年使用:0次
【推荐2】氧化还原反应在物质的制备和转化中有重要的应用。
(1)碘酸钾(KIO3)是一种重要的食品添加剂,可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另一种化合物。
①写出该反应的化学方程式:_____ 。
②该反应中被氧化的I原子与被还原的I原子的物质的量之比为_____ 。
③每生成2molKIO3,该反应中转移电子的物质的量为_____ mol。
(2)一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”能快速溶于水,放出大量CO2,得到ClO2溶液.生成ClO2的化学方程式为5NaClO2+4NaHSO4=4ClO2+NaCl+4Na2SO4+2H2O。
①该反应的离子方程式为_____ 。
②该反应中氧化剂为_____ (填化学式,下同),还原剂为_____ 。
③用双线桥法表示该反应中电子转移的方向和数目:_____ 。
④产生CO2的离子方程式为_____ 。
(1)碘酸钾(KIO3)是一种重要的食品添加剂,可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另一种化合物。
①写出该反应的化学方程式:
②该反应中被氧化的I原子与被还原的I原子的物质的量之比为
③每生成2molKIO3,该反应中转移电子的物质的量为
(2)一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”能快速溶于水,放出大量CO2,得到ClO2溶液.生成ClO2的化学方程式为5NaClO2+4NaHSO4=4ClO2+NaCl+4Na2SO4+2H2O。
①该反应的离子方程式为
②该反应中氧化剂为
③用双线桥法表示该反应中电子转移的方向和数目:
④产生CO2的离子方程式为
您最近一年使用:0次
【推荐3】氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)下列表述中没有氧化还原反应发生的是_____ 。
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)NH3和Cl2反应的方程式为:NH3+Cl2﹣N2+HCl
①该反应中被氧化的元素是_____ (填元素名称),氧化剂是_____ (填化学式)。
②配平该方程式:_____ NH3+_____ Cl2=_____ N2+_____ HCl
(3)“地康法”制氯气的反应原理图示如下:

①反应I的化学方程式为_____ 。
②若要制得标准状况下氯气11.2L,则整个反应中转移电子的物质的量为_____ 。
(1)下列表述中没有氧化还原反应发生的是
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)NH3和Cl2反应的方程式为:NH3+Cl2﹣N2+HCl
①该反应中被氧化的元素是
②配平该方程式:
(3)“地康法”制氯气的反应原理图示如下:

①反应I的化学方程式为
②若要制得标准状况下氯气11.2L,则整个反应中转移电子的物质的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】氮元素的化合物种类繁多。请结合以下工业制硝酸的原理示意图回答含氮化合物的相关问题:

(1)与氮氧化物有关的全球性大气环境问题有_______(填字母序号)。
(2)下列有关NH3的说法,不正确的是_______(填字母序号)。
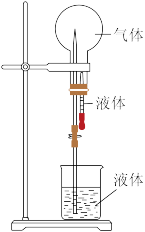
(3)如图是喷泉实验装置,在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有相同液体。下列组合能形成喷泉的是_______(填字母序号)。
(4)请写出氧化炉中反应的化学方程式_______ 。
(5)实验室制取NH3的化学方程式_______ ,检验氨气是否收集满的方法_______ 。

(1)与氮氧化物有关的全球性大气环境问题有_______(填字母序号)。
| A.酸雨 | B.沙尘暴 | C.光化学烟雾 | D.白色污染 |
| A.工业合成NH3属于人工固氮 | B.NH3可用来生产尿素等氮肥 |
| C.NH3可用浓硫酸或无水氯化钙干燥 | D.实验室用向下排空气法收集氨气 |

| A.HCl与水 | B.Cl2与饱和氯化钠溶液 |
| C.SO2与NaOH溶液 | D.CO2与水 |
(5)实验室制取NH3的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】结合所学内容,回答下列问题:
(1)氮元素及其化合物的转化关系如下:

①写出X的化学式:_______ ,Y的化学式:_______ 。
②图中所示,关于 转化为
转化为 的反应过程,下列说法正确的是
的反应过程,下列说法正确的是_______ 。
a.氮元素的化合价不发生变化
b.若用 与
与 反应制取
反应制取 ,另一种生成物可能是
,另一种生成物可能是
c.该转化过程中, 既是氧化剂,又是还原剂
既是氧化剂,又是还原剂
(2) 催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:

① 技术中的氧化剂为
技术中的氧化剂为_______ 。
②当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生反应,该反应的化学方程式为_______ 。
(3)某同学利用如图所示的装置,进行氨气的喷泉实验,回答下列问题:

①仪器A的名称是_______ 。
②写出实验室用NH4Cl和Ca(OH)2制取氨气的化学方程式:_______ 。
③喷泉实验前需要在仪器A中充满干燥的氨气,可用_______ (填“向上”或“向下”)排空气法收集氨气:可用_______ (填“浓硫酸”或“碱石灰”)干燥氨气。
④引发喷泉实验的操作是_______ 。
(1)氮元素及其化合物的转化关系如下:

①写出X的化学式:
②图中所示,关于
 转化为
转化为 的反应过程,下列说法正确的是
的反应过程,下列说法正确的是a.氮元素的化合价不发生变化
b.若用
 与
与 反应制取
反应制取 ,另一种生成物可能是
,另一种生成物可能是
c.该转化过程中,
 既是氧化剂,又是还原剂
既是氧化剂,又是还原剂(2)
 催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
①
 技术中的氧化剂为
技术中的氧化剂为②当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生反应,该反应的化学方程式为
(3)某同学利用如图所示的装置,进行氨气的喷泉实验,回答下列问题:

①仪器A的名称是
②写出实验室用NH4Cl和Ca(OH)2制取氨气的化学方程式:
③喷泉实验前需要在仪器A中充满干燥的氨气,可用
④引发喷泉实验的操作是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】按要求回答下列问题:
(1)实验室制备氨气,下列方法中可以选用的是_______ 。
a.固态氯化铵加热分解 b.浓氨水中加入固体氢氧化钠
c.加热浓氨水 d.固态氯化铵与氢氧化钙混合加热
(2)氯化铵溶液显酸性,用离子方程式表示呈酸性的原因_______ 。
(3)NH3常用于检验氯气管道是否泄漏,写出反应的化学方程式_______ 。
(4)将57.6克的铜投入200毫升的硝酸溶液中恰好反应完全,产生标准状况下的NO2、NO共1.4 mol。
①写出刚开始反应的化学方程式_______ ;
②求硝酸的浓度_______ mol·L-1;
③将生成的气体收集在大试管中,然后倒扣在水中,写出二氧化氮与水反应的化学方程式_______ ,若往试管中通入氧气让液体充满试管,则通入氧气的物质的量_______ mol。
(1)实验室制备氨气,下列方法中可以选用的是
a.固态氯化铵加热分解 b.浓氨水中加入固体氢氧化钠
c.加热浓氨水 d.固态氯化铵与氢氧化钙混合加热
(2)氯化铵溶液显酸性,用离子方程式表示呈酸性的原因
(3)NH3常用于检验氯气管道是否泄漏,写出反应的化学方程式
(4)将57.6克的铜投入200毫升的硝酸溶液中恰好反应完全,产生标准状况下的NO2、NO共1.4 mol。
①写出刚开始反应的化学方程式
②求硝酸的浓度
③将生成的气体收集在大试管中,然后倒扣在水中,写出二氧化氮与水反应的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】下图是氮的化合物的“价类二维图”。

(1)写出实验室制取氨气的化学方程式:___________ 。
(2)图中方框中的化学式为___________ ,一水合氨电离可使溶液显碱性,写出一水合氨的电离方程式:___________ 。
(3)写出 和
和 在加热催化剂条件下生成
在加热催化剂条件下生成 的化学方程式:
的化学方程式:___________ 。
(4)向盛有少量 溶液的试管中加入
溶液的试管中加入 溶液并加热,在试管口放一片湿润的红色石蕊试纸,实验现象是
溶液并加热,在试管口放一片湿润的红色石蕊试纸,实验现象是___________ 。
(5)将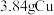 和稀硝酸充分反应,生成的气体体积为
和稀硝酸充分反应,生成的气体体积为___________ L(在标准状况下),用排水法收集该气体,将收集到的气体的试管倒立于水槽中缓缓通入___________ 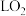 (标准状况)使
(标准状况)使 恰好完全反应,写出观察到的现象:
恰好完全反应,写出观察到的现象:___________ 。


(1)写出实验室制取氨气的化学方程式:
(2)图中方框中的化学式为
(3)写出
 和
和 在加热催化剂条件下生成
在加热催化剂条件下生成 的化学方程式:
的化学方程式:(4)向盛有少量
 溶液的试管中加入
溶液的试管中加入 溶液并加热,在试管口放一片湿润的红色石蕊试纸,实验现象是
溶液并加热,在试管口放一片湿润的红色石蕊试纸,实验现象是(5)将
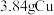 和稀硝酸充分反应,生成的气体体积为
和稀硝酸充分反应,生成的气体体积为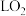 (标准状况)使
(标准状况)使 恰好完全反应,写出观察到的现象:
恰好完全反应,写出观察到的现象:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】化学在治理空气污染方面发挥着重要的作用。
Ⅰ.化石燃料的过度使用是导致酸雨的主要原因。研究表明, 、
、 形成酸雨时的转化关系如图所示:
形成酸雨时的转化关系如图所示:

(1) 的电离方程式为
的电离方程式为___________ 。
(2) 会被雨水吸收形成酸雨,这种酸雨在空气中久置酸性增强的原因是
会被雨水吸收形成酸雨,这种酸雨在空气中久置酸性增强的原因是___________ 。
Ⅱ. 、
、 等均为大气污染物,需处理后才能排放。
等均为大气污染物,需处理后才能排放。
(3)用氨水可以吸收 制取铵盐。
制取铵盐。
①实验室用固固加热法制取 的化学方程式为
的化学方程式为___________ 。
②用足量氨水吸收 的化学方程式为
的化学方程式为___________ 。
(4)利用 吸收液可在脱除烟气中
吸收液可在脱除烟气中 的同时脱除
的同时脱除 ,研究发现在不同的初始pH条件下,吸收液对流动烟气的脱硫效率都接近100%,而对NO的脱除率如下图所示。
,研究发现在不同的初始pH条件下,吸收液对流动烟气的脱硫效率都接近100%,而对NO的脱除率如下图所示。

 时,脱除
时,脱除 的离子方程式为
的离子方程式为___________ ;反应时间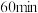 时,由图可知,
时,由图可知, 越小,
越小, 脱除率越小,原因是
脱除率越小,原因是___________ 。
Ⅰ.化石燃料的过度使用是导致酸雨的主要原因。研究表明,
 、
、 形成酸雨时的转化关系如图所示:
形成酸雨时的转化关系如图所示:
(1)
 的电离方程式为
的电离方程式为(2)
 会被雨水吸收形成酸雨,这种酸雨在空气中久置酸性增强的原因是
会被雨水吸收形成酸雨,这种酸雨在空气中久置酸性增强的原因是Ⅱ.
 、
、 等均为大气污染物,需处理后才能排放。
等均为大气污染物,需处理后才能排放。(3)用氨水可以吸收
 制取铵盐。
制取铵盐。①实验室用固固加热法制取
 的化学方程式为
的化学方程式为②用足量氨水吸收
 的化学方程式为
的化学方程式为(4)利用
 吸收液可在脱除烟气中
吸收液可在脱除烟气中 的同时脱除
的同时脱除 ,研究发现在不同的初始pH条件下,吸收液对流动烟气的脱硫效率都接近100%,而对NO的脱除率如下图所示。
,研究发现在不同的初始pH条件下,吸收液对流动烟气的脱硫效率都接近100%,而对NO的脱除率如下图所示。
 时,脱除
时,脱除 的离子方程式为
的离子方程式为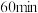 时,由图可知,
时,由图可知, 越小,
越小, 脱除率越小,原因是
脱除率越小,原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为____________ 。
②下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是_______ (填字母序号)。
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
(2)下表为某同学所测25℃时,甲、乙两种溶液的pH。
①甲溶液中的c(OH-) =___________ mol/L。
②25℃时,等体积的甲、乙两溶液与等浓度的盐酸反应,消耗的盐酸体积:甲_____ 乙。
③甲、乙溶液均加水稀释10倍后,所得溶液的pH:甲_____ 乙。
(3)已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度……今有HA、H2B、H3C三种弱酸,根据“较强酸 + 较弱酸盐 = 较强酸盐 + 较弱酸”的反应规律,它们之间能发生下列反应:
a.HA + HC2-(少量) = A-+ H2C-
b.H2B(少量) + 2A- = B2- + 2HA
c.H2B(少量) + H2C- = HB-+ H3C
回答下列问题:
①相同条件下,HA、H2B、H3C三种酸中,酸性最强的是_____________ 。
②下列反应的离子方程式正确的是____________ 。
A.H3C +3A- = 3HA + C3- B.HB- +A- = HA + B2-
③完成下列反应的离子方程式:
a.H3C + OH-(过量)——__________________ ;b.HA(过量) + C3- ——_____________________ 。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为
②下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
(2)下表为某同学所测25℃时,甲、乙两种溶液的pH。
| 甲 | 乙 | |
| pH | 11 | 11 |
| 溶液 | 氨水 | 氢氧化钠溶液 |
①甲溶液中的c(OH-) =
②25℃时,等体积的甲、乙两溶液与等浓度的盐酸反应,消耗的盐酸体积:甲
③甲、乙溶液均加水稀释10倍后,所得溶液的pH:甲
(3)已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度……今有HA、H2B、H3C三种弱酸,根据“较强酸 + 较弱酸盐 = 较强酸盐 + 较弱酸”的反应规律,它们之间能发生下列反应:
a.HA + HC2-(少量) = A-+ H2C-
b.H2B(少量) + 2A- = B2- + 2HA
c.H2B(少量) + H2C- = HB-+ H3C
回答下列问题:
①相同条件下,HA、H2B、H3C三种酸中,酸性最强的是
②下列反应的离子方程式正确的是
A.H3C +3A- = 3HA + C3- B.HB- +A- = HA + B2-
③完成下列反应的离子方程式:
a.H3C + OH-(过量)——
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】回答下列问题
(1)写出下列离子方程式:
①Ba(OH)2 在水溶液中电离:_______
②H2S 在水溶液中电离:_______
③NaHCO3 在水溶液中电离:_______
④NaHSO4 在水溶液中电离:_______
⑤少量 CO2 通入 NaClO 溶液中_______
⑥泡沫灭火器的原理:_______
(2)已知 NH3·H2O 的 Kb=1.8 ×10-5
①计算 0.10 mol/L 的 NH3·H2O 的 c(OH-)=_______ (可以不化简)。
②若向其中加入固体 NH4Cl,使 c(NH )的浓度达到 0.20 mol/L,计算c(OH-)=
)的浓度达到 0.20 mol/L,计算c(OH-)=_______ 。
(1)写出下列离子方程式:
①Ba(OH)2 在水溶液中电离:
②H2S 在水溶液中电离:
③NaHCO3 在水溶液中电离:
④NaHSO4 在水溶液中电离:
⑤少量 CO2 通入 NaClO 溶液中
⑥泡沫灭火器的原理:
(2)已知 NH3·H2O 的 Kb=1.8 ×10-5
①计算 0.10 mol/L 的 NH3·H2O 的 c(OH-)=
②若向其中加入固体 NH4Cl,使 c(NH
 )的浓度达到 0.20 mol/L,计算c(OH-)=
)的浓度达到 0.20 mol/L,计算c(OH-)=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】下表是几种常见弱酸的电离平衡常数(25℃),回答下列各题:
(1)当温度升高时,K值___________ (填“增大”、“减小”或“不变”);
(2)结合表中给出的电离常数回答下列问题:
①上述四种酸中,酸性最弱、最强的酸分别是___________ 、___________ (用化学式表示),
②下列能使醋酸溶液中 的电离程度增大,而电离平衡常数不变的操作是
的电离程度增大,而电离平衡常数不变的操作是___________ (填序号),
A.升高温度 B.加水稀释 C.加少量的 固体 D.加少量冰醋酸 E.加氢氧化钠固体
固体 D.加少量冰醋酸 E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式___________ 。
(3)已知草酸是一种二元弱酸,其电离常数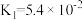 ,
, ,写出草酸的电离方程式
,写出草酸的电离方程式___________ 、___________ 。
| 酸 |  |  | HCN | HClO |
电离平衡常数( ) ) |  |  |  |  |
(2)结合表中给出的电离常数回答下列问题:
①上述四种酸中,酸性最弱、最强的酸分别是
②下列能使醋酸溶液中
 的电离程度增大,而电离平衡常数不变的操作是
的电离程度增大,而电离平衡常数不变的操作是A.升高温度 B.加水稀释 C.加少量的
 固体 D.加少量冰醋酸 E.加氢氧化钠固体
固体 D.加少量冰醋酸 E.加氢氧化钠固体③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式
(3)已知草酸是一种二元弱酸,其电离常数
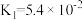 ,
, ,写出草酸的电离方程式
,写出草酸的电离方程式
您最近一年使用:0次