人们从化学反应中获取物质和能量,回答下列问题。
(1)已知:C(s,石墨)=C(s,金刚石)△H=+1.5kJ•mol-1,则稳定性:石墨_______ 金刚石(填“>”或“<”)。
(2)0.5L0.2mol/LHCl溶液与0.5L.0.25mol/LNaOH溶液完全反应,放出5.7kJ热量,通过该反应测得中和△H=_______ kJ•mol-1。
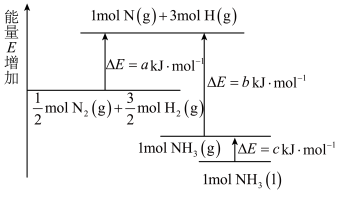
(3)合成氨反应的能量变化如图所示,由图可知,N-H键的键能(1mol气态分子离解成气态原子所吸收量,其单位为kJ•mol-1)为_______ kJ•mol-1,反应N2(g)+3H2(g)=2NH3(l)△H=_______ kJ•mol-1。
(4)电化学气敏传感器可用于监测空气中的HCHO,工作原理如图:
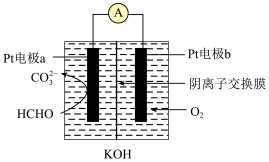
在该装置中Pt电极b为_______ (填“正极”或“负极”),OH-离子的移动方向为_______ (填“a→b”或“b→a”);Pt电极a发生的电极反应式为_______ 。反应一段时间后,该装置中KOH浓度会_______ (填“增大”、“减小”或“不变”)。
(1)已知:C(s,石墨)=C(s,金刚石)△H=+1.5kJ•mol-1,则稳定性:石墨
(2)0.5L0.2mol/LHCl溶液与0.5L.0.25mol/LNaOH溶液完全反应,放出5.7kJ热量,通过该反应测得中和△H=
(3)合成氨反应的能量变化如图所示,由图可知,N-H键的键能(1mol气态分子离解成气态原子所吸收量,其单位为kJ•mol-1)为

(4)电化学气敏传感器可用于监测空气中的HCHO,工作原理如图:

在该装置中Pt电极b为
更新时间:2023-05-31 08:06:37
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】碳酸锂在医疗上可用于治疗狂躁性精神病,作镇静剂等。电解铝废渣(主要含AlF3、LiF、NaF、CaO等)可用于制备Li2CO3。

已知:①20℃时,Ksp[Ca3(PO4)2]=2×10-29,Ksp(CaHPO4)=1×10-7,Ksp(CaSO4)=5×10-5。
②CaF2可溶于硫酸。
③Li2CO3的溶解度:0℃1.54g,20℃1.33g,80℃0.85g。
(1)在加热条件下“酸浸”,反应生成能腐蚀玻璃的气体,写出“酸浸”中AlF3发生反应的化学方程式:__ 。
(2)“滤渣”的主要成分是__ (填化学式)。
(3)“转化”后所得的LiHCO3溶液中含有的Ca2+需要加入Li3PO4稀溶液除去。“除钙”步骤中其他条件不变,反应相同时间,温度对除钙率和Li2CO3产率的影响如图1所示。
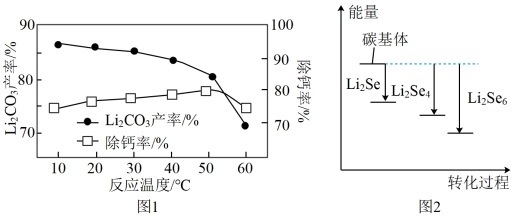
①随着温度的升高,Li2CO3的产率逐渐减小的原因是__ 。
②当温度高于50℃时,除钙率下降的原因可能是__ 。
(4)热分解后,获得Li2CO3的操作是先加热蒸发,然后__ 。
(5)锂硒电池是新一代全固态锂二次电池,具有优异的循环稳定性,其正极材料为附着硒化锂(Li2Sex)的碳基体。Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是__ 。
(6)对电解铝废水中Al3+含量的测定和处理是环境保护的重要课题。工业上常采用EDTA络合滴定法测定电解铝废水中的Al3+含量:取10.00mL电解铝废水置于250mL锥形瓶中,加入一定体积的柠檬酸,煮沸;再加入0.005mol·L-1的EDTA标准液20.00mL,调节溶液的pH至4.0,加热,冷却后用0.002mol·L-1的CuSO4标准液滴定至终点,消耗CuSO4标准液30.00mL。该矿业废水中Al3+的含量为___ mg·L-1。(已知:Cu2+、Al3+与EDTA反应的化学计量比均为1:1)

已知:①20℃时,Ksp[Ca3(PO4)2]=2×10-29,Ksp(CaHPO4)=1×10-7,Ksp(CaSO4)=5×10-5。
②CaF2可溶于硫酸。
③Li2CO3的溶解度:0℃1.54g,20℃1.33g,80℃0.85g。
(1)在加热条件下“酸浸”,反应生成能腐蚀玻璃的气体,写出“酸浸”中AlF3发生反应的化学方程式:
(2)“滤渣”的主要成分是
(3)“转化”后所得的LiHCO3溶液中含有的Ca2+需要加入Li3PO4稀溶液除去。“除钙”步骤中其他条件不变,反应相同时间,温度对除钙率和Li2CO3产率的影响如图1所示。

①随着温度的升高,Li2CO3的产率逐渐减小的原因是
②当温度高于50℃时,除钙率下降的原因可能是
(4)热分解后,获得Li2CO3的操作是先加热蒸发,然后
(5)锂硒电池是新一代全固态锂二次电池,具有优异的循环稳定性,其正极材料为附着硒化锂(Li2Sex)的碳基体。Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是
(6)对电解铝废水中Al3+含量的测定和处理是环境保护的重要课题。工业上常采用EDTA络合滴定法测定电解铝废水中的Al3+含量:取10.00mL电解铝废水置于250mL锥形瓶中,加入一定体积的柠檬酸,煮沸;再加入0.005mol·L-1的EDTA标准液20.00mL,调节溶液的pH至4.0,加热,冷却后用0.002mol·L-1的CuSO4标准液滴定至终点,消耗CuSO4标准液30.00mL。该矿业废水中Al3+的含量为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】碳的化合物在工业上应用广泛,下面有几种碳的化合物的应用:
(1)正戊烷异构化为异戊烷是油品升级的一项重要技术。正戊烷和异戊烷的部分性质如表:
由表中数据可知,稳定性:正戊烷_______ 异戊烷(填“>”或“=”或“<”)。
(2)用催化剂Fe3(CO)12/ZSM-5催化CO2加氢合成乙烯的反应,所得产物含CH4、C3H6、C4H8等副产物。催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表:
欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加_______ 助剂效果最好;从活化能对反应影响的角度说明加入该助剂能提高单位时间内乙烯产量的根本原因是_______ 。
(3)在密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S):n(CH4)=2:1,发生反应:CH4(g)+2H2S(g)⇌CS2(g)+4H2(g)。0.11MPa时,温度变化对平衡时产物的物质的量分数的影响如图甲所示:
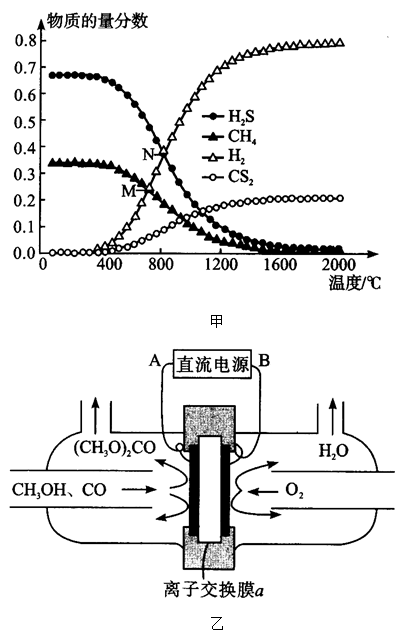
为提高H2S的平衡转化率,除改变温度外,还可采取的措施是____ (列举一条)。N点对应温度下,该反应的Kp=___ (MPa)2(Kp为以分压表示的平衡常数)。
(4)合成碳酸二甲酯的工作原理如图乙所示。阳极的电极反应式为__ ,离子交换膜a为___ (填“阳膜”、“阴膜”)。
(1)正戊烷异构化为异戊烷是油品升级的一项重要技术。正戊烷和异戊烷的部分性质如表:
| 名称 | 结构简式 | 熔点/℃ | 沸点/℃ | 燃烧热/kJ∙mol-1 |
| 正戊烷 | CH3CH2CH2CH2CH3 | -130 | 36 | 3506.1 |
| 异戊烷 | (CH3)2CHCH2CH3 | -159.4 | 27.8 | 3504.1 |
(2)用催化剂Fe3(CO)12/ZSM-5催化CO2加氢合成乙烯的反应,所得产物含CH4、C3H6、C4H8等副产物。催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表:
| 助剂 | CO2转化率(%) | 各产物在所有产物中的占比(%) | ||
| C2H4 | C3H6 | 其他 | ||
| Na | 42.5 | 35.9 | 39.6 | 24.5 |
| K | 27.2 | 75.6 | 22.8 | 1.6 |
| Cu | 9.8 | 80.7 | 12.5 | 6.8 |
(3)在密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S):n(CH4)=2:1,发生反应:CH4(g)+2H2S(g)⇌CS2(g)+4H2(g)。0.11MPa时,温度变化对平衡时产物的物质的量分数的影响如图甲所示:

为提高H2S的平衡转化率,除改变温度外,还可采取的措施是
(4)合成碳酸二甲酯的工作原理如图乙所示。阳极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】能源的开发、利用与人类社会的可持续发展息息相关,充分利用好能源是摆在人类面前的重大课题。
Ⅰ.已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=a kJ·mol-1
②CO(g)+l/2O2(g)=CO2(g) ΔH=b kJ·mol-1
③C(石墨)+O2(g)=CO2(g) ΔH=c kJ·mol-1
则反应4Fe(s)+3O2(g)=2Fe2O3(s)的焓变ΔH=______________ kJ·mol-1。
Ⅱ.依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是_____ (填序号)。
C(s)+CO2(g)=2CO(g) ΔH>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0
C.2H2O(l)=2H2(g)+O2(g) ΔH>0
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH<0
若以稀硫酸为电解质溶液,则该原电池的正极反应式为______________________ 。
Ⅲ.金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,充分燃烧时生成二氧化碳,反应中放出的热量如下图所示。

①在通常状况下,金刚石和石墨中________ (填“金刚石”或“石墨”)更稳定,石墨的燃烧热为________ 。
②12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量________ 。
Ⅰ.已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=a kJ·mol-1
②CO(g)+l/2O2(g)=CO2(g) ΔH=b kJ·mol-1
③C(石墨)+O2(g)=CO2(g) ΔH=c kJ·mol-1
则反应4Fe(s)+3O2(g)=2Fe2O3(s)的焓变ΔH=
Ⅱ.依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是
C(s)+CO2(g)=2CO(g) ΔH>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0
C.2H2O(l)=2H2(g)+O2(g) ΔH>0
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH<0
若以稀硫酸为电解质溶液,则该原电池的正极反应式为
Ⅲ.金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,充分燃烧时生成二氧化碳,反应中放出的热量如下图所示。

①在通常状况下,金刚石和石墨中
②12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】油气开采、石油化工、煤化工等行业的废气中普遍含有 ,需要对
,需要对 回收处理并加以利用。
回收处理并加以利用。
已知:①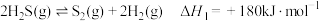
②
③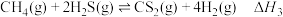
回答下列问题:
(1)反应③的
___________ 。
(2)下列叙述不能说明反应③达到平衡状态的是___________(填标号)。
(3)在不同温度、反应压强为 ,进料
,进料 的物质的量分数为
的物质的量分数为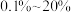 的条件下(其余为N2),对于反应①来说,H2S分解的平衡转化率与H2S的物质的量分数的关系如图1所示。则温度T1、T2、T3由大到小的顺序为
的条件下(其余为N2),对于反应①来说,H2S分解的平衡转化率与H2S的物质的量分数的关系如图1所示。则温度T1、T2、T3由大到小的顺序为___________ 。温度一定时,H2S的物质的量分数越大,H2S分解的平衡转化率越小,原因是___________ 。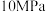 时,向恒压密闭容器中充入
时,向恒压密闭容器中充入 发生反应①,平衡时各组分的体积分数与温度的关系如图2所示。代表
发生反应①,平衡时各组分的体积分数与温度的关系如图2所示。代表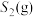 的是曲线
的是曲线___________ (填“I”“II”或“III”)。X点对应温度下,反应①的压强平衡常数
___________  。
。
(5)反应①的速率方程为 ,
,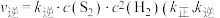 为速率常数)。
为速率常数)。
①某温度下,反应①的化学平衡常数K=10,k逆=3,则k正=___________ 。
②已知: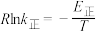 (式中,R为常数,
(式中,R为常数,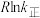 单位为
单位为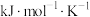 ,温度
,温度 单位为K,E正表示正反应的活化能,单位为kJ·mol-1)。Rlink正与不同催化剂(Catl、Cat2为催化剂)、温度(
单位为K,E正表示正反应的活化能,单位为kJ·mol-1)。Rlink正与不同催化剂(Catl、Cat2为催化剂)、温度( )关系如图3所示。相同条件下,催化效率较高的是
)关系如图3所示。相同条件下,催化效率较高的是___________ (填“Catl”或“Cat2”),判断依据是___________ 。在催化剂Cat2作用下,正反应的活化能为___________  。
。
 ,需要对
,需要对 回收处理并加以利用。
回收处理并加以利用。已知:①
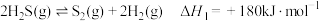
②

③
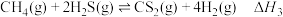
回答下列问题:
(1)反应③的

(2)下列叙述不能说明反应③达到平衡状态的是___________(填标号)。
A.断裂 键的同时断裂 键的同时断裂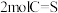 键 键 |
| B.恒容恒温条件下,反应体系的气体压强不再变化 |
| C.恒容条件下,反应体系的气体密度不再变化 |
D.反应速率: |
(3)在不同温度、反应压强为
 ,进料
,进料 的物质的量分数为
的物质的量分数为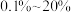 的条件下(其余为N2),对于反应①来说,H2S分解的平衡转化率与H2S的物质的量分数的关系如图1所示。则温度T1、T2、T3由大到小的顺序为
的条件下(其余为N2),对于反应①来说,H2S分解的平衡转化率与H2S的物质的量分数的关系如图1所示。则温度T1、T2、T3由大到小的顺序为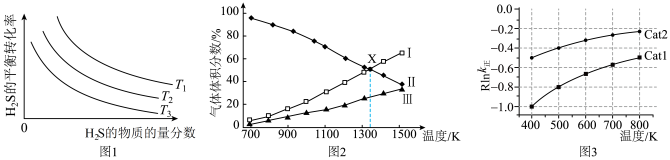
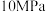 时,向恒压密闭容器中充入
时,向恒压密闭容器中充入 发生反应①,平衡时各组分的体积分数与温度的关系如图2所示。代表
发生反应①,平衡时各组分的体积分数与温度的关系如图2所示。代表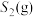 的是曲线
的是曲线
 。
。(5)反应①的速率方程为
 ,
,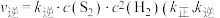 为速率常数)。
为速率常数)。①某温度下,反应①的化学平衡常数K=10,k逆=3,则k正=
②已知:
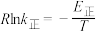 (式中,R为常数,
(式中,R为常数,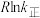 单位为
单位为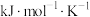 ,温度
,温度 单位为K,E正表示正反应的活化能,单位为kJ·mol-1)。Rlink正与不同催化剂(Catl、Cat2为催化剂)、温度(
单位为K,E正表示正反应的活化能,单位为kJ·mol-1)。Rlink正与不同催化剂(Catl、Cat2为催化剂)、温度( )关系如图3所示。相同条件下,催化效率较高的是
)关系如图3所示。相同条件下,催化效率较高的是 。
。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】氨的合成原理为:N2(g)+3H2(g)⇌2NH3(g)∆H=-92.4kJ·mol-1在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。回答下列问题:
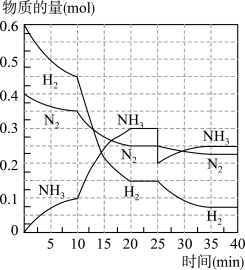
(1)10min内以NH3表示的平均反应速率为_________
(2)在10~20min内,NH3浓度变化的原因可能是_____________
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加NH3物质的量
(3)第1次平衡:平衡常数K1=__________ (带数据的表达式),第2次平衡时NH3的体积分数为_____________ 。
(4)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fc2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(l)⇌2NH3+1.5O2(g)∆H=akJ·mol-1,进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
①此合成反应的a______ 0,△S_______ 0;(填“>”、“<”或一”)
②已知N2(g)+3H2(g)⇌2NH3(g)∆H=-92.4kJ·mol-1,2 H2(g)+ O2(g)=2H2O(l) ∆H=-571.kJ·mol-1 则常温下氮气与水反应生成氨气与氧气的热化学方程式为_____________________________

(1)10min内以NH3表示的平均反应速率为
(2)在10~20min内,NH3浓度变化的原因可能是
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加NH3物质的量
(3)第1次平衡:平衡常数K1=
(4)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fc2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(l)⇌2NH3+1.5O2(g)∆H=akJ·mol-1,进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a
②已知N2(g)+3H2(g)⇌2NH3(g)∆H=-92.4kJ·mol-1,2 H2(g)+ O2(g)=2H2O(l) ∆H=-571.kJ·mol-1 则常温下氮气与水反应生成氨气与氧气的热化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】SO2的含量是衡最大气污染的一个重要指标,工业上常采用催化还原法或吸收法处理SO2。利用催化还原SO2不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。已知CH4和S的燃烧热(△H)分别为-890.3kJ/mol和-297.2kJ/mol,则CH4和SO2反应的热化学方程式为_____________ 。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
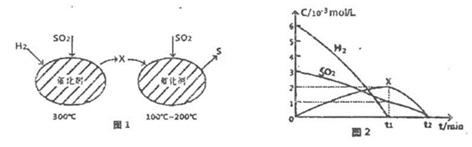
①分析可知X为______ (写化学式),0~t1时间段的温度为_____ ,0~t1时间段用SO2表示的化学反应速率为________ 。
②总反应的化学方程式为_____________ 。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g) S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
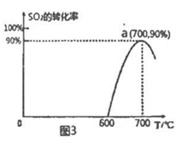
①该反应的△H____ 0(填“>”或“<”)。
②算a点的平衡常数为_________ 。
(4)工业上可用Na2SO3溶液吸收法处理SO2,25℃时用1mo/L的Na2SO3溶液吸收SO2。当溶液pH=7时,溶液中各离子浓度的大小关系为________ 。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。已知CH4和S的燃烧热(△H)分别为-890.3kJ/mol和-297.2kJ/mol,则CH4和SO2反应的热化学方程式为
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:

①分析可知X为
②总反应的化学方程式为
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)
 S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
①该反应的△H
②算a点的平衡常数为
(4)工业上可用Na2SO3溶液吸收法处理SO2,25℃时用1mo/L的Na2SO3溶液吸收SO2。当溶液pH=7时,溶液中各离子浓度的大小关系为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】Ⅰ. (1) 已知S4的结构式如图,反应S4(g) + 4Cl2(s )== 4SCl2(g) △H= - 4 kJ·mol-1,S—S键的键能为266 kJ·mol-1,S—Cl键的键能为255 kJ·mol-1,则1mol Cl2(g)分子中的化学键断裂时需要吸收的能量为_____ kJ。

Ⅱ. 工业上合成氯化亚砜反应:SO2(g)+ SCl2(g)+Cl2(s) 2SOCl2(g),该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。
2SOCl2(g),该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。

(2) 在373K时,向2L密闭容器中通入物质的量均为0.04 mol的SO2、SCl2与Cl2, 发生上述反应。测得其压强(p)随时间(t)的变化为下表中数据Ⅰ(平衡时的温度与起始温度相同)
①该反应的△H_____ 0(填“>”“<”或“=”)。
②反应开始至达到平衡时,v(SCl2)=__________ 。
③若只改变某一条件,测得其压强随时间的变化为表中数据Ⅱ,则改变的条件是_______________ 。
(3) 下图是某同学测定的上述反应的pK(pK= - lgK)与温度的变化关系图。
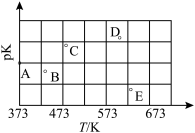
① A点的数值为_________ (已知lg4=0.6)。
②当升高到某一温度时,反应重新达到平衡,A点可能变化为______ 点。
Ⅲ. (4) 电解NO2制备NH4NO3,其工作原理如图所示。
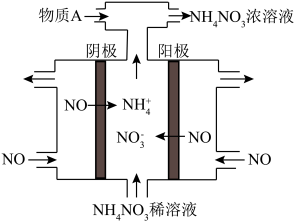
①阴极的电极反应式为_________________________ 。
②为使电解产物全部转化为NH4NO3,需补充某种物质A,则A的化学式为___________ 。

Ⅱ. 工业上合成氯化亚砜反应:SO2(g)+ SCl2(g)+Cl2(s)
 2SOCl2(g),该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。
2SOCl2(g),该反应中某一反应物的体积分数(以A%表示)随温度的变化关系如图所示。
(2) 在373K时,向2L密闭容器中通入物质的量均为0.04 mol的SO2、SCl2与Cl2, 发生上述反应。测得其压强(p)随时间(t)的变化为下表中数据Ⅰ(平衡时的温度与起始温度相同)
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| Ⅰ | 6.0p0 | 6.7 p0 | 6.1 p0 | 5.4 p0 | 5.0 p0 | 5.0 p0 |
| Ⅱ | 6.0 p0 | 7.0 p0 | 5.3 p0 | 5.0 p0 | 5.0 p0 | 5.0 p0 |
②反应开始至达到平衡时,v(SCl2)=
③若只改变某一条件,测得其压强随时间的变化为表中数据Ⅱ,则改变的条件是
(3) 下图是某同学测定的上述反应的pK(pK= - lgK)与温度的变化关系图。

① A点的数值为
②当升高到某一温度时,反应重新达到平衡,A点可能变化为
Ⅲ. (4) 电解NO2制备NH4NO3,其工作原理如图所示。

①阴极的电极反应式为
②为使电解产物全部转化为NH4NO3,需补充某种物质A,则A的化学式为
您最近一年使用:0次
【推荐2】CO2的过量排放会造成温室效应,CO2的固定可以有效的缓解这一问题。
已知键能数据如下表(单位:kJ/mol):
(1)在催化剂Ni—CeO2的作用下,CO2(g)和H2(g)反应生成CH4(g)和H2O(g),其反应历程如下图所示(吸附在催化剂表面的物种用*标注)。保持CO2与H2的体积比为1:4,反应气的总流量控制在40mL/min,通过320℃催化剂表面,反应未达到平衡状态。

①主反应生成甲烷,热化学方程式为_______ 。
②欲提高CH4产率,可采取的措施是_______ (写一种即可)。
③根据历程写出存在的副反应的化学方程式_______ 。
④测得CO2的转化率为80%,则CO2的反应速率为_______ mL/min。
(2)320℃时,将lmolCO2和4molH2混合于1L恒容密闭容器中,同时发生主副反应。
①下列说法可说明主副反应均已达到平衡状态的是_______ (填选项字母)。
A.容器内密度不再发生变化
B.容器内气体的平均摩尔质量不再发生变化
C.容器内压强不再发生变化
D.4v正(CO2)=v逆(H2)
E.容器内各物质的物质的量n(CO2):n(H2):n(CH4):n(H2O)=1:4:1:2
②平衡后测得c(H2O)=1.93mol/L,c(CH4)=0.95mol/L,主反应的平衡常数K=_______ (mol/L)-2(写出计算式,不用计算出结果)。
(3)可以利用直流光电池将CO2和H2O转化为HCOOH和O2,O2在_______ (填“阳极”或“阴极”)表面生成,通入CO2电极发生反应的电极反应为_______ 。
已知键能数据如下表(单位:kJ/mol):
| 共价键 | C=O | C—H | H—H | H—O |
| 键能 | 799 | 413 | 436 | 463 |
(1)在催化剂Ni—CeO2的作用下,CO2(g)和H2(g)反应生成CH4(g)和H2O(g),其反应历程如下图所示(吸附在催化剂表面的物种用*标注)。保持CO2与H2的体积比为1:4,反应气的总流量控制在40mL/min,通过320℃催化剂表面,反应未达到平衡状态。

①主反应生成甲烷,热化学方程式为
②欲提高CH4产率,可采取的措施是
③根据历程写出存在的副反应的化学方程式
④测得CO2的转化率为80%,则CO2的反应速率为
(2)320℃时,将lmolCO2和4molH2混合于1L恒容密闭容器中,同时发生主副反应。
①下列说法可说明主副反应均已达到平衡状态的是
A.容器内密度不再发生变化
B.容器内气体的平均摩尔质量不再发生变化
C.容器内压强不再发生变化
D.4v正(CO2)=v逆(H2)
E.容器内各物质的物质的量n(CO2):n(H2):n(CH4):n(H2O)=1:4:1:2
②平衡后测得c(H2O)=1.93mol/L,c(CH4)=0.95mol/L,主反应的平衡常数K=
(3)可以利用直流光电池将CO2和H2O转化为HCOOH和O2,O2在
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】碳、氮等元素及其化合物和人类生产、生活密切相关,请回答下列问题:
(1)氨催化氧化是硝酸工业的基础,生产过程中会发生以下反应:
主反应:
副反应:
①工业上往往采用物料比 在1.7—2.0之间,主要目的是
在1.7—2.0之间,主要目的是____________ 。
②下表所示是部分化学键的键能参数:
则拆开1mol NO中的化学键需要吸收的能量是__________ kJ。
(2)在一定温度下,向1L密闭恒容容器中充入l mol NO和一定物质的量的CO,在催化剂作用下发生反应:2NO (g)+2CO (g) 2CO2(g)+N2(g) ΔH>0,NO的物质10 s随反应时间t的变化曲线如图:
2CO2(g)+N2(g) ΔH>0,NO的物质10 s随反应时间t的变化曲线如图:

①前10 s内N2的平均生成速率为____ 。
②已知在t1时刻反应速率加快,则在t1时刻改变的条件可能是____ 。(填写一种)
(3)在723K时,将0.1mol H2和0.2mol CO2通入抽空的上述密闭容器中,发生如下反应:CO2(g)+H2(g) CO(g)+H2O(g),反应平衡后,水的物质的量分数为0.10。
CO(g)+H2O(g),反应平衡后,水的物质的量分数为0.10。
①CO2 的平衡转化率等于______ ,反应平衡常数K等于______ (保留两位有效数字)。
②再向容器中加入过量的CoO (s)和Co (s),则容器中又会增加如下平衡:CoO (s) +H2 (g) Co (s) +H2O(l)K1;CoO (s) +CO (g)
Co (s) +H2O(l)K1;CoO (s) +CO (g) Co (s) +CO2(g) K2。最后反应平衡时,容器中水的物质的量分数为0. 30,则K1等于
Co (s) +CO2(g) K2。最后反应平衡时,容器中水的物质的量分数为0. 30,则K1等于____ 。
(1)氨催化氧化是硝酸工业的基础,生产过程中会发生以下反应:
主反应:

副反应:

①工业上往往采用物料比
 在1.7—2.0之间,主要目的是
在1.7—2.0之间,主要目的是②下表所示是部分化学键的键能参数:
| 化学键 | N-N | O=O |
| 键能/kJ· mol-1 | 946 | 497.3 |
则拆开1mol NO中的化学键需要吸收的能量是
(2)在一定温度下,向1L密闭恒容容器中充入l mol NO和一定物质的量的CO,在催化剂作用下发生反应:2NO (g)+2CO (g)
 2CO2(g)+N2(g) ΔH>0,NO的物质10 s随反应时间t的变化曲线如图:
2CO2(g)+N2(g) ΔH>0,NO的物质10 s随反应时间t的变化曲线如图:
①前10 s内N2的平均生成速率为
②已知在t1时刻反应速率加快,则在t1时刻改变的条件可能是
(3)在723K时,将0.1mol H2和0.2mol CO2通入抽空的上述密闭容器中,发生如下反应:CO2(g)+H2(g)
 CO(g)+H2O(g),反应平衡后,水的物质的量分数为0.10。
CO(g)+H2O(g),反应平衡后,水的物质的量分数为0.10。①CO2 的平衡转化率等于
②再向容器中加入过量的CoO (s)和Co (s),则容器中又会增加如下平衡:CoO (s) +H2 (g)
 Co (s) +H2O(l)K1;CoO (s) +CO (g)
Co (s) +H2O(l)K1;CoO (s) +CO (g) Co (s) +CO2(g) K2。最后反应平衡时,容器中水的物质的量分数为0. 30,则K1等于
Co (s) +CO2(g) K2。最后反应平衡时,容器中水的物质的量分数为0. 30,则K1等于
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】《我在故宫修文物》这部纪录片里关于古代青铜器的修复引起了某研学小组的兴趣。“修旧如旧”是文物保护的主旨。
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。参与形成铜绿的物质有Cu和_______ 。
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈和有害锈,结构如图所示:
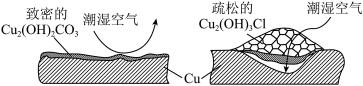
Cu2(OH)2CO3和Cu2(OH)3Cl分别属于无害锈和有害锈,请解释原因_____________ 。
(3)文献显示有害锈的形成过程中会产生CuCl(白色不溶于水的固体),请结合下图回答:
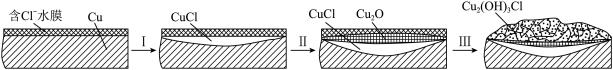
① 过程Ⅰ的正极反应物是___________ 。
② 过程Ⅰ负极的电极反应式是_____________ 。
(4)青铜器的修复有以下三种方法:
ⅰ.柠檬酸浸法:将腐蚀文物直接放在2%-3%的柠檬酸溶液中浸泡除锈;
ⅱ.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)2CO3;
ⅲ.BTA保护法:
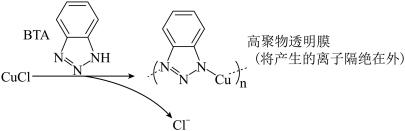
请回答下列问题:
①写出碳酸钠法的离子方程式___________________ 。
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有___________ 。
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl-,能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。参与形成铜绿的物质有Cu和
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈和有害锈,结构如图所示:

Cu2(OH)2CO3和Cu2(OH)3Cl分别属于无害锈和有害锈,请解释原因
(3)文献显示有害锈的形成过程中会产生CuCl(白色不溶于水的固体),请结合下图回答:

① 过程Ⅰ的正极反应物是
② 过程Ⅰ负极的电极反应式是
(4)青铜器的修复有以下三种方法:
ⅰ.柠檬酸浸法:将腐蚀文物直接放在2%-3%的柠檬酸溶液中浸泡除锈;
ⅱ.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)2CO3;
ⅲ.BTA保护法:

请回答下列问题:
①写出碳酸钠法的离子方程式
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl-,能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】化学能在一定条件下能够转化为电能,构成原电池。
(1)根据构成原电池的本质判断,如下反应可以设计成原电池的是(填序号)______ 。
A.NaOH+HCl=NaCl+H2O B.Na2CO3+2HCl=2NaCl+H2O+CO2↑
C.2H2O=2H2↑+O2↑ D.Cu+2AgNO3=2Ag+Cu(NO3)2
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验。有关实验现象,下列说法正确的是:_______ (填序号)
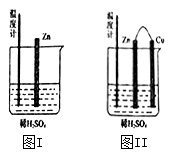
A.图I和图II的气泡均产生在锌棒表面
B.图II中产生气体的速度比I快
C.图I中温度计的示数高于图II的示数
D.图I和图II中温度计的示数相等,且均高于室温
(3)大气污染越来越成为人们关注的问题.烟气中的NOx必须脱除(即脱硝)后才能排放。已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=一890.3kJ·mol-l
N2(g)+O2(g)=2NO(g) △H=+180kJ·mol-1
CH4可用于脱硝,写出该反应热化学反应式________ 。
(4)如图是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极反应式为:__________ 。
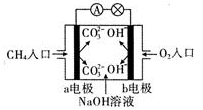
②电池工作一段时间后电解质溶液的pH________ (填“增大”“减小”或“不变”)。
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池。试写出该电池的正极反应式_________ 。
(1)根据构成原电池的本质判断,如下反应可以设计成原电池的是(填序号)
A.NaOH+HCl=NaCl+H2O B.Na2CO3+2HCl=2NaCl+H2O+CO2↑
C.2H2O=2H2↑+O2↑ D.Cu+2AgNO3=2Ag+Cu(NO3)2
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验。有关实验现象,下列说法正确的是:
A.图I和图II的气泡均产生在锌棒表面
B.图II中产生气体的速度比I快
C.图I中温度计的示数高于图II的示数
D.图I和图II中温度计的示数相等,且均高于室温

(3)大气污染越来越成为人们关注的问题.烟气中的NOx必须脱除(即脱硝)后才能排放。已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=一890.3kJ·mol-l
N2(g)+O2(g)=2NO(g) △H=+180kJ·mol-1
CH4可用于脱硝,写出该反应热化学反应式
(4)如图是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极反应式为:

②电池工作一段时间后电解质溶液的pH
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃料电池。试写出该电池的正极反应式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。T℃时反应
2SO2(g)+O2(g) 2SO3(g)过程中的能量变化如图所示,回答下列问题。
2SO3(g)过程中的能量变化如图所示,回答下列问题。
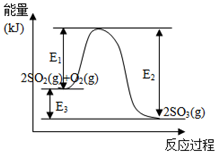
(1)T℃时将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol,则达到平衡时SO2的转化率为_______ ,反应放出_____________ 热量。(用E1、E2或E3表示)
(2)下列叙述能证明该反应已达化学平衡状态的是__________________ (填序号)
①SO2的体积分数不再发生变化
②容器内压强不再发生变化
③容器内气体原子总数不再发生变化
④相同时间内消耗2n molSO2的同时生成n molO2
⑤相同时间内消耗2n molSO2的同时生成2n molSO3
(3)在反应体系中加入催化剂,反应速率增大, E3的变化是: E3____________ (填“增大”“减小”或“不变”)
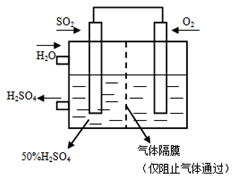
(4)若以下图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应。写出通SO2电极的电极反应式:______________ 。
(5) SOCl2是一种无色液体,可与碳共同构成锂电池的正极材料,且其放电时也有SO2气体产生。写出SOCl2在电池中放电时的电极反应式_________________ 。
2SO2(g)+O2(g)
 2SO3(g)过程中的能量变化如图所示,回答下列问题。
2SO3(g)过程中的能量变化如图所示,回答下列问题。
(1)T℃时将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol,则达到平衡时SO2的转化率为
(2)下列叙述能证明该反应已达化学平衡状态的是
①SO2的体积分数不再发生变化
②容器内压强不再发生变化
③容器内气体原子总数不再发生变化
④相同时间内消耗2n molSO2的同时生成n molO2
⑤相同时间内消耗2n molSO2的同时生成2n molSO3
(3)在反应体系中加入催化剂,反应速率增大, E3的变化是: E3
(4)若以下图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应。写出通SO2电极的电极反应式:

(5) SOCl2是一种无色液体,可与碳共同构成锂电池的正极材料,且其放电时也有SO2气体产生。写出SOCl2在电池中放电时的电极反应式
您最近一年使用:0次



