完成下列问题。
(1)硅是重要的半导体材料,构成了现代电子工业的基础。碳和硅的有关化学键键能如表所示,简要分析和解释下列有关事实:
硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___________ 。SiH4的稳定性小于CH4,更易生成氧化物,原因是___________ 。
(2)比较NH3和[Cu(NH3)4]2+中H−N−H键角的大小:NH3___________ [Cu(NH3)4]2+(填“>”或“<”),并说明理由:___________
(3)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为_______ ,下列对XeF2中心原子杂化方式推断合理的是_______ (填标号)。
A.sp B.sp2 C.sp3 D.sp3d
(4)苯胺( )与甲苯(
)与甲苯(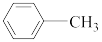 )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是_______ 。
(5)硒的两种含氧酸的酸分别为 、
、 ,试比较其酸性强弱并说明原因:
,试比较其酸性强弱并说明原因:___________ 。
(6)在水中的溶解度,吡啶(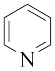 )远大于苯,主要原因是①
)远大于苯,主要原因是①_______ ,②_______ 。
(1)硅是重要的半导体材料,构成了现代电子工业的基础。碳和硅的有关化学键键能如表所示,简要分析和解释下列有关事实:
| 化学键 | C−C | C−H | C−O | Si−Si | Si−H | Si−O |
| 键能/ (kJ·mol-1) | 365 | 413 | 336 | 226 | 318 | 452 |
(2)比较NH3和[Cu(NH3)4]2+中H−N−H键角的大小:NH3
(3)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为
A.sp B.sp2 C.sp3 D.sp3d
(4)苯胺(
 )与甲苯(
)与甲苯(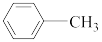 )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是(5)硒的两种含氧酸的酸分别为
 、
、 ,试比较其酸性强弱并说明原因:
,试比较其酸性强弱并说明原因:(6)在水中的溶解度,吡啶(
 )远大于苯,主要原因是①
)远大于苯,主要原因是①
更新时间:2023-07-01 08:13:11
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】该反应曾用于检测司机是否酒后驾驶:2Cr2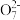 +3CH3CH2OH+16H++13H2O=4[Cr(H2O)6]3++3CH3COOH
+3CH3CH2OH+16H++13H2O=4[Cr(H2O)6]3++3CH3COOH
(1)基态Cr3+的核外电子排布式为_______ ;配合离子[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是_______ (填元素符号)。
(2)CH3COOH中C原子的杂化轨道类型为_______ 和_______ ;1molCH3COOH分子中含有σ键的数目为_______ 。
(3)H2O与CH3CH2OH可以任意比例互溶,原因是_______ 、_______ (回答两点)。
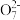 +3CH3CH2OH+16H++13H2O=4[Cr(H2O)6]3++3CH3COOH
+3CH3CH2OH+16H++13H2O=4[Cr(H2O)6]3++3CH3COOH(1)基态Cr3+的核外电子排布式为
(2)CH3COOH中C原子的杂化轨道类型为
(3)H2O与CH3CH2OH可以任意比例互溶,原因是
您最近一年使用:0次
【推荐2】按要求回答下列问题:
(1)C、Be、Cl、Fe等元素及其化合物有重要的应用。
①查表得知,Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为_______ (填离子或共价)化合物。
(2)镍元素基态原子的价电子排布式为_______ ;3d能级上的未成对电子数为______ 。
(3)科学发现,C和Ni、Mg元素的原子形成的晶体也具有超导性,其晶胞的结构特点如图,则该化合物的化学式为______ ,C、Ni、Mg三种元素中,电负性最大的是______ 。

(1)C、Be、Cl、Fe等元素及其化合物有重要的应用。
①查表得知,Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为
(2)镍元素基态原子的价电子排布式为
(3)科学发现,C和Ni、Mg元素的原子形成的晶体也具有超导性,其晶胞的结构特点如图,则该化合物的化学式为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】氨硼烷是一种有效、安全固体储氢材料,氨硼烷的结构和乙烷相似,如下图。
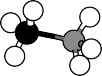
(1)氨硼烷的晶体类型为_______ 。
(2)氨硼烷分子中氮原子、硼原子的杂化轨道类型分别为_______ ,_______
(3)氨硼烷晶体中存在的作用力有_______ (填序号)
A离子键 B极性键 C非极性键 D配位键 E金属键 F氢键 G范德华力
(4)以NaBH4为硼源、某配合物为氨源可用于制备氨硼烷.为测定该配合物的结构,取2.32g配合物进行如下实验:用重量法分析金属元素,测得镍元素的质量为0.59g;在碱性条件下加热蒸出NH3,用滴定法测出其物质的量为0.06mol;滴加过量硝酸银溶液,有白色沉淀生成,加热,沉淀没有增加;用摩尔法分析含量,测得氯元素质量为0.71g。
①该配合物中镍离子的基态电子排布式为_______ 。
②该配合物的结构简式为_______ 。

(1)氨硼烷的晶体类型为
(2)氨硼烷分子中氮原子、硼原子的杂化轨道类型分别为
(3)氨硼烷晶体中存在的作用力有
A离子键 B极性键 C非极性键 D配位键 E金属键 F氢键 G范德华力
(4)以NaBH4为硼源、某配合物为氨源可用于制备氨硼烷.为测定该配合物的结构,取2.32g配合物进行如下实验:用重量法分析金属元素,测得镍元素的质量为0.59g;在碱性条件下加热蒸出NH3,用滴定法测出其物质的量为0.06mol;滴加过量硝酸银溶液,有白色沉淀生成,加热,沉淀没有增加;用摩尔法分析含量,测得氯元素质量为0.71g。
①该配合物中镍离子的基态电子排布式为
②该配合物的结构简式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】GaN是研制微电子器件、光电子器件的第三代半导体材料。
(1)基态Ga的核外电子排布为 ,转化为下列激发态时所需能量最少的是_______(填标号)。
,转化为下列激发态时所需能量最少的是_______(填标号)。
(2)与家同主族的B具有缺电子性,硼氢化钠( )是有机合成中重要的还原剂,其阴离子
)是有机合成中重要的还原剂,其阴离子 的立体构型为
的立体构型为_______ 。另一种含硼的阴离子 的结构如图所示,其中B原子的杂化方式为
的结构如图所示,其中B原子的杂化方式为_______ 。_______ (填“共价”或“离子”)化合物,它们的晶体结构与金刚石相似,其熔点如下表所示,试分析GaN、CaP、GaAs熔点依次降低的原因:_______ 。
(4)GaAs的晶胞结构如图甲所示,将Mn掺杂到GaAs的晶体中得到稀磁性半导体材料如图乙所示。 ,
, 表示阿伏加德罗常数的值,则晶胞中距离最近的两个Ga原子间距离为
表示阿伏加德罗常数的值,则晶胞中距离最近的两个Ga原子间距离为_______ nm(列出计算式)。
②图乙中掺杂Mn之后,晶体中Mn、Ga、As的原子个数比为_______ 。
(1)基态Ga的核外电子排布为
 ,转化为下列激发态时所需能量最少的是_______(填标号)。
,转化为下列激发态时所需能量最少的是_______(填标号)。A. | B. |
C. | D. |
(2)与家同主族的B具有缺电子性,硼氢化钠(
 )是有机合成中重要的还原剂,其阴离子
)是有机合成中重要的还原剂,其阴离子 的立体构型为
的立体构型为 的结构如图所示,其中B原子的杂化方式为
的结构如图所示,其中B原子的杂化方式为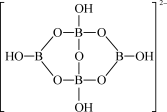
| 物质 | GaN | CaP | GaAs |
| 熔点/℃ | 1700 | 1480 | 1238 |
(4)GaAs的晶胞结构如图甲所示,将Mn掺杂到GaAs的晶体中得到稀磁性半导体材料如图乙所示。
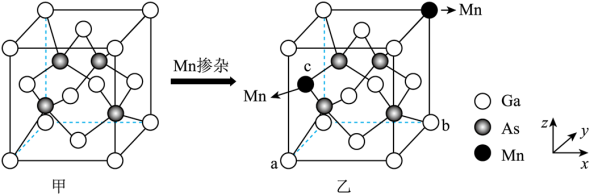
 ,
, 表示阿伏加德罗常数的值,则晶胞中距离最近的两个Ga原子间距离为
表示阿伏加德罗常数的值,则晶胞中距离最近的两个Ga原子间距离为②图乙中掺杂Mn之后,晶体中Mn、Ga、As的原子个数比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】氨硼烷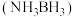 含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)基态N原子的价电子轨道表示式为_______ ,基态N原子中电子占据最高能级的电子云轮廓图为_______ 形; 分子中存在配位键,提供空轨道的原子是
分子中存在配位键,提供空轨道的原子是_______ ,分子中的N原子杂化方式为_______ 。
(2)B元素在周期表中的位置_______ ,B的第一电离能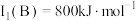 ,判断
,判断
_______ 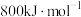 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3) 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性 。在H、B、N三种元素中:电负性由大到小的顺序是
。在H、B、N三种元素中:电负性由大到小的顺序是_______ 。
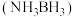 含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:(1)基态N原子的价电子轨道表示式为
 分子中存在配位键,提供空轨道的原子是
分子中存在配位键,提供空轨道的原子是(2)B元素在周期表中的位置
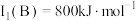 ,判断
,判断
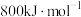 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)
 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性 。在H、B、N三种元素中:电负性由大到小的顺序是
。在H、B、N三种元素中:电负性由大到小的顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均采用虚线表示。________________________ 。
(2)Cu2+还能与NH3、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有__________ (填序号)。
A.配位键 B.离子键 C.极性共价键 D.非极性共价键
②已知[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为_______________ 。
(3)实验证明,用蒸汽密度法测得的H2O的相对分子质量比用化学式计算出来的相对分子质量要大,其原因是_____________________________ 。
(4)向硫酸铜水溶液中逐滴加入氨水直至过量,反应的离子方程式为______________________ 。

(2)Cu2+还能与NH3、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有
A.配位键 B.离子键 C.极性共价键 D.非极性共价键
②已知[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
(3)实验证明,用蒸汽密度法测得的H2O的相对分子质量比用化学式计算出来的相对分子质量要大,其原因是
(4)向硫酸铜水溶液中逐滴加入氨水直至过量,反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】回答下列问题:

(1)H2Se的沸点低于H2O,其原因是_______ 。
(2)关于I~III三种反应物,下列说法正确的有_______ 。
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有sp与sp2
E.I~III含有的元素中,O电负性最大
(3)IV中具有孤对电子的原子有_______ 。
(4)硒的两种含氧酸的酸性强弱为H2SeO4_______ H2SeO3(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(Na2SeO4)可减轻重金属铊引起的中毒。SeO 的立体构型为
的立体构型为_______ 。

(1)H2Se的沸点低于H2O,其原因是
(2)关于I~III三种反应物,下列说法正确的有
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有sp与sp2
E.I~III含有的元素中,O电负性最大
(3)IV中具有孤对电子的原子有
(4)硒的两种含氧酸的酸性强弱为H2SeO4
 的立体构型为
的立体构型为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】C、N、O、S、Mg、Fe等是中学化学中的常见元素。按要求回答下列问题:
(1)N元素在元素周期表中的位置是______________ 。
(2) H2S的沸点比H2O的沸点低的主要原因是__________________ 。
(3)已知:2 SO2(g) +O2(g)- 2 SO3(g) △H=-196.6 kJ·mol-l
2 SO3(g) △H=-196.6 kJ·mol-l
2 NO(g) +O2(g) 2 NO2(g) AH="-113.0" kJ·mol-l
2 NO2(g) AH="-113.0" kJ·mol-l
则反应NO2(g) +SO2(g) SO3(g)+NO(g)的△H=
SO3(g)+NO(g)的△H=___________ kJ·mol-l
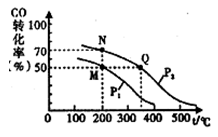
(4)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2 H2(g) CH3OH(g),在2L密闭容器中充人lmol CO与2 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。则M、N、Q三点的平衡常数KM、KN、Ko的大小关系为
CH3OH(g),在2L密闭容器中充人lmol CO与2 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。则M、N、Q三点的平衡常数KM、KN、Ko的大小关系为_______ ;Pl_______ P2(填“>、<或=”);平衡常数KM=__________ 。
(5) Mg和Fe组成的合金是目前已发现的储氢密度最(高的储氢材料之一,其晶胞结构如图甲(白球代表Mg,黑球代表Fe)。则该合金的化学式为____________ 。若该合金用M表示,某种储氢镍电池(MH - Ni电池)的结构如图乙所示。其电池反应为:MH+NiOOH Ni( OH)2 +M。下列有关说法不正确的是
Ni( OH)2 +M。下列有关说法不正确的是________ 。
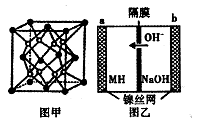
A.放电时正极反应为:NiOOH+H2O+e-= Ni(OH)2 +OH-
B.放电时电子由b极到a极
C.充电时负极反应为:MH+ OH- - e-= H20+M
D.M的储氢密度越大,电池的比能量越高
(1)N元素在元素周期表中的位置是
(2) H2S的沸点比H2O的沸点低的主要原因是
(3)已知:2 SO2(g) +O2(g)-
 2 SO3(g) △H=-196.6 kJ·mol-l
2 SO3(g) △H=-196.6 kJ·mol-l2 NO(g) +O2(g)
 2 NO2(g) AH="-113.0" kJ·mol-l
2 NO2(g) AH="-113.0" kJ·mol-l则反应NO2(g) +SO2(g)
 SO3(g)+NO(g)的△H=
SO3(g)+NO(g)的△H=(4)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2 H2(g)
 CH3OH(g),在2L密闭容器中充人lmol CO与2 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。则M、N、Q三点的平衡常数KM、KN、Ko的大小关系为
CH3OH(g),在2L密闭容器中充人lmol CO与2 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。则M、N、Q三点的平衡常数KM、KN、Ko的大小关系为
(5) Mg和Fe组成的合金是目前已发现的储氢密度最(高的储氢材料之一,其晶胞结构如图甲(白球代表Mg,黑球代表Fe)。则该合金的化学式为
 Ni( OH)2 +M。下列有关说法不正确的是
Ni( OH)2 +M。下列有关说法不正确的是
A.放电时正极反应为:NiOOH+H2O+e-= Ni(OH)2 +OH-
B.放电时电子由b极到a极
C.充电时负极反应为:MH+ OH- - e-= H20+M
D.M的储氢密度越大,电池的比能量越高
您最近一年使用:0次



