二硫化碳用于制造人造丝、杀虫剂、促进剂等,也用作溶剂。回答下列问题:
(1)下列反应的焓变及平衡常数如下:
(Ⅰ)


(Ⅱ)
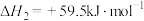
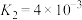
(Ⅲ)
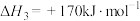
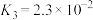
(Ⅳ)
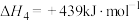

①反应(Ⅳ)自发进行的条件是_______ (填字母)。
A.高温 B.低温 C.任意温度
②
_______  ;
;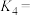
_______ 。
(2)硫化氢替代硫黄生产二硫化碳的原理为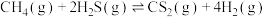 ,起始时,
,起始时,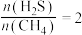 。在100 kPa压强下测得不同温度时的平衡组成如图1所示,在不同压强下测得的平衡组成如图2所示:
。在100 kPa压强下测得不同温度时的平衡组成如图1所示,在不同压强下测得的平衡组成如图2所示:

①该反应的
_______ 0(填“>”或“<”);图2中a、d代表的物质分别是_______ 、_______ 。
②图1中,X点H2S的转化率为_______ %。
③为提高该反应中H2S的平衡转化率,除改变温度和压强外,还可采取的措施是_______ 。
(1)下列反应的焓变及平衡常数如下:
(Ⅰ)



(Ⅱ)

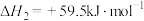
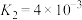
(Ⅲ)

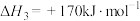
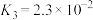
(Ⅳ)

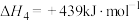

①反应(Ⅳ)自发进行的条件是
A.高温 B.低温 C.任意温度
②

 ;
;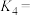
(2)硫化氢替代硫黄生产二硫化碳的原理为
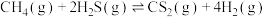 ,起始时,
,起始时,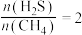 。在100 kPa压强下测得不同温度时的平衡组成如图1所示,在不同压强下测得的平衡组成如图2所示:
。在100 kPa压强下测得不同温度时的平衡组成如图1所示,在不同压强下测得的平衡组成如图2所示:
①该反应的

②图1中,X点H2S的转化率为
③为提高该反应中H2S的平衡转化率,除改变温度和压强外,还可采取的措施是
更新时间:2023-08-14 15:00:56
|
相似题推荐
【推荐1】乙二醇(沸点:197.3℃)是一种重要的基础化工原料。由煤基合成气(主要成分CO、H2)与氧气先制备得到草酸二甲酯(沸点:164.5℃),再加氢间接合成乙二醇,具有反应条件温和、环境污染小等优点。反应过程如下:
反应I:4NO(g)+4CH3OH(g)+O2(g) 4CH3ONO(g)+2H2O(g) △H1 =a kJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 =a kJ·mol-1
反应II:2CO(g)+2CH3ONO(g) CH3OOCCOOCH3(l) + 2NO(g) △H2=b kJ·mol-1
CH3OOCCOOCH3(l) + 2NO(g) △H2=b kJ·mol-1
反应III:CH3OOCCOOCH3(1)+4H2(g) HOCH2CH2OH(1)+2CH3OH(g) △H3 =c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g) △H3 =c kJ·mol-1
请回答下列问题:
(1)煤基合成气间接合成乙二醇的总热化学方程式是_____________________________ ,已知该反应在较低温条件下能自发进行。说明该反应的△H ______ 0(填“>”“<”或“=”)。
(2)CO、CH3ONO各0.4mol在恒温、容积恒定为2 L的密闭容器中发生反应II,达到平衡时CO的体积分数与NO的体积分数相等,计算该反应的化学平衡常数K=_____________ 。若此时向容器中再通入0.4 mol NO,一段时间后,达到新平衡时NO 的体积分数与原平衡时相比______ (填“增大”“相等”“减小”或“不能确定”)。
(3)温度改变对反应II的催化剂活性有影响,评价催化剂的活性参数——空时收率和CO的选择性可表示如下:
空 时收率=CH3OOCCOOCH3质量/反应时间×催化剂的体积
CO的选择性=合成[CH3OOCCOOCH3所消耗的CO的物质的量/反应掉的CO 的物质的量]×100%
在不同温度下,某学习小组对四组其他条件都相同的反应物进行研究,经过相同时间th,测得空时收率、CO的选择性数据如下表所示。
下列说法正确的是________ (填字母代号)。
A.温度升高,空时收率先增大后减小,说明△H2>0
B.温度升高,催化剂活性逐渐减弱,对CO 的选择性逐渐降低
C.综合考虑空时收率和CO的选择性,工业生成CH3OOCCOOCH3时,选择140℃效果最好
D.130℃时,CO的选择性最高,说明CO生成CH3OOCCOOCH3的转化率最高
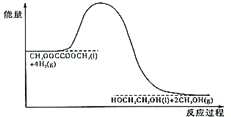
(4)120℃、常压时,CH3OOCCOOCH3 +4H2 HOCH2CH2OH+2CH3OH 反应过程中的能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中的能量变化图。
HOCH2CH2OH+2CH3OH 反应过程中的能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中的能量变化图。________
(5)研究证实,乙二醇、氧气可以在碱性溶液中形成燃料电池,负极的电极反应式是________________ 。
反应I:4NO(g)+4CH3OH(g)+O2(g)
 4CH3ONO(g)+2H2O(g) △H1 =a kJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 =a kJ·mol-1反应II:2CO(g)+2CH3ONO(g)
 CH3OOCCOOCH3(l) + 2NO(g) △H2=b kJ·mol-1
CH3OOCCOOCH3(l) + 2NO(g) △H2=b kJ·mol-1反应III:CH3OOCCOOCH3(1)+4H2(g)
 HOCH2CH2OH(1)+2CH3OH(g) △H3 =c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g) △H3 =c kJ·mol-1请回答下列问题:
(1)煤基合成气间接合成乙二醇的总热化学方程式是
(2)CO、CH3ONO各0.4mol在恒温、容积恒定为2 L的密闭容器中发生反应II,达到平衡时CO的体积分数与NO的体积分数相等,计算该反应的化学平衡常数K=
(3)温度改变对反应II的催化剂活性有影响,评价催化剂的活性参数——空时收率和CO的选择性可表示如下:
空 时收率=CH3OOCCOOCH3质量/反应时间×催化剂的体积
CO的选择性=合成[CH3OOCCOOCH3所消耗的CO的物质的量/反应掉的CO 的物质的量]×100%
在不同温度下,某学习小组对四组其他条件都相同的反应物进行研究,经过相同时间th,测得空时收率、CO的选择性数据如下表所示。
| 反应温度(℃) | 空时收率(g·mL-1·h-1) | CO的选择性(%) |
| 130 | 0.70 | ①72.5 |
| 140 | 0.75 | ②71.0 |
| 150 | 0.71 | ③55.6 |
| 160 | 0.66 | ④63.3 |
A.温度升高,空时收率先增大后减小,说明△H2>0
B.温度升高,催化剂活性逐渐减弱,对CO 的选择性逐渐降低
C.综合考虑空时收率和CO的选择性,工业生成CH3OOCCOOCH3时,选择140℃效果最好
D.130℃时,CO的选择性最高,说明CO生成CH3OOCCOOCH3的转化率最高
(4)120℃、常压时,CH3OOCCOOCH3 +4H2
 HOCH2CH2OH+2CH3OH 反应过程中的能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中的能量变化图。
HOCH2CH2OH+2CH3OH 反应过程中的能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中的能量变化图。
(5)研究证实,乙二醇、氧气可以在碱性溶液中形成燃料电池,负极的电极反应式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】中科院“大气灰霾追因与控制”项目针对北京强霾过程进行分析,强霾过程中,出现了大量有毒有害的含氮有机颗粒物。燃煤和机动车尾气是氮氧化物的主要来源。现在对其中的一些气体进行了一定的研究:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式___________ 。
(2)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环。T ℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程中NO的物质的量随时间变化如图所示。

①写出该反应的化学方程式___________ 。
②10 min内该反应的速率v(N2)=___________ ;T ℃时该化学反应的平衡常数K=___________ 。
③若该反应ΔH<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是___________ 。

④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,能判断反应已达到化学平衡状态的是___________ 。
a.容器中压强不再变化 b.CO2的浓度不再改变
c.2v正(NO)=v逆(N2) d.气体的密度保持不变
(3)一定温度下,用水吸收SO2气体时,若得到pH=4的H2SO3溶液,试计算溶液中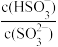 =
=___________ 。SO2可用足量小苏打溶液吸收,反应的离子方程式是___________ 。(已知该温度下,H2SO3的电离常数:K1=4.5×10-2,K2=2.5×10-7,H2CO3的电离常数K1=8.4×10-7,K2=1.2×10-10)
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式
(2)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环。T ℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程中NO的物质的量随时间变化如图所示。

①写出该反应的化学方程式
②10 min内该反应的速率v(N2)=
③若该反应ΔH<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是

④一定温度下,在恒容密闭容器中充入一定量NO和CO进行该反应,能判断反应已达到化学平衡状态的是
a.容器中压强不再变化 b.CO2的浓度不再改变
c.2v正(NO)=v逆(N2) d.气体的密度保持不变
(3)一定温度下,用水吸收SO2气体时,若得到pH=4的H2SO3溶液,试计算溶液中
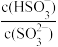 =
=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】氮的固定意义重大,氮肥的使用大面积提高了粮食产量。
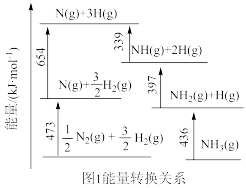
(1)目前人工固氮最有效的方法是合成氨。
根据图1数据计算反应 的
的
________  。
。
(2)400℃时,合成氨反应的化学平衡常数K=0.5,在2L的容器进行反应,一段时间后,测得 、
、 、
、 的物质的量分别为4mol、2mol、4mol,则此时反应
的物质的量分别为4mol、2mol、4mol,则此时反应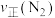
________ 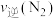 (填“>”“<”“=”或“不能确定”)
(填“>”“<”“=”或“不能确定”)
(3)合成氨中需要的氢气可以通过将水蒸气与红热的炭反应: 在一定温度下、容积不变的密闭容器中,发生该反应,达到平衡状态的标志是
在一定温度下、容积不变的密闭容器中,发生该反应,达到平衡状态的标志是________ (填序号)
①CO的生成速率与CO的消耗速率相等
②单位时间内有2amolO-H键断裂的同时有amolH-H键形成
③混合气体的密度不再改变
④炭的质量不再改变
⑤ 、
、 、CO的浓度之比为1:1:1
、CO的浓度之比为1:1:1
自然界中的固氮反应是将 转化为含氮氧化物。在100kPa时,反应
转化为含氮氧化物。在100kPa时,反应 中NO的平衡转化率与温度的关系曲线如图2,反应
中NO的平衡转化率与温度的关系曲线如图2,反应 中
中 的平衡转化率与温度的关系曲线如图3。
的平衡转化率与温度的关系曲线如图3。

(4)图2中A、B、C三点表示不同温度、压强下 达到平衡时NO的转化率,则
达到平衡时NO的转化率,则________ 点对应的压强最大。
(5)100kPa、25℃时, 平衡体系中
平衡体系中 的物质的量分数为
的物质的量分数为________ , 的分压
的分压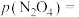
________ kPa,列式计算平衡常数
________ ( 用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(1)目前人工固氮最有效的方法是合成氨。
根据图1数据计算反应
 的
的
 。
。
(2)400℃时,合成氨反应的化学平衡常数K=0.5,在2L的容器进行反应,一段时间后,测得
 、
、 、
、 的物质的量分别为4mol、2mol、4mol,则此时反应
的物质的量分别为4mol、2mol、4mol,则此时反应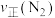
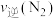 (填“>”“<”“=”或“不能确定”)
(填“>”“<”“=”或“不能确定”)(3)合成氨中需要的氢气可以通过将水蒸气与红热的炭反应:
 在一定温度下、容积不变的密闭容器中,发生该反应,达到平衡状态的标志是
在一定温度下、容积不变的密闭容器中,发生该反应,达到平衡状态的标志是①CO的生成速率与CO的消耗速率相等
②单位时间内有2amolO-H键断裂的同时有amolH-H键形成
③混合气体的密度不再改变
④炭的质量不再改变
⑤
 、
、 、CO的浓度之比为1:1:1
、CO的浓度之比为1:1:1自然界中的固氮反应是将
 转化为含氮氧化物。在100kPa时,反应
转化为含氮氧化物。在100kPa时,反应 中NO的平衡转化率与温度的关系曲线如图2,反应
中NO的平衡转化率与温度的关系曲线如图2,反应 中
中 的平衡转化率与温度的关系曲线如图3。
的平衡转化率与温度的关系曲线如图3。
(4)图2中A、B、C三点表示不同温度、压强下
 达到平衡时NO的转化率,则
达到平衡时NO的转化率,则(5)100kPa、25℃时,
 平衡体系中
平衡体系中 的物质的量分数为
的物质的量分数为 的分压
的分压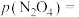

 用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】CO2可用于制备CH4、合成气(CO、H2),是CO2资源化利用的重要途径。
(1)CO2甲烷化过程可能发生反应:
i.
ii.
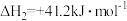
iii.
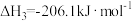
△H1=_______  。
。
(2)利用CO、 合成甲醇的反应为
合成甲醇的反应为
 ,向密闭容器中充入1molCO和
,向密闭容器中充入1molCO和 ,发生反应,测得CO的平衡转化率数据与温度、压强的对应关系如下表所示:
,发生反应,测得CO的平衡转化率数据与温度、压强的对应关系如下表所示:
①由此可知,P1_______ P2(填“大于”或“小于”)。有利于提高CO平衡转化率的措施是_______ 。
②P2kPa、250℃条件下,反应5min达到平衡,此时H2的物质的量为_______ ,该反应的压强平衡常数Kp=_______ (kPa)2(用分压代替浓度,分压=总压×该组分物质的量分数,用P2的式子表示)。
(1)CO2甲烷化过程可能发生反应:
i.

ii.

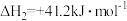
iii.

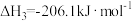
△H1=
 。
。(2)利用CO、
 合成甲醇的反应为
合成甲醇的反应为
 ,向密闭容器中充入1molCO和
,向密闭容器中充入1molCO和 ,发生反应,测得CO的平衡转化率数据与温度、压强的对应关系如下表所示:
,发生反应,测得CO的平衡转化率数据与温度、压强的对应关系如下表所示:温度/℃ 转化率 压强/kPa | 50 | 100 | 150 | 200 | 250 | 300 |
| P1 | 0.82 | 0.70 | 0.34 | 0.12 | 0.04 | 0.02 |
| P2 | 0.90 | 0.86 | 0.76 | 0.48 | 0.20 | 0.10 |
①由此可知,P1
②P2kPa、250℃条件下,反应5min达到平衡,此时H2的物质的量为
您最近一年使用:0次
【推荐2】随着现代工业的发展和人们生活水平的提高,大气中氮氧化物污染越来越多,如何处理氮氧化物污染,变废为宝成为当前研究的主要课题。请回答下列问题:
(1)已知:在25℃、101kPa下,由最稳定的单质生成1mol物质的反应焓变,叫作该物质的标准摩尔生成焓,规定稳定单质的标准摩尔生成焓为0.下表为常见几种物质的标准摩尔生成焓的数值。
则反应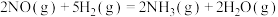

___________ kJ·mol-1,该反应在___________ (填“低温”“高温”或“任何温度”)下能够自发进行。
(2)工业上常用甲烷消除氮氧化物的污染,生成物为常见的大气成分,在两种不同温度下(T1,T2均大于100℃),向2L固定体积的密闭容器中分别加入0.8molCH4、1.4molNO2和催化剂,测得甲烷物质的量随反应时间的变化如图所示:___________ T2 (填“>”“<”或“=”),该反应的正反应为___________ (填“吸热”或“放热”)反应。
②温度为T2时,0~20min内用NO2表示的平均反应速率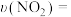
___________ mol·L-1·min-1。
③T2时,该反应的正反应化学平衡常数数值为___________ 。
(3)为了减少汽车尾气的污染,科学家设计在排气管中安装一种高效催化剂,反应原理为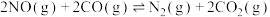 。
。
①在恒温、恒容密闭容器中进行上述反应,下列能表明反应达到平衡状态的是___________ (填标号)。
A.
B.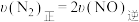
C.混合气体的密度不随时间变化
D.混合气体的平均摩尔质量不随时间变化
②若将上述反应设计为原电池,则通入CO的电极名称为___________ ;NO电极在酸性条件下的电极反应式为___________ 。
(1)已知:在25℃、101kPa下,由最稳定的单质生成1mol物质的反应焓变,叫作该物质的标准摩尔生成焓,规定稳定单质的标准摩尔生成焓为0.下表为常见几种物质的标准摩尔生成焓的数值。
| 物质 |  |  |  |  | 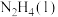 |
| 标准摩尔生成焓/(kJ·mol-1) | 91.3 | -241.8 | 0 | -46.0 | 50.6 |

(2)工业上常用甲烷消除氮氧化物的污染,生成物为常见的大气成分,在两种不同温度下(T1,T2均大于100℃),向2L固定体积的密闭容器中分别加入0.8molCH4、1.4molNO2和催化剂,测得甲烷物质的量随反应时间的变化如图所示:
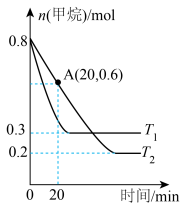
②温度为T2时,0~20min内用NO2表示的平均反应速率
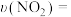
③T2时,该反应的正反应化学平衡常数数值为
(3)为了减少汽车尾气的污染,科学家设计在排气管中安装一种高效催化剂,反应原理为
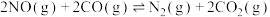 。
。①在恒温、恒容密闭容器中进行上述反应,下列能表明反应达到平衡状态的是
A.

B.
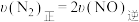
C.混合气体的密度不随时间变化
D.混合气体的平均摩尔质量不随时间变化
②若将上述反应设计为原电池,则通入CO的电极名称为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:
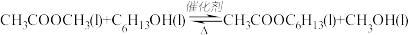
已知v正=k正χ(CH3COOCH3)·χ(C6H13OH),v逆=k逆χ(CH3COOC6H13)·χ(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,χ为备组分的物质的量分数。
(1)反应开始时,己醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的
_______ 0(填>或<)。348K时,以物质的量分数表示的化学平衡常数KX=________ (保留2位有效数字)。
在曲线①、②、③中,k正—k逆值最小的曲线是______________ ;A、B、C、D四点中,v正最小的是_____________ ,v逆最大的是_________________ 。
(2)343K时,乙酸甲酯和己醇按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比__________ 时,乙酸甲酯转化率最大;与按2:1投料相比,按1:2投料时化学平衡常数KX_____________ (填增大、减小或不变)。
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法不正确的是_______
a.参与了醇解反应,但并不改变反应历程 b.使k正和k逆增大相同倍数
c.降低了醇解反应的活化能 d.提高乙酸甲酯的平衡转化率
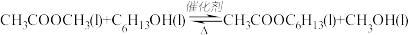
已知v正=k正χ(CH3COOCH3)·χ(C6H13OH),v逆=k逆χ(CH3COOC6H13)·χ(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,χ为备组分的物质的量分数。
(1)反应开始时,己醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的

在曲线①、②、③中,k正—k逆值最小的曲线是
(2)343K时,乙酸甲酯和己醇按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法不正确的是
a.参与了醇解反应,但并不改变反应历程 b.使k正和k逆增大相同倍数
c.降低了醇解反应的活化能 d.提高乙酸甲酯的平衡转化率
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】某温度下,在一个 2L 的密闭容器中,X、Y、Z 三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:
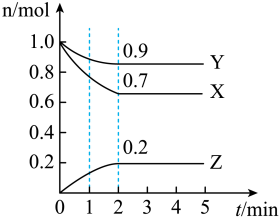
(1)从开始至 2min,Y 的平均反应速率为____ 。
(2)该反应的化学方程式为____ 。
(3)1min 时,ν(逆)____ ν(正),3min 时,ν(正)____ ν(逆) (填“大于”或“小于”或“等于”) 。
(4)上述反应在甲、乙两个相同容器内同时进行,分别测得甲中 v(X)=9mol•L-1min-1,乙中 v(Y)=0.5mol•L-1s-1,则____ 中反应更快。
(5) 若 X、Y、Z 均为气体(容器体积不变),下列能说明反应已达平衡的是____ 。
a.X、Y、Z 三种气体的浓度不再改变
b.气体混合物物质的量不再改变
c.反应已经停止
d.反应速率 v(X)∶v(Y)=3∶1
e.单位时间内消耗 X 的物质的量∶单位时间内消耗 Z 的物质的量=3∶2
f.混合气体的密度不随时间变化

(1)从开始至 2min,Y 的平均反应速率为
(2)该反应的化学方程式为
(3)1min 时,ν(逆)
(4)上述反应在甲、乙两个相同容器内同时进行,分别测得甲中 v(X)=9mol•L-1min-1,乙中 v(Y)=0.5mol•L-1s-1,则
(5) 若 X、Y、Z 均为气体(容器体积不变),下列能说明反应已达平衡的是
a.X、Y、Z 三种气体的浓度不再改变
b.气体混合物物质的量不再改变
c.反应已经停止
d.反应速率 v(X)∶v(Y)=3∶1
e.单位时间内消耗 X 的物质的量∶单位时间内消耗 Z 的物质的量=3∶2
f.混合气体的密度不随时间变化
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】甲醇是一种很好的清洁燃料,CO和H2在一定条件下反应可制得甲醇:CO(g)+2H2(g) CH3OH(g) ΔH。回答下列问题:
CH3OH(g) ΔH。回答下列问题:
(1)已知CO(g)、H2(g)、CH3OH(g)的燃烧热ΔH分别为-283.0kJ·mol-1、-285.8kJ·mol-1、-726.5kJ·mol-1,则反应CO(g)+2H2(g) CH3OH(g)的ΔH=
CH3OH(g)的ΔH=_______ kJ·mol-1。
(2)在容积可变的密闭容器中充入1mol CO(g)和2mol H2(g)生成CH3OH(g),H2的平衡转化率随温度(T)、压强(p)的变化如图所示。

①该反应的ΔS_______ 0(填“<”“>”或“=”,下同),图中的T1_______ T2。
②当达到平衡状态A时,容器的体积为2L,此时该反应的平衡常数K=_______ 。若达到平衡状态B时,则容器的体积V(B)=_______ L。
(3)在容积固定为2L的密闭容器中充入2mol CO(g)和6mol H2(g)生成CH3OH(g),反应时间与CH3OH(g)的物质的量浓度的关系如下图所示。则前10分钟内,氢气的平均反应速率v(H2)=_______ 。若15分钟时升高体系温度,在20分钟时达到新平衡,此时氢气的转化率为33.3%,请在图中画出15~25分钟c(CO)的变化曲线。_______

 CH3OH(g) ΔH。回答下列问题:
CH3OH(g) ΔH。回答下列问题:(1)已知CO(g)、H2(g)、CH3OH(g)的燃烧热ΔH分别为-283.0kJ·mol-1、-285.8kJ·mol-1、-726.5kJ·mol-1,则反应CO(g)+2H2(g)
 CH3OH(g)的ΔH=
CH3OH(g)的ΔH=(2)在容积可变的密闭容器中充入1mol CO(g)和2mol H2(g)生成CH3OH(g),H2的平衡转化率随温度(T)、压强(p)的变化如图所示。

①该反应的ΔS
②当达到平衡状态A时,容器的体积为2L,此时该反应的平衡常数K=
(3)在容积固定为2L的密闭容器中充入2mol CO(g)和6mol H2(g)生成CH3OH(g),反应时间与CH3OH(g)的物质的量浓度的关系如下图所示。则前10分钟内,氢气的平均反应速率v(H2)=

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】三氧化钼(MoO3)是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为MoS3)通过一定条件来制备。回答下列相关问题:
(1)已知:①MoS2(s) Mo(s)+S2(g) △H1
Mo(s)+S2(g) △H1
②S2(g)+2O2(g) 2SO2(g) △H2
2SO2(g) △H2
③2Mo(s)+3O2(g) 2MoO3(s) △H3
2MoO3(s) △H3
则2MoS2+7O2(g) 2MoO3(s)+4SO2(g)的△H=
2MoO3(s)+4SO2(g)的△H=_______ (用含△H1、△H2、△H3的代数式表示)。
(2)若在恒温恒容条件下,仅发生反应MoS2(s) Mo(s)+S2(g)。
Mo(s)+S2(g)。
①下列说法正确的是_______ (填序号)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加MoS2的量,平衡正向移动
②达到平衡时S2(g)的浓度为1.4mol•L-1,充入一定量的S2(g),反应再次达到平衡,S2(g)浓度_______ (填“>”“<”或“=”)1.4mol•L-1。
(3)在2L恒容密闭容器中充入1.0molS2(g)和1.5molO2(g),若仅发生反应;S2(g)+2O2(g) 2SO2(g),5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,S2(g)的反应速率为
2SO2(g),5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,S2(g)的反应速率为_______ mol•L-1•min-1。
(4)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应:2MoS2+7O2(g) 2MoO3(s)+4SO2(g) △H。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
2MoO3(s)+4SO2(g) △H。测得氧气的平衡转化率与起始压强、温度的关系如图所示。

①比较p1、p2、p3的大小:_______ 。
②若在p2为7.0kPa下,初始通入7.0molO2,则A点平衡常数Kp=________ 。(用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。
(1)已知:①MoS2(s)
 Mo(s)+S2(g) △H1
Mo(s)+S2(g) △H1②S2(g)+2O2(g)
 2SO2(g) △H2
2SO2(g) △H2③2Mo(s)+3O2(g)
 2MoO3(s) △H3
2MoO3(s) △H3则2MoS2+7O2(g)
 2MoO3(s)+4SO2(g)的△H=
2MoO3(s)+4SO2(g)的△H=(2)若在恒温恒容条件下,仅发生反应MoS2(s)
 Mo(s)+S2(g)。
Mo(s)+S2(g)。①下列说法正确的是
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加MoS2的量,平衡正向移动
②达到平衡时S2(g)的浓度为1.4mol•L-1,充入一定量的S2(g),反应再次达到平衡,S2(g)浓度
(3)在2L恒容密闭容器中充入1.0molS2(g)和1.5molO2(g),若仅发生反应;S2(g)+2O2(g)
 2SO2(g),5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,S2(g)的反应速率为
2SO2(g),5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,S2(g)的反应速率为(4)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应:2MoS2+7O2(g)
 2MoO3(s)+4SO2(g) △H。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
2MoO3(s)+4SO2(g) △H。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
①比较p1、p2、p3的大小:
②若在p2为7.0kPa下,初始通入7.0molO2,则A点平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】甲醇(CH3OH)是重要有机化工原料,现在全球的能源紧张,甲醇需求也在增大。利用合成气(主要成分为CO和H2)在催化剂的作用下合成甲醇的方法是:CO(g)+2H2(g) CH3OH(g) ∆H。
CH3OH(g) ∆H。
(1)已知该反应为自发反应,则∆H___________ 0。(填“>”,“<”或“=”)
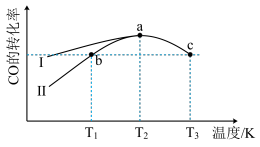
(2)向恒容密闭容器中充入一定量的CO和H2,在使用不同催化剂时,相同时间t内测得CO的转化率随温度的变化如下图所示,有关说法不正确的是___________。
(3)已知:v(正)=k(正)·p(CO)·p2(H2),v(逆)=k(逆)·p(CH3OH);p(CO),p(H2),p(CH3OH)为各组分气体的分压(分压=气体的物质的量分数×体系总压)。在密闭容器中按物质的量之比为1:2充入CO和H2,测得平衡混合气体中CO的平衡转化率随温度、压强的变化关系如图所示。
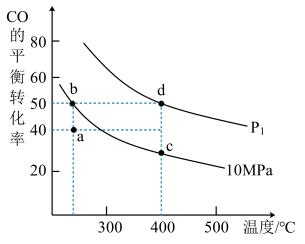
①P1___________ 10Mpa(填“>”或“<”);
②b、c、d三点平衡常数Kb、Kc、Kd三者之间的关系为___________ 。
③实际工业生产往往采用300-400℃和10Mpa的条件,其原因可能有___________ 。(至少写出两方面的原因)
④在10Mpa下,求a点的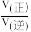 =
=___________ 。(保留1位小数)
 CH3OH(g) ∆H。
CH3OH(g) ∆H。(1)已知该反应为自发反应,则∆H
(2)向恒容密闭容器中充入一定量的CO和H2,在使用不同催化剂时,相同时间t内测得CO的转化率随温度的变化如下图所示,有关说法不正确的是___________。

| A.使用催化剂Ⅰ时,反应的活化能较高 |
| B.b点时v正>v逆。 |
| C.KT1对应的平衡常数等于KT3对应的平衡常数 |
| D.在相同时间t内,理论上最佳生产温度应为T2 |
(3)已知:v(正)=k(正)·p(CO)·p2(H2),v(逆)=k(逆)·p(CH3OH);p(CO),p(H2),p(CH3OH)为各组分气体的分压(分压=气体的物质的量分数×体系总压)。在密闭容器中按物质的量之比为1:2充入CO和H2,测得平衡混合气体中CO的平衡转化率随温度、压强的变化关系如图所示。

①P1
②b、c、d三点平衡常数Kb、Kc、Kd三者之间的关系为
③实际工业生产往往采用300-400℃和10Mpa的条件,其原因可能有
④在10Mpa下,求a点的
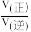 =
=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】NOx的排放主要来自于汽车尾气,包含 NO2和 NO I.
(1)用 CH4催化还原 NOx 可以消除氮氧化物的污染。例如:
a.CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) ∆H1= -574kJ/mol
b.CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) ∆H2= -1160kJ/mol
①这两个反应在热力学上趋势均很大,其原因是:______________ 。
②有利于提高 NOx 的平衡转化率的反应条件是:______________ (至少答一条)。
③在相同条件下,CH4(g)+2NO2(g)=N2(g)+2H2O(g)+CO2(g) ∆H2=______________ kJ/mol
(2)为了提高 CH4和 NO 转化为 N2的产率,种学家寻找了一种新型的催化剂。将 CH4和 NO 按一定比例、一定流速通过装有上述新型催化剂的反应器中,测得 N2的产率与温度的关系如图1所示,OA 段 N2产率增大的原因是______________ 。 AB 段 N2产率降低的可能原因是______________ (填标号)
A. 催化剂活性降低 B. 平衡常数变大 C. 副反应增多
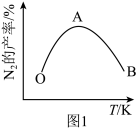
(3)N2的产率与 ,由图可知
,由图可知 最佳约为
最佳约为____________

II.有人利用反应 2C(s)+2NO2(g) N2(g)+2CO2(g) ΔH=-64.2kJ/mol 对 NO2进行吸附。在 T℃下,向密闭容器中加入足量的 C 和一定量的 NO2气体,图为不同压强下上述反应经过 相同时间,NO2的转化率随着压强变化的示意图。
N2(g)+2CO2(g) ΔH=-64.2kJ/mol 对 NO2进行吸附。在 T℃下,向密闭容器中加入足量的 C 和一定量的 NO2气体,图为不同压强下上述反应经过 相同时间,NO2的转化率随着压强变化的示意图。
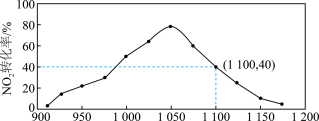
用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作 Kp);在 T℃、 1100KPa 时,该反应的化学平衡常数 Kp=______________ (计算表达式表示); 已知:气体分压(P 分)=气体总压(P 总)×体积分数。
(1)用 CH4催化还原 NOx 可以消除氮氧化物的污染。例如:
a.CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) ∆H1= -574kJ/mol
b.CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) ∆H2= -1160kJ/mol
①这两个反应在热力学上趋势均很大,其原因是:
②有利于提高 NOx 的平衡转化率的反应条件是:
③在相同条件下,CH4(g)+2NO2(g)=N2(g)+2H2O(g)+CO2(g) ∆H2=
(2)为了提高 CH4和 NO 转化为 N2的产率,种学家寻找了一种新型的催化剂。将 CH4和 NO 按一定比例、一定流速通过装有上述新型催化剂的反应器中,测得 N2的产率与温度的关系如图1所示,OA 段 N2产率增大的原因是
A. 催化剂活性降低 B. 平衡常数变大 C. 副反应增多

(3)N2的产率与
 ,由图可知
,由图可知 最佳约为
最佳约为
II.有人利用反应 2C(s)+2NO2(g)
 N2(g)+2CO2(g) ΔH=-64.2kJ/mol 对 NO2进行吸附。在 T℃下,向密闭容器中加入足量的 C 和一定量的 NO2气体,图为不同压强下上述反应经过 相同时间,NO2的转化率随着压强变化的示意图。
N2(g)+2CO2(g) ΔH=-64.2kJ/mol 对 NO2进行吸附。在 T℃下,向密闭容器中加入足量的 C 和一定量的 NO2气体,图为不同压强下上述反应经过 相同时间,NO2的转化率随着压强变化的示意图。
用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作 Kp);在 T℃、 1100KPa 时,该反应的化学平衡常数 Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】以 和
和 为原料制备甲醇是实现
为原料制备甲醇是实现 资源化利用的方式之一,反应原理为:
资源化利用的方式之一,反应原理为:
反应Ⅰ: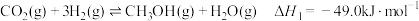
除生成甲醇外,还会生成副产物 :
:
反应Ⅱ: 。
。
(1)图中,曲线___________ (选填i、ii或iii)能表示反应Ⅰ的平衡常数K与温度T的关系。 的恒容密闭容器中充入
的恒容密闭容器中充入 和
和 模拟反应Ⅰ(即控制条件使只发生反应Ⅰ)。反应达到平衡状态时,测得
模拟反应Ⅰ(即控制条件使只发生反应Ⅰ)。反应达到平衡状态时,测得 。计算该温度下的平衡常数
。计算该温度下的平衡常数
___________ 。
(3)在不同温度下,向等容积的反应器中,分别通入等量、相同比例的 和
和 的混合气体,反应相同时间后,测得甲醇产率与催化剂活性、温度关系如图所示。
的混合气体,反应相同时间后,测得甲醇产率与催化剂活性、温度关系如图所示。___________ 。
②解释产率 的可能原因
的可能原因___________ 。
③已知催化剂对副反应没有影响。解释当温度高于500K,甲醇产率逐渐下降的原因可能是___________ 。
(4)中国科学家研制出了一种具有反应和分离“双功能分子筛催化膜”反应器,使用该反应器制甲醇时,能大幅度提高二氧化碳转化率,其原理如下图所示: 转化率和甲醇选择性
转化率和甲醇选择性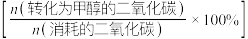 的相关实验数据如下表所示:
的相关实验数据如下表所示:
分析该双功能分子筛催化膜反应器的优点有: 的平衡转化率明显升高;①
的平衡转化率明显升高;①___________ ;②___________ 。
 和
和 为原料制备甲醇是实现
为原料制备甲醇是实现 资源化利用的方式之一,反应原理为:
资源化利用的方式之一,反应原理为:反应Ⅰ:
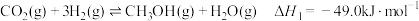
除生成甲醇外,还会生成副产物
 :
:反应Ⅱ:
 。
。(1)图中,曲线

 的恒容密闭容器中充入
的恒容密闭容器中充入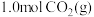 和
和 模拟反应Ⅰ(即控制条件使只发生反应Ⅰ)。反应达到平衡状态时,测得
模拟反应Ⅰ(即控制条件使只发生反应Ⅰ)。反应达到平衡状态时,测得 。计算该温度下的平衡常数
。计算该温度下的平衡常数
(3)在不同温度下,向等容积的反应器中,分别通入等量、相同比例的
 和
和 的混合气体,反应相同时间后,测得甲醇产率与催化剂活性、温度关系如图所示。
的混合气体,反应相同时间后,测得甲醇产率与催化剂活性、温度关系如图所示。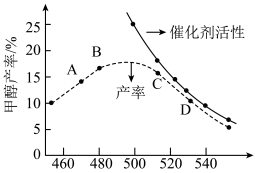
②解释产率
 的可能原因
的可能原因③已知催化剂对副反应没有影响。解释当温度高于500K,甲醇产率逐渐下降的原因可能是
(4)中国科学家研制出了一种具有反应和分离“双功能分子筛催化膜”反应器,使用该反应器制甲醇时,能大幅度提高二氧化碳转化率,其原理如下图所示:

 转化率和甲醇选择性
转化率和甲醇选择性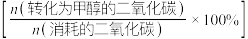 的相关实验数据如下表所示:
的相关实验数据如下表所示:| 实验组 | 反应器 | 压强/ | 温度/K |  |  的平衡转化率/% 的平衡转化率/% | 甲醇选择性/% |
| ① | 普通催化反应器 | 3 | 533 | 3 | 21.9 | 67.3 |
| ② | 双功能分子筛催化膜反应器 | 36.1 | 100 |
 的平衡转化率明显升高;①
的平衡转化率明显升高;①
您最近一年使用:0次



