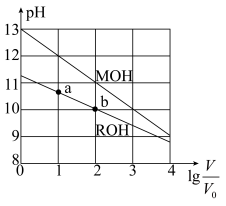
浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg 的变化如图所示。下列叙述错误的是
的变化如图所示。下列叙述错误的是
 的变化如图所示。下列叙述错误的是
的变化如图所示。下列叙述错误的是
| A.MOH的碱性强于ROH的碱性 |
B.当lg =2时,若两溶液同时升高温度,则 =2时,若两溶液同时升高温度,则 增大 增大 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
| D.ROH的电离程度:b点大于a点 |
22-23高二下·云南文山·期末 查看更多[5]
山东省泰安市2023-2024学年高二上学期第四次调研测试化学试题四川省德阳市什邡中学2023-2024学年高二上学期11月期中考试化学试题(已下线)期末押题卷02-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)【定心卷】3.1.2 弱电解质的电离平衡随堂练习-人教版2023-2024学年选择性必修1云南省马关县第一中学校2022-2023学年高二下学期期末考试化学试题
更新时间:2023-07-28 15:30:19
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】某温度时,将n mol•L﹣1氨水滴入20 mL1.0 mol•L﹣1盐酸中,忽略溶液混合时的体积变化,溶液pH和温度随加入氨水体积变化的曲线如图所示。下列有关说法正确的是( )


| A.a点:Kw=1.0×10﹣14 |
B.b点:c(NH )>c(Cl-)>c(H+)>c(OH-) )>c(Cl-)>c(H+)>c(OH-) |
| C.25℃NH4Cl水解常数为(n﹣1)×10-6 |
| D.b点水的电离程度最大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】从植物花汁中提取的一种有机物,可简化表示为HIn,在水溶液中因存在下列电离平衡,故可用做酸、碱指示剂:HIn(红色溶液) H+(溶液)+In-(黄色溶液)
H+(溶液)+In-(黄色溶液)
在上述溶液中加入下列物质,最终能使指示剂显黄色的是:
 H+(溶液)+In-(黄色溶液)
H+(溶液)+In-(黄色溶液)在上述溶液中加入下列物质,最终能使指示剂显黄色的是:
| A.盐酸 | B.NaHCO3溶液 |
| C.NaHSO4溶液 | D.Na2O2固体 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】常温下向100mL0.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液中NH4+和NH3·H2O的物质的量分数φ与加入盐酸的体积V及混合液pH变化的关系如图所示,下列说法正确的是


| A.表示NH3·H2O物质的量分数变化的曲线是B |
| B.pH=9.26时的溶液中,NH3·H2O的电离程度小于NH4+的水解程度 |
| C.常温下,NH3·H2O的电离常数为1.8×10-5mol/L (已知lg1.8=0.26) |
| D.当加入盐酸体积为50mL时,溶液中c(NH4+)-c(NH3·H2O)=2×(10-5+10-9)mol/L |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】强酸制弱酸非常重要的一种离子反应,已知:
下列离子反应不正确的有( )个
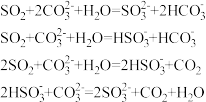
| Ka1 | Ka2 | |
| H2SO3 | 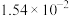 | 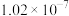 |
| H2CO3 | 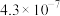 | 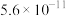 |
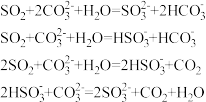
| A.0个 | B.1个 | C.2个 | D.3个 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】在相同温度下,100mL0.1mol·L-1的醋酸与10mL1mol·L-1的醋酸相比较,下列说法正确的是
| A.发生中和反应时所需NaOH的量前者大于后者 |
| B.前者的电离程度小于后者 |
| C.所含H+的物质的量前者大于后者 |
| D.所含CH3COOH的物质的量前者大于后者 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】已知HCN溶液中存在电离平衡HCN H++CN-,平衡常数为Ka。现对HCN溶液做如下处理,其中叙述正确的是
H++CN-,平衡常数为Ka。现对HCN溶液做如下处理,其中叙述正确的是
 H++CN-,平衡常数为Ka。现对HCN溶液做如下处理,其中叙述正确的是
H++CN-,平衡常数为Ka。现对HCN溶液做如下处理,其中叙述正确的是| A.加入NaOH溶液,平衡正向移动,c(H+)减小,c(CN-)增大 |
| B.加水稀释,平衡正向移动,Ka增大 |
| C.增大HCN的浓度,平衡正向移动,Ka不变 |
| D.加入NaCN固体,平衡逆向移动,Ka减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】常温下,下列有关各溶液的叙述正确的是
A. 的溶液中不可能存在醋酸分子 的溶液中不可能存在醋酸分子 |
B. 的醋酸钠溶液与 的醋酸钠溶液与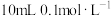 的盐酸混合后溶液显酸性: 的盐酸混合后溶液显酸性: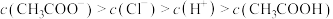 |
C. 醋酸的 醋酸的 , , 的醋酸的 的醋酸的 ,则 ,则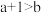 |
D.已知酸性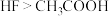 ,pH相等的 ,pH相等的 与 与 溶液中 溶液中 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列叙述正确的是
A.用水稀释0.1mol·L-1的氨水,则溶液中 减小 减小 |
| B.pH=3的盐酸和醋酸分别升高相同的温度,CH3COOH的pH变大 |
| C.在等体积等浓度的盐酸和醋酸中分别加入等质量的相同锌粒,随着反应的进行,醋酸不断电离出H+,反应速率比盐酸大 |
| D.两种氨水的pH分别为a和a+1,物质的量浓度分别为c1和c2,则c2<10c1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】某同学拟用 计测定溶液
计测定溶液 以探究某酸
以探究某酸 是否为弱电解质。下列说法正确的是
是否为弱电解质。下列说法正确的是
 计测定溶液
计测定溶液 以探究某酸
以探究某酸 是否为弱电解质。下列说法正确的是
是否为弱电解质。下列说法正确的是A. 时,若测得 时,若测得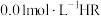 溶液 溶液 ,则 ,则 是弱酸 是弱酸 |
B. 时,若测得 时,若测得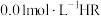 溶液 溶液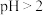 且 且 ,则 ,则 是弱酸 是弱酸 |
C. 时,若测得 时,若测得 溶液 溶液 ,取该溶液 ,取该溶液 ,加蒸馏水稀释至 ,加蒸馏水稀释至 ,测得 ,测得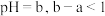 ,则 ,则 是弱酸 是弱酸 |
D. 时,若测得 时,若测得 溶液 溶液 ,取该溶液 ,取该溶液 ,升温至 ,升温至 ,测得 ,测得 ,若 ,若 是弱酸,则 是弱酸,则 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】下列实验操作、现象、结论正确的是
| 操作及现象 | 结论 | |
| A | 向Al2(SO4)3溶液中滴加Na2S溶液,产生白色沉淀 | 白色沉淀成分是Al2S3 |
| B | 将粗铜和精铜分别连接电源的正、负极,两电极减少和增加的质量不相等 | 质量变化大的电极一定与电源的负极相连 |
| C | 向盛有2mL 0.1mol/LZnSO4溶液的试管中加入2mL 1mol/LNa2S溶液,再加入0.1mol/LCuSO4溶液,最终得到黑色沉淀 | CuS的溶解度比ZnS小 |
| D | 向盛有0.01mol/L CH3COONa溶液的试管中滴加几滴酚酞试液,溶液变红,加热,颜色变深 | 溶液中存在水解平衡CH3COO-+H2O CH3COOH+OH—,且为吸热反应 CH3COOH+OH—,且为吸热反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



