甘氨酸亚铁[(H2NCH2COO)2Fe]是一种补血剂,工业上用赤铁矿(含少量Al2O3、CuO、MnO2和SiO2等)制备甘氨酸亚铁的流程图如下:
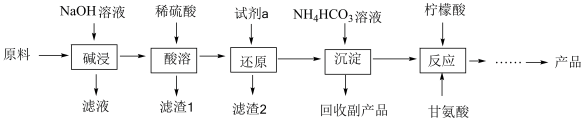
已知:甘氨酸(H2NCH2COOH),易溶于水,微溶于乙醇,具有两性。
回答下列问题:
(1)“碱浸”时除去的元素是___________ (填化学用语,下同),“滤渣1”是___________ 。
(2)“还原”时的还原产物是___________ 。
(3)“沉淀”的离子方程式为___________ 。
(4)FeSO4·7H2O也是一种常用的补血剂,在空气中易变质,可检验其是否变质的试剂是___________ ,某同学通过如下实验测定该补血剂中Fe2+的含量。
①配制:用分析天平称取1.400gFeSO4·7H2O样品,再用煮沸并冷却的蒸馏水将其溶解并配制成100mL溶液。配制时还需要的定量仪器是___________ 。
②滴定:用移液管移取25.00mLFeSO4溶液于锥形瓶中,用0.0100mol·L-1的酸性KMnO4溶液滴定,平行滴定3次,KMnO4溶液的平均用量为24.00mL,则样品Fe2+的含量为___________ %。

已知:甘氨酸(H2NCH2COOH),易溶于水,微溶于乙醇,具有两性。
回答下列问题:
(1)“碱浸”时除去的元素是
(2)“还原”时的还原产物是
(3)“沉淀”的离子方程式为
(4)FeSO4·7H2O也是一种常用的补血剂,在空气中易变质,可检验其是否变质的试剂是
①配制:用分析天平称取1.400gFeSO4·7H2O样品,再用煮沸并冷却的蒸馏水将其溶解并配制成100mL溶液。配制时还需要的定量仪器是
②滴定:用移液管移取25.00mLFeSO4溶液于锥形瓶中,用0.0100mol·L-1的酸性KMnO4溶液滴定,平行滴定3次,KMnO4溶液的平均用量为24.00mL,则样品Fe2+的含量为
更新时间:2023-09-13 23:14:07
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】离子反应是中学化学中重要的反应类型,回答下列问题:
(1)某工业废水中存在大量的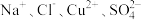 ,欲除去其中的
,欲除去其中的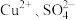 ,设计提纯流程如图所示:
,设计提纯流程如图所示:
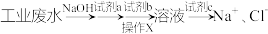
①试剂b溶液为_______ (化学式),试剂c溶液为_______ (化学式)。
②操作X为_______ 。
(2)将两种盐混合后溶于水得到一种无色透明溶液,溶液中含有下列离子中的某些离子:H+、Na+、Mg2+、Cu2+、Ba2+、SO 、CO
、CO 和Cl-,取该溶液进行如下实验:
和Cl-,取该溶液进行如下实验:
I.取少量溶液滴入紫色石蕊溶液,溶液呈红色。
Ⅱ.取少许溶液滴入过量的Ba(OH)2溶液,有白色沉淀产生。过滤,向沉淀中加入足量稀硝酸,沉淀不溶解。
Ⅲ.取步骤Ⅱ中滤液少许,先滴加硝酸酸化,再滴加AgNO3溶液,产生白色沉淀。
①根据以上现象判断,两种盐的混合溶液中肯定不存在的离子是_____ ;两种盐分别是______ 。
②写出反应的离子方程式:
实验Ⅱ中滴入过量的Ba(OH)2溶液:_______ ;
实验Ⅲ中:_______ 。
(1)某工业废水中存在大量的
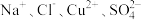 ,欲除去其中的
,欲除去其中的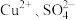 ,设计提纯流程如图所示:
,设计提纯流程如图所示: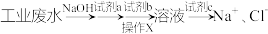
①试剂b溶液为
②操作X为
(2)将两种盐混合后溶于水得到一种无色透明溶液,溶液中含有下列离子中的某些离子:H+、Na+、Mg2+、Cu2+、Ba2+、SO
 、CO
、CO 和Cl-,取该溶液进行如下实验:
和Cl-,取该溶液进行如下实验:I.取少量溶液滴入紫色石蕊溶液,溶液呈红色。
Ⅱ.取少许溶液滴入过量的Ba(OH)2溶液,有白色沉淀产生。过滤,向沉淀中加入足量稀硝酸,沉淀不溶解。
Ⅲ.取步骤Ⅱ中滤液少许,先滴加硝酸酸化,再滴加AgNO3溶液,产生白色沉淀。
①根据以上现象判断,两种盐的混合溶液中肯定不存在的离子是
②写出反应的离子方程式:
实验Ⅱ中滴入过量的Ba(OH)2溶液:
实验Ⅲ中:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某化学兴趣小组分组通过实验验证“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
(1)实验小组1:向1mL0.1mol/LFeSO4溶液中加入1mL0. lmol/LAgNO3溶液,开始时,溶液无明显变化,几分钟后迅速出现大量灰黑色沉淀,反应过程中温度几乎无变化。测得溶液中Ag浓度随时间的变化如图1所示。
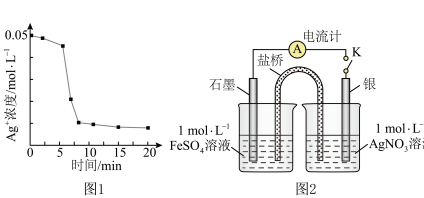
几分钟后迅速出现灰黑色沉淀的可能原因是_____________________ 。20min后取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_____ 。
(2)实验小组2:采用图2电化学验装置从平衡移动角度进行验证。闭合K,电流表指针发生偏转,一段时间后指针归零,证明该电池工作时能产生Fe3+操作及现象__________________ 。指针归零后再向左侧烧杯中加入较浓的Fe2(SO4)3溶液,指针变化为__________ ,综合实验Ⅰ和实验Ⅱ,证实“Ag++Fe2+ Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。
(3)实验小组3:向硝酸酸化的0.05mol/L硝酸银溶液(pH=2)中加入过量铁粉,发生反应“Fe+2Ag+=Fe2++2Ag”,静置后取上层清液,滴加KSCN溶液,溶液变红,同时发现有白色沉淀生成,说明溶液中存在________ (填离子符号) ;随静置时间延长,产生白色沉淀的量越来越少,溶液红色先变深后变浅,请结合离子方程式解释实验现象产生的原因___________________ (反应过程中忽略NO;和空气中氧气的氧化作用;查资料知Ag+与SCN-生成白色沉淀AgSCN)。
 Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。(1)实验小组1:向1mL0.1mol/LFeSO4溶液中加入1mL0. lmol/LAgNO3溶液,开始时,溶液无明显变化,几分钟后迅速出现大量灰黑色沉淀,反应过程中温度几乎无变化。测得溶液中Ag浓度随时间的变化如图1所示。

几分钟后迅速出现灰黑色沉淀的可能原因是
(2)实验小组2:采用图2电化学验装置从平衡移动角度进行验证。闭合K,电流表指针发生偏转,一段时间后指针归零,证明该电池工作时能产生Fe3+操作及现象
 Fe3++Ag↓”为可逆反应。
Fe3++Ag↓”为可逆反应。(3)实验小组3:向硝酸酸化的0.05mol/L硝酸银溶液(pH=2)中加入过量铁粉,发生反应“Fe+2Ag+=Fe2++2Ag”,静置后取上层清液,滴加KSCN溶液,溶液变红,同时发现有白色沉淀生成,说明溶液中存在
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】 —锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
—锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
以 —锂辉石为原料制备碳酸锂的一种流程如下:
—锂辉石为原料制备碳酸锂的一种流程如下:
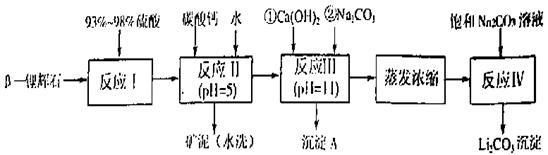
已知:①部分金属氢氧化物开始沉淀和完全沉淀的pH:
②Li2CO3在不同温度的溶解度如下表:
回答下列问题:
(1)反应II中加碳酸钙的作用是___________ 。
(2)写出反应III中生成沉淀A的离子方程式______________ 、________________ 。
(3)写出反应IV的化学方程式________ 。洗涤所得Li2CO3沉淀要用热水而非冷水,原因是________ 。
(4)实验室中常用于蒸发浓缩的硅酸盐质的仪器有______________ 。
A.蒸发皿 B.玻璃棒 C.铁架台(带铁圈) D.酒精灯 E、圆底烧瓶
 —锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
—锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。以
 —锂辉石为原料制备碳酸锂的一种流程如下:
—锂辉石为原料制备碳酸锂的一种流程如下:
已知:①部分金属氢氧化物开始沉淀和完全沉淀的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度的溶解度如下表:
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
回答下列问题:
(1)反应II中加碳酸钙的作用是
(2)写出反应III中生成沉淀A的离子方程式
(3)写出反应IV的化学方程式
(4)实验室中常用于蒸发浓缩的硅酸盐质的仪器有
A.蒸发皿 B.玻璃棒 C.铁架台(带铁圈) D.酒精灯 E、圆底烧瓶
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

(1)滴定醋酸的曲线是_______ (填“Ⅰ”或“Ⅱ”)。
(2)室温时,若0.1mol/L的醋酸的电离度为1%,计算这醋酸溶液的pH_______ 。
(3)滴定开始前,三种溶液中由水电离出的c(H+)最大的是_______ 。
(4)用0.1mol/L的NaOH溶液作为标准液滴定盐酸,下列使结果偏高的是_______。
(5)上述滴定用酚酞作指示剂,滴定终点的现象:_______ 。

(1)滴定醋酸的曲线是
(2)室温时,若0.1mol/L的醋酸的电离度为1%,计算这醋酸溶液的pH
(3)滴定开始前,三种溶液中由水电离出的c(H+)最大的是
(4)用0.1mol/L的NaOH溶液作为标准液滴定盐酸,下列使结果偏高的是_______。
| A.用标准NaOH溶液润洗碱式滴定管后,再装入标准碱溶液 |
| B.用待测酸溶液润洗锥形瓶后,再装入待测酸溶液 |
| C.滴定时,若溶液颜色发生变化立即停止滴定 |
| D.取20.00mL盐酸时,先仰视后平视 |
(5)上述滴定用酚酞作指示剂,滴定终点的现象:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】为测定某品牌洗厕精的酸(盐酸)含量,某学生欲用已知物质的量浓度的NaOH溶液来测定该洗厕精(盐酸)的物质的量浓度时,选择酚酞作指示剂。请填写下列空白:
(1)碱式滴定管的使用方法,正确步骤的先后顺序为___________ (填字母)。
A.用NaOH溶液润洗仪器并加入NaOH溶液
B.放出NaOH溶液进行滴定
C.调节起始读数
D.查漏,再水洗2~3遍
(2)排除碱式滴定管中气泡的方法应采用操作___________ (填图编号),轻轻挤压玻璃球使尖嘴部分充满碱液。

(3)滴定达到终点的标志是___________ 。
(4)某学生根据三次实验分别记录有关数据如下表:
请选用其中合理的数据计算,该洗厕精中酸(盐酸)的物质的量浓度:c(HCl)=___________ 。
(5)分析下列操作对所测洗厕精的酸(盐酸)的浓度的影响:
A.若取待测液时,开始仰视读数,后俯视读数,则___________ (填“偏大”、“偏小”或“无影响”);
B.若碱式滴定管在滴定前有气泡,滴定后气泡消失,则___________ (填“偏大”、“偏小”或“无影响”)。
(1)碱式滴定管的使用方法,正确步骤的先后顺序为
A.用NaOH溶液润洗仪器并加入NaOH溶液
B.放出NaOH溶液进行滴定
C.调节起始读数
D.查漏,再水洗2~3遍
(2)排除碱式滴定管中气泡的方法应采用操作

(3)滴定达到终点的标志是
(4)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 | 待测盐酸的体积/mL | 0.100mol/LNaOH溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 2.00 | 28.15 |
| 第二次 | 25.00 | 1.50 | 27.75 |
| 第三次 | 25.00 | 0.20 | 26.55 |
(5)分析下列操作对所测洗厕精的酸(盐酸)的浓度的影响:
A.若取待测液时,开始仰视读数,后俯视读数,则
B.若碱式滴定管在滴定前有气泡,滴定后气泡消失,则
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】二氯异氰尿酸钠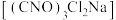 具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和
具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和 (氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(1)装置B中试剂为___________ 。
(2) 的制备步骤如下:
的制备步骤如下:
①检查装置气密性后加入药品。
②关闭K1,打开K2,向A中滴加足量的浓盐酸,关闭K2,当观察到___________ 时,滴入 的吡啶溶液,写出
的吡啶溶液,写出 和NaClO发生反应的化学方程式
和NaClO发生反应的化学方程式___________ 。制备过程中要不断通入Cl2,其目的是___________ ,反应完成后需进行的操作为___________ 。
③取装置D中溶液,制得产品。操作为___________ 、过滤、冷水洗涤、低温干燥得到粗产品。
(3)粗产品中 纯度测定。取m g粗产品溶于少量水,加入过量维生素C充分反应,再加入过量
纯度测定。取m g粗产品溶于少量水,加入过量维生素C充分反应,再加入过量
 的AgNO3溶液,加入几滴稀
的AgNO3溶液,加入几滴稀 溶液,用
溶液,用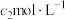 NH4SCN标准溶液滴定至终点,消耗
NH4SCN标准溶液滴定至终点,消耗 标准液。[已知:
标准液。[已知: (白色)]
(白色)]
① (摩尔质量为
(摩尔质量为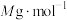 )的纯度为
)的纯度为___________ 。
②下列有关上述滴定操作的说法正确的是___________ 。
a.接近滴定终点时微微转动活塞,使溶液悬挂在尖嘴上,形成半滴,用锥形瓶内壁将其刮落
b.若盛放NH4SCN标准溶液的滴定管没有润洗,使测定结果偏大
c.锥形瓶洗涤后未干燥即加入所配待测溶液,使测定结果偏小
d.滴定前俯视读数,滴定后仰视读数,使测定结果偏小
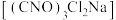 具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和
具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和 (氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(1)装置B中试剂为
(2)
 的制备步骤如下:
的制备步骤如下:①检查装置气密性后加入药品。
②关闭K1,打开K2,向A中滴加足量的浓盐酸,关闭K2,当观察到
 的吡啶溶液,写出
的吡啶溶液,写出 和NaClO发生反应的化学方程式
和NaClO发生反应的化学方程式③取装置D中溶液,制得产品。操作为
(3)粗产品中
 纯度测定。取m g粗产品溶于少量水,加入过量维生素C充分反应,再加入过量
纯度测定。取m g粗产品溶于少量水,加入过量维生素C充分反应,再加入过量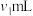
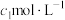 的AgNO3溶液,加入几滴稀
的AgNO3溶液,加入几滴稀 溶液,用
溶液,用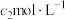 NH4SCN标准溶液滴定至终点,消耗
NH4SCN标准溶液滴定至终点,消耗 标准液。[已知:
标准液。[已知: (白色)]
(白色)]①
 (摩尔质量为
(摩尔质量为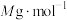 )的纯度为
)的纯度为②下列有关上述滴定操作的说法正确的是
a.接近滴定终点时微微转动活塞,使溶液悬挂在尖嘴上,形成半滴,用锥形瓶内壁将其刮落
b.若盛放NH4SCN标准溶液的滴定管没有润洗,使测定结果偏大
c.锥形瓶洗涤后未干燥即加入所配待测溶液,使测定结果偏小
d.滴定前俯视读数,滴定后仰视读数,使测定结果偏小
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
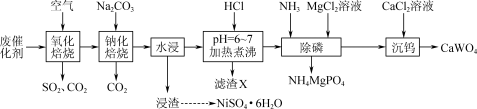
【推荐1】对以SiO2为载体的加氢废催化剂(主要含有WS2、NiS、Al2S3,少量碳、磷)处理的实验流程如下:_______ 。
(2)滤渣X的成分为H2SiO3和_______ (填化学式)。
(3)Mg(H2PO4)2易溶于水,MgHPO4、Mg3(PO4)2均难溶于水。除磷装置如图所示,向滤液中先通入NH3,再滴加MgCl2溶液,维持溶液pH为9~10,得到复合肥料NH4MgPO4固体。_______ 。
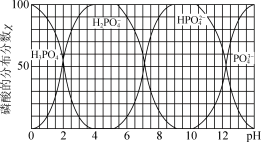
②磷酸的分布分数χ(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。生成NH4MgPO4的离子方程式为_______ 。_______ 。
(4)已知:
①该实验中pH=5.0时,Al3+沉淀完全;在pH=6.0时,Ni2+开始沉淀。
②浸渣中含NiO、少量的Al2O3和不溶性杂质。实验中须用到的试剂:2mol·L-1H2SO4溶液、0.1mol·L-1NaOH溶液。
请完成用浸渣制备NiSO4·6H2O的实验方案:_______ 。
(2)滤渣X的成分为H2SiO3和
(3)Mg(H2PO4)2易溶于水,MgHPO4、Mg3(PO4)2均难溶于水。除磷装置如图所示,向滤液中先通入NH3,再滴加MgCl2溶液,维持溶液pH为9~10,得到复合肥料NH4MgPO4固体。
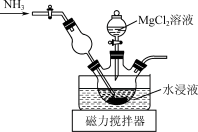
②磷酸的分布分数χ(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。生成NH4MgPO4的离子方程式为
(4)已知:
①该实验中pH=5.0时,Al3+沉淀完全;在pH=6.0时,Ni2+开始沉淀。
②浸渣中含NiO、少量的Al2O3和不溶性杂质。实验中须用到的试剂:2mol·L-1H2SO4溶液、0.1mol·L-1NaOH溶液。
请完成用浸渣制备NiSO4·6H2O的实验方案:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】工业上处理酸性高浓度含砷废水,同时制取As2O3的工艺流程如下:
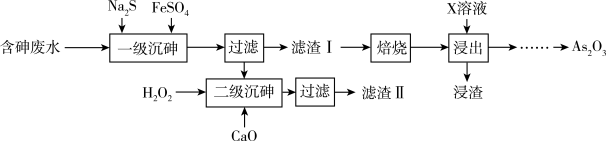
已知:①含砷废水中砷元素为+3价,溶液中各微粒的物质的量分数与pH的关系如图所示。

②As2S3与S2-能发生反应: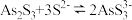
③H3AsO3、H3AsO4均为弱酸,且亚砷酸盐的溶解性大于相应砷酸盐。
(1)“一级沉砷”过程中需控制溶液的pH<6,加入Na2S可生成As2S3,写出发生反应的离子方程式:_ 。“一级沉砷”中FeSO4的作用是__ 。
(2)“二级沉砷”时先在滤液中加入H2O2,则H2O2与含砷物质反应的化学方程式为__ 。再加入CaO,则得到的滤渣II含有的成分有Ca3(AsO4)2、FeAsO4、CaSO4、__ 等。
(3)“焙烧”滤渣I得到As2O3和Fe2O3的混合物。As2O3是一种酸性氧化物,选择合适的溶液X,将砷元素从混合物中浸出,写出“浸出”发生反应的离子方程式:__ 。
(4)25℃砷酸(H3AsO4)分步电离的平衡常数为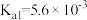 ,
,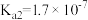 ,
,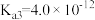 ,则NaH2AsO4溶液的pH
,则NaH2AsO4溶液的pH__ 7(填“>”、“<”、“=”),判断依据为__ 。

已知:①含砷废水中砷元素为+3价,溶液中各微粒的物质的量分数与pH的关系如图所示。

②As2S3与S2-能发生反应:
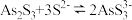
③H3AsO3、H3AsO4均为弱酸,且亚砷酸盐的溶解性大于相应砷酸盐。
(1)“一级沉砷”过程中需控制溶液的pH<6,加入Na2S可生成As2S3,写出发生反应的离子方程式:
(2)“二级沉砷”时先在滤液中加入H2O2,则H2O2与含砷物质反应的化学方程式为
(3)“焙烧”滤渣I得到As2O3和Fe2O3的混合物。As2O3是一种酸性氧化物,选择合适的溶液X,将砷元素从混合物中浸出,写出“浸出”发生反应的离子方程式:
(4)25℃砷酸(H3AsO4)分步电离的平衡常数为
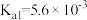 ,
,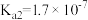 ,
,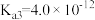 ,则NaH2AsO4溶液的pH
,则NaH2AsO4溶液的pH
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】一氧化二氯(Cl2O)是一种氯化剂和氧化剂,极易溶于水,与水反应生成HClO,遇有机物易燃烧或爆炸,42℃以上易分解。制备出的Cl2O要冷却成固体才便于操作和保存,制取少量的Cl2O是用干燥的氧化汞和氯气反应:2HgO+2Cl2=Cl2O+HgCl2·HgO(反应放热)。某化学兴趣小组设计如图装置以制备Cl2O(支撑、加热及夹持装置已省略)。
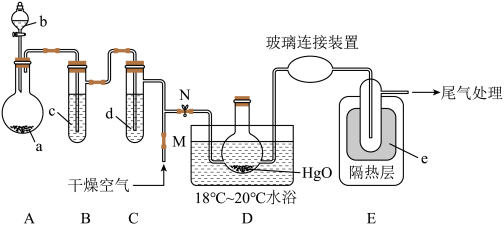
已知:①a中固体试剂是MnO2,b中试剂是浓盐酸。
②有关物质的熔沸点如下表。
请回答:
(1)仪器b的名称___________ ,B中盛有的液体c应是___________ 。
(2)写出装置A中制备氯气的化学方程式___________ 。
(3)待装置A不再产生氯气后,M处通入干燥空气的作用是___________ 。
(4)装置中D的水浴温度应控制在18℃~20℃原因之一是:温度过低反应太慢不利于制备,另一个原因是:___________ 。
(5)E中的保温瓶中盛有液态制冷剂e是___________ (在“干冰”“冰水”“液态空气”“液氨”“液氯”中选择一种)
(6)据文献报道,Cl2O的另一种制备方法是利用Cl2与潮湿的Na2CO3反应来制得,同时生成两种盐,写出该反应的化学方程式___________ 。

已知:①a中固体试剂是MnO2,b中试剂是浓盐酸。
②有关物质的熔沸点如下表。
| Cl2O | N2 | O2 | CO2 | NH3 | Cl2 | |
| 熔点 | -120.6℃ | -209.8℃ | -218.4℃ | -78.5℃(升华) | -77.3℃ | -101℃ |
| 沸点 | 3.8℃ | -195.8℃ | -183℃ | -33.35℃ | -34.6℃ |
(1)仪器b的名称
(2)写出装置A中制备氯气的化学方程式
(3)待装置A不再产生氯气后,M处通入干燥空气的作用是
(4)装置中D的水浴温度应控制在18℃~20℃原因之一是:温度过低反应太慢不利于制备,另一个原因是:
(5)E中的保温瓶中盛有液态制冷剂e是
(6)据文献报道,Cl2O的另一种制备方法是利用Cl2与潮湿的Na2CO3反应来制得,同时生成两种盐,写出该反应的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】连二亚硫酸钠(Na2S2O4)俗称保险粉,有极强的还原性,在空气中易被氧化,受热、遇水都会发生分解反应放出大量的热,甚至引起燃烧。不溶于乙醇,可溶于氢氧化钠水溶液并稳定存在。
(1)锌粉法是制备Na2S2O4的一种常见方法,其原理如图所示:
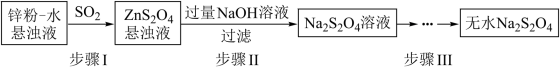
①步骤I中SO2表现了___________ (填“氧化性”、“还原性”或“酸性”);若用Na2SO3固体和某酸反应制备SO2气体,你认为下列最适宜选用的酸是___________ (填序号)。
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
②常温下,若ZnS2O4 悬浊液中c(Zn2+)=0.05mol•L-1,则应加氢氧化钠溶液调至pH≥___________ ,才能使Zn(OH)2沉淀完全。(已知离子浓度≤1.0×10-5mol•L-1,即沉淀完全;Ksp[Zn(OH)2]=4.0×10-17;lg2=0.3)
③步骤III中得到的Na2S2O4要用乙醇洗涤,其优点是___________ 。请写出具体的洗涤操作过程___________ 。
(2)甲酸钠法是制备Na2S2O4的一种新方法,其原理为将甲酸钠(HCOONa)和烧碱溶于乙醇水溶液中,再通入SO2发生反应,有CO2气体放出,析出Na2S2O4固体,总反应的化学方程式为___________ 。
(3)Na2S2O4固体在隔绝空气的条件下加热至75℃时完全分解,生成Na2SO3、Na2S2O3、SO2,检验产物中是否含有Na2SO4的实验方法是___________ 。
(1)锌粉法是制备Na2S2O4的一种常见方法,其原理如图所示:

①步骤I中SO2表现了
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
②常温下,若ZnS2O4 悬浊液中c(Zn2+)=0.05mol•L-1,则应加氢氧化钠溶液调至pH≥
③步骤III中得到的Na2S2O4要用乙醇洗涤,其优点是
(2)甲酸钠法是制备Na2S2O4的一种新方法,其原理为将甲酸钠(HCOONa)和烧碱溶于乙醇水溶液中,再通入SO2发生反应,有CO2气体放出,析出Na2S2O4固体,总反应的化学方程式为
(3)Na2S2O4固体在隔绝空气的条件下加热至75℃时完全分解,生成Na2SO3、Na2S2O3、SO2,检验产物中是否含有Na2SO4的实验方法是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】冰晶石是一种矿物,主要成分为六氟合铝酸钠(Na3AlF6),微溶于水,熔融的冰晶石能溶解氧化铝,在电解铝工业作助熔剂,制造乳白色玻璃和搪瓷的遮光剂。工业上生产Na3AlF6的主要流程如下:
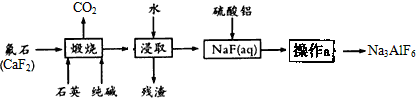
试结合生产流程回答下列问题:
(1)浸取后的“残渣”中一定含有的成分是________ ,硫酸铝与NaF(aq)反应的离子方程式为____ ;
(2)为提高NaF的浸出率,煅烧后的固体在浸取前应采取的措施为_______________________ ,为得到纯净的Na3AlF6产品,操作a包括的主要操作步骤为_______ →_______ →_______ ;
(3)在按化学计量加入硫酸铝溶液前,需先用硫酸将NaF(aq)的pH下调至5左右,请解释其原因是_____________________________________ ;
(4)78kg含CaF280%的氟石(杂质不含氟元素)理论上可生产Na3AlF6______ kg(设生产过程中的每一步含氟物质均完全转化);
(5)碳酸化法也是工业制取Na3AlF6的一种方法:在偏铝酸钠及氟化钠溶液中,通入足量二氧化碳即可,请写出该反应的化学方程式_____________ 。

试结合生产流程回答下列问题:
(1)浸取后的“残渣”中一定含有的成分是
(2)为提高NaF的浸出率,煅烧后的固体在浸取前应采取的措施为
(3)在按化学计量加入硫酸铝溶液前,需先用硫酸将NaF(aq)的pH下调至5左右,请解释其原因是
(4)78kg含CaF280%的氟石(杂质不含氟元素)理论上可生产Na3AlF6
(5)碳酸化法也是工业制取Na3AlF6的一种方法:在偏铝酸钠及氟化钠溶液中,通入足量二氧化碳即可,请写出该反应的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】试分析回答下列有关实验与计算问题:
(1)利用反应Ca2++H2O2+2NH3+8H2O=CaO2∙8H2O↓+2 ,在碱性环境下制取CaO2∙8H2O的装置如图:
,在碱性环境下制取CaO2∙8H2O的装置如图:
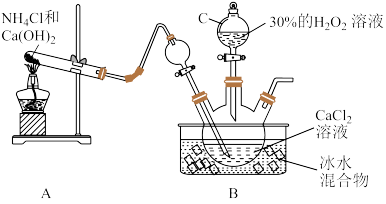
①仪器C的名称为_______ ;反应结束后,经_______ (填操作名称)、洗涤、低温烘干可获得CaO2∙8H2O。
②装置B中用冰水浴控制温度,其可能的原因是_______ 。
(2)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如图所示实验方案来测定该混合气体中SO2的体积分数。
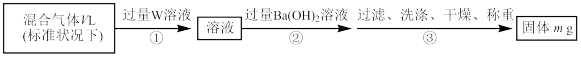
①W溶液可以是_______ (填序号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为_______ (用含V、m的式子表示)。
(1)利用反应Ca2++H2O2+2NH3+8H2O=CaO2∙8H2O↓+2
 ,在碱性环境下制取CaO2∙8H2O的装置如图:
,在碱性环境下制取CaO2∙8H2O的装置如图:
①仪器C的名称为
②装置B中用冰水浴控制温度,其可能的原因是
(2)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如图所示实验方案来测定该混合气体中SO2的体积分数。
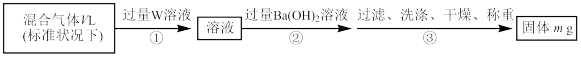
①W溶液可以是
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为
您最近一年使用:0次



