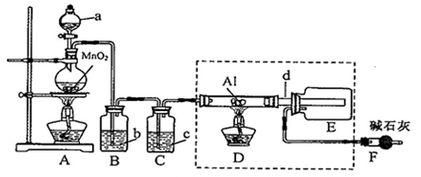
连二亚硫酸钠(Na2S2O4)俗称保险粉,有极强的还原性,在空气中易被氧化,受热、遇水都会发生分解反应放出大量的热,甚至引起燃烧。不溶于乙醇,可溶于氢氧化钠水溶液并稳定存在。
(1)锌粉法是制备Na2S2O4的一种常见方法,其原理如图所示:
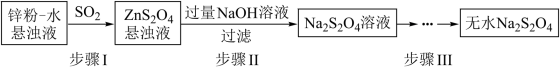
①步骤I中SO2表现了___________ (填“氧化性”、“还原性”或“酸性”);若用Na2SO3固体和某酸反应制备SO2气体,你认为下列最适宜选用的酸是___________ (填序号)。
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
②常温下,若ZnS2O4 悬浊液中c(Zn2+)=0.05mol•L-1,则应加氢氧化钠溶液调至pH≥___________ ,才能使Zn(OH)2沉淀完全。(已知离子浓度≤1.0×10-5mol•L-1,即沉淀完全;Ksp[Zn(OH)2]=4.0×10-17;lg2=0.3)
③步骤III中得到的Na2S2O4要用乙醇洗涤,其优点是___________ 。请写出具体的洗涤操作过程___________ 。
(2)甲酸钠法是制备Na2S2O4的一种新方法,其原理为将甲酸钠(HCOONa)和烧碱溶于乙醇水溶液中,再通入SO2发生反应,有CO2气体放出,析出Na2S2O4固体,总反应的化学方程式为___________ 。
(3)Na2S2O4固体在隔绝空气的条件下加热至75℃时完全分解,生成Na2SO3、Na2S2O3、SO2,检验产物中是否含有Na2SO4的实验方法是___________ 。
(1)锌粉法是制备Na2S2O4的一种常见方法,其原理如图所示:

①步骤I中SO2表现了
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
②常温下,若ZnS2O4 悬浊液中c(Zn2+)=0.05mol•L-1,则应加氢氧化钠溶液调至pH≥
③步骤III中得到的Na2S2O4要用乙醇洗涤,其优点是
(2)甲酸钠法是制备Na2S2O4的一种新方法,其原理为将甲酸钠(HCOONa)和烧碱溶于乙醇水溶液中,再通入SO2发生反应,有CO2气体放出,析出Na2S2O4固体,总反应的化学方程式为
(3)Na2S2O4固体在隔绝空气的条件下加热至75℃时完全分解,生成Na2SO3、Na2S2O3、SO2,检验产物中是否含有Na2SO4的实验方法是
更新时间:2021-01-03 10:51:46
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
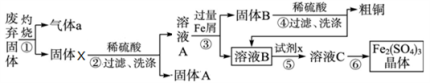
【推荐1】某实验小组利用FeS处理含Cu2+和Pb2+废水后的废弃固体(主要成分CuS、FeS、PbS、SiO2)制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
(1)提高步骤①反应速率的措施,除温度外,还有_____________ (写一条);
(2)处理废水时,FeS与Pb2+反应的离子方程式为____________ ;
(3)固体A的主要成分是_______________ (填化学式);
(4)步骤⑤中,所加试剂x为____________ (填标号);
a.Cl2 b.H2O2 c.KMnO4 d.HNO3
(5)检验溶液B完全转化为溶液C的试剂是_________________________ ;
(6)潮湿多雨的夏季,在细菌作用下,废石堆中的硫化铜与硫酸铁转化为含重金属盐的酸性废水(硫元素全部进入溶液中)而污染土壤。该转化反应的离子方程式为____________ ;
(7)已知,常温下FeS、CuS的Ksp分别为6.5x10-18和1.3x10-36)。现用过量的FeS处理含0.01mol·L-1 Cu2+的废水,处理后废水中c(Cu2+)=______ mol·L-1(忽略体积变化)。
(1)提高步骤①反应速率的措施,除温度外,还有
(2)处理废水时,FeS与Pb2+反应的离子方程式为
(3)固体A的主要成分是
(4)步骤⑤中,所加试剂x为
a.Cl2 b.H2O2 c.KMnO4 d.HNO3
(5)检验溶液B完全转化为溶液C的试剂是
(6)潮湿多雨的夏季,在细菌作用下,废石堆中的硫化铜与硫酸铁转化为含重金属盐的酸性废水(硫元素全部进入溶液中)而污染土壤。该转化反应的离子方程式为
(7)已知,常温下FeS、CuS的Ksp分别为6.5x10-18和1.3x10-36)。现用过量的FeS处理含0.01mol·L-1 Cu2+的废水,处理后废水中c(Cu2+)=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】我国科学家以铬铁合金(主要成分铬、铁、镍)为原料,提出了制备氧化铬的“铬铁—三价铬冶金化工联合法”,彻底解决了传统铬生产工艺中六价铬的污染问题,其工艺流程示意图如图。

已知:整个工艺流程,溶液中的铬元素均为+3价。
(1)写出酸浸时的离子方程式____ (至少写2个)。
(2)硫化铬属于难溶电解质,FeS和NiS的溶度积如表所示,试剂a为____ 。将NiS固体加入0.1mol/LFeSO4溶液中,分析是否有FeS生成____ (简述计算过程, ≈5.3)。
≈5.3)。
(3)加入草酸(H2C2O4)生成草酸亚铁的化学方程式____ 。
(4)为满足冶金及颜料级铬绿的要求,氧化铬产品中铁的质量分数应低于0.03%。一种测定氧化铬中铁含量的操作如下:
ⅰ.称取mg氧化铬产品,用酸溶解;
ⅱ.多步操作分离铁和铬;
ⅲ.取含有Fe3+的溶液,调pH,加入指示剂,用cmol/L的无色EDTA—2Na溶液滴定,共消耗EDTA—2Na标准液VmL。
资料:EDTA—2Na和Fe3+按物质的量1:1反应,低浓度时产物无明显颜色。
①指示剂是____ ,滴定终点的现象为____ 。
②氧化铬产品中铁的质量分数是____ 。

已知:整个工艺流程,溶液中的铬元素均为+3价。
(1)写出酸浸时的离子方程式
(2)硫化铬属于难溶电解质,FeS和NiS的溶度积如表所示,试剂a为
 ≈5.3)。
≈5.3)。| 硫化物 | Ksp |
| FeS | 6.3×10-18 |
| NiS | 2.8×10-21 |
(4)为满足冶金及颜料级铬绿的要求,氧化铬产品中铁的质量分数应低于0.03%。一种测定氧化铬中铁含量的操作如下:
ⅰ.称取mg氧化铬产品,用酸溶解;
ⅱ.多步操作分离铁和铬;
ⅲ.取含有Fe3+的溶液,调pH,加入指示剂,用cmol/L的无色EDTA—2Na溶液滴定,共消耗EDTA—2Na标准液VmL。
资料:EDTA—2Na和Fe3+按物质的量1:1反应,低浓度时产物无明显颜色。
①指示剂是
②氧化铬产品中铁的质量分数是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
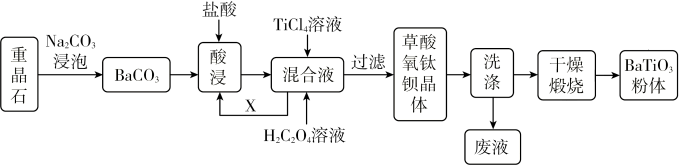
【推荐3】我国重晶石(含BaSO490%以上)资源丰富,其中贵州省重晶石储量占全国总储量的三分之一、某工厂以重晶石为原料,生产“电子陶瓷工业支柱”—钛酸钡(BaTiO3)的工艺流程如下:
查阅资料可知:
①常温下: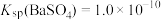 ,
,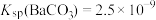 。
。
②TiCl4在常温下是无色液体,遇水容易发生水解:TiCl4+2H2O=TiO2+4HCl。
③草酸氧钛钡的化学式为BaTiO(C2O4)2·4H2O。
请回答下列问题:
(1)BaTiO(C2O4)2·4H2O中Ti元素的化合价为___________ 。
(2)工业上用饱和Na2CO3溶液处理重晶石(假设杂质不与Na2CO3溶液作用),待达到平衡后,移走上层清液,重复多次操作,将BaSO4转化为易溶于酸的BaCO3,该反应的平衡常数K=___________ (填写计算结果)。
(3)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是___________ 。
(4)写出混合液加入TiCl4和H2C2O4溶液反应的化学方程式___________ 。
(5)检验草酸氧钛钡晶体是否洗净的方法___________ 。
(6)煅烧草酸氧钛钡晶体得到BaTiO3的同时,高温下生成的气体产物有CO、___________ 和________ (填化学式)。

查阅资料可知:
①常温下:
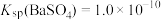 ,
,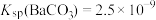 。
。②TiCl4在常温下是无色液体,遇水容易发生水解:TiCl4+2H2O=TiO2+4HCl。
③草酸氧钛钡的化学式为BaTiO(C2O4)2·4H2O。
请回答下列问题:
(1)BaTiO(C2O4)2·4H2O中Ti元素的化合价为
(2)工业上用饱和Na2CO3溶液处理重晶石(假设杂质不与Na2CO3溶液作用),待达到平衡后,移走上层清液,重复多次操作,将BaSO4转化为易溶于酸的BaCO3,该反应的平衡常数K=
(3)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是
(4)写出混合液加入TiCl4和H2C2O4溶液反应的化学方程式
(5)检验草酸氧钛钡晶体是否洗净的方法
(6)煅烧草酸氧钛钡晶体得到BaTiO3的同时,高温下生成的气体产物有CO、
您最近一年使用:0次
【推荐1】某化工厂产生的废渣中含有PbSO4和Ag,为了回收这两种物质,某同学设计了如图过程:
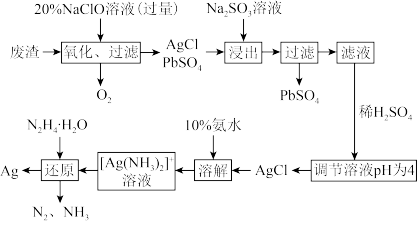
(1)写出NaClO的电子式____ 。
(2)“氧化”阶段需在80℃条件下进行,写出将废渣“氧化”的化学方程式____ 。
(3)已知:①“浸出”过程发生可逆反应:AgCl(s)+2SO (aq)
(aq) Ag(SO3)
Ag(SO3)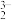 (aq)+Cl-(aq)。
(aq)+Cl-(aq)。
②浸出液中含银化合物总浓度与含硫化合物总浓度及浸出液pH的关系如图。

①由图可知,pH=10时,浸出液中含银化合物总浓度随含硫化合物总浓度的增大而____ (填“增大”、“减小”或“基本不变”),产生该变化的原因是_____ 。
②依题意分析,下列说法合理的是____ 。
A.“浸出”过程中的反应平衡常数表达式为K=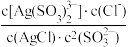
B.若“浸出”过程在敞口容器中进行,浸出时间过长会导致银的浸出率降低
C.pH=5时,随着含硫化合物总浓度的增大,浸出液中含银化合物总浓度基本不变
(4)“还原”阶段氧化产物与还原产物的物质的量之比为_____ 。

(1)写出NaClO的电子式
(2)“氧化”阶段需在80℃条件下进行,写出将废渣“氧化”的化学方程式
(3)已知:①“浸出”过程发生可逆反应:AgCl(s)+2SO
 (aq)
(aq) Ag(SO3)
Ag(SO3)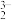 (aq)+Cl-(aq)。
(aq)+Cl-(aq)。②浸出液中含银化合物总浓度与含硫化合物总浓度及浸出液pH的关系如图。

①由图可知,pH=10时,浸出液中含银化合物总浓度随含硫化合物总浓度的增大而
②依题意分析,下列说法合理的是
A.“浸出”过程中的反应平衡常数表达式为K=
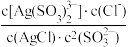
B.若“浸出”过程在敞口容器中进行,浸出时间过长会导致银的浸出率降低
C.pH=5时,随着含硫化合物总浓度的增大,浸出液中含银化合物总浓度基本不变
(4)“还原”阶段氧化产物与还原产物的物质的量之比为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】发生复分解反应的条件是生成沉淀、气体或弱电解质(如水等),利用这一规律,我们可以通过控制条件,使原来“不能进行”的反应真实发生。
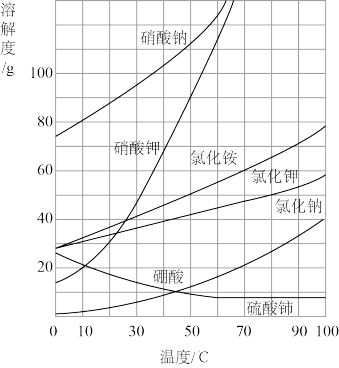
(1)当实验室中盐酸过期无法使用,可通过复分解反应制取少量HCl: 这是利用了HCl的
这是利用了HCl的_____ 性。
(2)侯氏制碱法的反应原理为: 。某同学在学习了物质分类和转化之后,对该反应原理进行了如下解读:
。某同学在学习了物质分类和转化之后,对该反应原理进行了如下解读: 属于
属于_____ (填具体物质类型),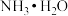 属于碱,它们反应可生成了一种酸式盐,其化学式为
属于碱,它们反应可生成了一种酸式盐,其化学式为_____ ,在一定温度下,该体系中各物质的溶解度如表所示,其中溶解度最小的溶质(即_____ )会析出,也即生成了沉淀反应得以发生。侯氏制碱法的反应原理是否属于离子反应,若是,请写出相应的离子方程式_____ 。若否,请在横线上写“否”。
(3)根据各物质的溶解度随温度变化的曲线,欲使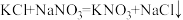 发生,应选择的温度可以是_____(填选项字母)。
发生,应选择的温度可以是_____(填选项字母)。

(1)当实验室中盐酸过期无法使用,可通过复分解反应制取少量HCl:
 这是利用了HCl的
这是利用了HCl的(2)侯氏制碱法的反应原理为:
 。某同学在学习了物质分类和转化之后,对该反应原理进行了如下解读:
。某同学在学习了物质分类和转化之后,对该反应原理进行了如下解读: 属于
属于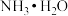 属于碱,它们反应可生成了一种酸式盐,其化学式为
属于碱,它们反应可生成了一种酸式盐,其化学式为| 溶解度/克 |  |  |  |
 | 9.6 | 36.0 | 21.8 |
 | 21.7 | 372 | 100 |
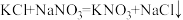 发生,应选择的温度可以是_____(填选项字母)。
发生,应选择的温度可以是_____(填选项字母)。| A.0-10℃ | B.10-20℃ | C.15-45℃ | D.70-80℃ |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
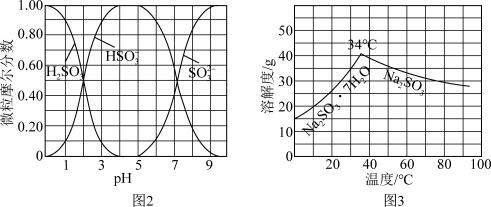
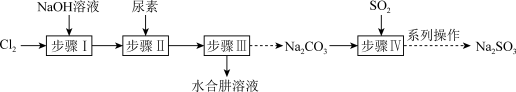
【推荐3】以Cl2、NaOH、CO(NH2)2 (尿素)和SO2为原料可制备N2H4∙H2O (水合肼)和无水Na2SO3,NaHSO3水溶液中含硫微粒随 的分布曲线如图2所示,Na2SO3的溶解度曲线如图3所示)其主要实验流程如下:
的分布曲线如图2所示,Na2SO3的溶解度曲线如图3所示)其主要实验流程如下:
已知:
①Cl2+2OH-=Cl-+ClO-+H2O是放热反应,超过40℃发生副反应。
②N2H4∙H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ用Cl2通入NaOH溶液制备NaClO溶液,Cl2需要缓慢通入的原因:_________________
(2)步骤Ⅱ合成N2H4∙H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应,使用冷凝管和迅速升温的目的分别是:__________

(3)关于实验操作下列说法正确的是______________。
(4)请补充完整由NaHSO3溶液制备较纯的无水Na2SO3的实验方案:
边搅拌边向NaHSO3溶液中滴加NaOH溶液→_______ →_______ →_______ 用少量无水乙醇洗涤、干燥,包装。
a.调节 至10 b.减压抽滤 c.趁热过滤 d.蒸发浓缩至有大量晶体析出
至10 b.减压抽滤 c.趁热过滤 d.蒸发浓缩至有大量晶体析出
e.蒸发浓缩至有晶膜产生,冷却结晶 f.调节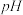 至7
至7
(5)①经某学习小组测定,Na2SO3中含有NaCl杂质,试分析杂质产生的原因:________
②产品的纯度是产品质量的重要指标,该小组同学利用cmol/L的KMnO4测定产品中Na2SO3的含量,装置如图,当酸性KMnO4与Na2SO3恰好完全反应时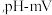 计测得的的电极电势将会迅速增加,KMnO4与Na2SO3反应方程式为(该条件下KMnO4不氧化
计测得的的电极电势将会迅速增加,KMnO4与Na2SO3反应方程式为(该条件下KMnO4不氧化 ):
):
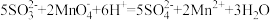
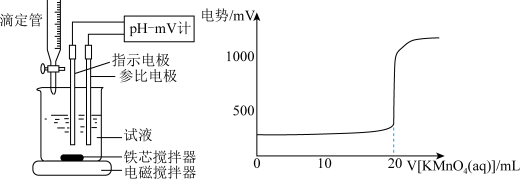
具体流程如下:称量ag样品,加入煮沸后冷却的蒸馏水溶解,配制为250mL的溶液,用碱式滴定管取25.00mL样品溶液于烧杯中,用cmol/L的KMnO4滴定,滴定曲线如图。则样品中Na2SO3纯度的表达式为:________________
 的分布曲线如图2所示,Na2SO3的溶解度曲线如图3所示)其主要实验流程如下:
的分布曲线如图2所示,Na2SO3的溶解度曲线如图3所示)其主要实验流程如下:

已知:
①Cl2+2OH-=Cl-+ClO-+H2O是放热反应,超过40℃发生副反应。
②N2H4∙H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ用Cl2通入NaOH溶液制备NaClO溶液,Cl2需要缓慢通入的原因:
(2)步骤Ⅱ合成N2H4∙H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应,使用冷凝管和迅速升温的目的分别是:

(3)关于实验操作下列说法正确的是______________。
| A.步骤Ⅱ中通过滴液漏斗滴加NaClO溶液 |
| B.步骤Ⅲ为了得到较高浓度的水合肼,可以向水合肼溶液中加入NaOH,减压蒸馏 |
| C.步骤Ⅳ中边搅拌边向Na2CO3溶液中通入SO2至pH约为4时,即可以停止通入SO2 |
| D.为了快速得到无水Na2CO3,可以将产品烘干 |
边搅拌边向NaHSO3溶液中滴加NaOH溶液→
a.调节
 至10 b.减压抽滤 c.趁热过滤 d.蒸发浓缩至有大量晶体析出
至10 b.减压抽滤 c.趁热过滤 d.蒸发浓缩至有大量晶体析出e.蒸发浓缩至有晶膜产生,冷却结晶 f.调节
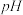 至7
至7(5)①经某学习小组测定,Na2SO3中含有NaCl杂质,试分析杂质产生的原因:
②产品的纯度是产品质量的重要指标,该小组同学利用cmol/L的KMnO4测定产品中Na2SO3的含量,装置如图,当酸性KMnO4与Na2SO3恰好完全反应时
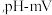 计测得的的电极电势将会迅速增加,KMnO4与Na2SO3反应方程式为(该条件下KMnO4不氧化
计测得的的电极电势将会迅速增加,KMnO4与Na2SO3反应方程式为(该条件下KMnO4不氧化 ):
):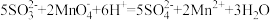

具体流程如下:称量ag样品,加入煮沸后冷却的蒸馏水溶解,配制为250mL的溶液,用碱式滴定管取25.00mL样品溶液于烧杯中,用cmol/L的KMnO4滴定,滴定曲线如图。则样品中Na2SO3纯度的表达式为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】Na2S2O4(连二亚硫酸钠俗称保险粉)是易溶于水、不溶于甲醇的白色固体,在空气中极易被氧化,是一种还原性漂白剂。用HCOONa还原SO2制备Na2S2O4的装置(夹持、加热仪器略)如图所示:
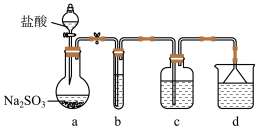
c中溶液是HCOONa、Na2CO3、CH3OH的混合溶液。
(1)装置b中的试剂是_______ ,作用是_______ 。
(2)d中的试剂是_______ 。
(3)装置c在70~83°C反应生成Na2S2O4并析出,同时逸出CO2,该反应的化学方程式为_______ ;对装置c的加热方式是_______ 。
(4)加入CH3OH的目的是_______ 。从反应后的浊液中获得连二亚硫酸钠粗品需要经过的操作步骤和方法为_______ 。
(5)将步骤(4)中得到的粗品进一步提纯的方法是_______ 。
(6)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:①2Na2S2O4+O2+H2O=4NaHSO3或②2Na2S2O4+O2+H2O=4NaHSO3 +NaHSO4请设计实验证明氧化时发生的是②的反应:_______ 。

c中溶液是HCOONa、Na2CO3、CH3OH的混合溶液。
(1)装置b中的试剂是
(2)d中的试剂是
(3)装置c在70~83°C反应生成Na2S2O4并析出,同时逸出CO2,该反应的化学方程式为
(4)加入CH3OH的目的是
(5)将步骤(4)中得到的粗品进一步提纯的方法是
(6)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:①2Na2S2O4+O2+H2O=4NaHSO3或②2Na2S2O4+O2+H2O=4NaHSO3 +NaHSO4请设计实验证明氧化时发生的是②的反应:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】2-溴戊二酸二甲酯是某抗癌药物的重要中间体,其制备的反应原理如下:
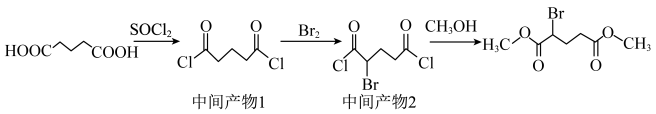
装置示意图如下图所示(夹持装置已略去),实验步骤为:
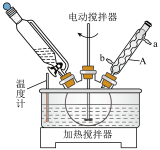
Ⅰ.制备
将10.0g戊二酸加入三颈烧瓶中,再向其中加入三氯甲烷 ,搅拌均匀。保持
,搅拌均匀。保持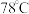 条件下,依次缓慢滴加氯化亚砜
条件下,依次缓慢滴加氯化亚砜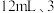 滴催化剂、液溴,随后回流。回流完毕后,将三颈烧瓶置于冰盐浴中,待溶液温度降到
滴催化剂、液溴,随后回流。回流完毕后,将三颈烧瓶置于冰盐浴中,待溶液温度降到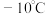 后,缓慢滴加
后,缓慢滴加 甲醇(沸点
甲醇(沸点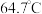 ),保持滴加过程中温度不超过
),保持滴加过程中温度不超过 。
。
Ⅱ.除杂
向三颈烧瓶中加入 饱和碳酸氢钠溶液进行洗涤,分液除去上层水相,下层有机相再用
饱和碳酸氢钠溶液进行洗涤,分液除去上层水相,下层有机相再用 饱和氯化钠溶液洗涤3次。洗涤完毕,用无水硫酸镁干燥,过滤。
饱和氯化钠溶液洗涤3次。洗涤完毕,用无水硫酸镁干燥,过滤。
Ⅲ.提纯过滤后的液体置于热浴容器中(外温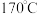 ,接上精馏装置,进行减压蒸馏。
,接上精馏装置,进行减压蒸馏。
Ⅳ.收集产品收集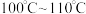 的馏分,得到
的馏分,得到 无色透明油状液体。
无色透明油状液体。
回答下列问题:
(1)仪器
 的名称是
的名称是(2)步骤Ⅰ中采取“温度降到
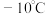 ”、“缓慢滴加”这些措施的可能原因是
”、“缓慢滴加”这些措施的可能原因是(3)步骤Ⅱ中加入饱和氯化钠溶液的目的是
(4)步骤Ⅲ中,热浴容器中应加入
(5)中间产物1(戊二酰氯)比戊二酸的沸点低很多,原因是
(6)从绿色化学角度分析,该实验装置存在明显不足之处,解决的办法是
(7)本实验的产率是
a. b.
b. c.
c. d.
d.
您最近一年使用:0次