已知反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;
反应②CO(g)+1/2O2(g)=CO2(g) ΔH=bkJ·mol-1;
反应③Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。测得在不同温度下,K值如下:
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为_______ 。
(2)反应①为________ (选填“吸热”或“放热”)反应。
(3)700 ℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有______ (填序号)。
A.缩小反应器体积 B.通入CO2 C.温度升高到900 ℃ D.使用合适的催化剂
E.增加Fe的量
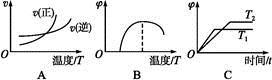
(4)下列图象符合反应①的是______ (填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2)。
(5)由反应①和②可求得,反应2Fe(s)+O2(g)= 2FeO(s)的ΔH=________ 。
(6)请运用盖斯定律写出Fe(固体)被O2(气体)氧化得到Fe2O3(固体)的热化学方程式:______________________________________________ 。
 FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)=CO2(g) ΔH=bkJ·mol-1;
反应③Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为
(2)反应①为
(3)700 ℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有
A.缩小反应器体积 B.通入CO2 C.温度升高到900 ℃ D.使用合适的催化剂
E.增加Fe的量
(4)下列图象符合反应①的是

(5)由反应①和②可求得,反应2Fe(s)+O2(g)= 2FeO(s)的ΔH=
(6)请运用盖斯定律写出Fe(固体)被O2(气体)氧化得到Fe2O3(固体)的热化学方程式:
2014高三·全国·专题练习 查看更多[4]
(已下线)2014届高考化学二轮专题复习 化学反应速率和化学平衡练习卷(已下线)2014高考名师推荐化学影响化学平衡移动的因素(已下线)2014高考名师推荐化学同分异构体的判断辽宁省大连市普兰店第三十八中学2020-2021学年高二上学期第二次考试化学试题
更新时间:2016-12-09 05:54:22
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】 催化氧化C2H6制取C2H4的新路径涉及以下反应:
催化氧化C2H6制取C2H4的新路径涉及以下反应:
反应Ⅰ: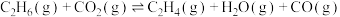

反应Ⅱ: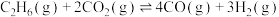

回答下列问题:
(1)计算反应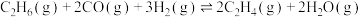 的
的
_______ (用含 和
和 的式子表示)。
的式子表示)。
(2) 和
和 按物质的量1∶1投料,在923K和保持总压恒定的条件下发生反应Ⅰ和反应Ⅱ,研究催化剂X和催化剂Y对“
按物质的量1∶1投料,在923K和保持总压恒定的条件下发生反应Ⅰ和反应Ⅱ,研究催化剂X和催化剂Y对“ 氧化
氧化 制
制 ”的影响,所得实验数据如表:
”的影响,所得实验数据如表:
结合上述数据分析, 催化氧化
催化氧化 制备
制备 的最佳催化剂为
的最佳催化剂为_______ ,判断依据是_______ 。
(3)若向绝热恒容容器中加入 和
和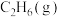 ,发生反应Ⅰ和反应Ⅱ.下列事实不能说明体系达到平衡状态的是_______(填选项字母)。
,发生反应Ⅰ和反应Ⅱ.下列事实不能说明体系达到平衡状态的是_______(填选项字母)。
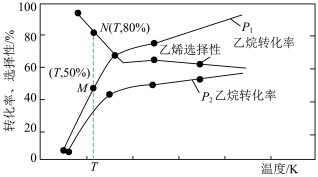
(4)一定条件下,向容积为1.0L的密闭容器中通入2mol 和3mol
和3mol  发生反应Ⅰ和反应Ⅱ,
发生反应Ⅰ和反应Ⅱ, 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度、压强的变化关系如图所示(已知:
的选择性随温度、压强的变化关系如图所示(已知: )。
)。
_______  (填“>”或“<”),理由是
(填“>”或“<”),理由是_______ 。
②压强为 、温度为T K时,反应达平衡时,混合气体中
、温度为T K时,反应达平衡时,混合气体中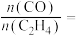
_______ 。
③M点时,反应Ⅰ的平衡常数为_______  (保留2位有效数字)。
(保留2位有效数字)。
 催化氧化C2H6制取C2H4的新路径涉及以下反应:
催化氧化C2H6制取C2H4的新路径涉及以下反应:反应Ⅰ:
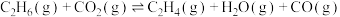

反应Ⅱ:
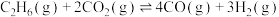

回答下列问题:
(1)计算反应
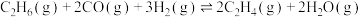 的
的
 和
和 的式子表示)。
的式子表示)。(2)
 和
和 按物质的量1∶1投料,在923K和保持总压恒定的条件下发生反应Ⅰ和反应Ⅱ,研究催化剂X和催化剂Y对“
按物质的量1∶1投料,在923K和保持总压恒定的条件下发生反应Ⅰ和反应Ⅱ,研究催化剂X和催化剂Y对“ 氧化
氧化 制
制 ”的影响,所得实验数据如表:
”的影响,所得实验数据如表:催化剂 |
|
|
催化剂X | 19.0 | 37.6 |
催化剂Y | 18.0 | 21.0 |
 催化氧化
催化氧化 制备
制备 的最佳催化剂为
的最佳催化剂为(3)若向绝热恒容容器中加入
 和
和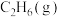 ,发生反应Ⅰ和反应Ⅱ.下列事实不能说明体系达到平衡状态的是_______(填选项字母)。
,发生反应Ⅰ和反应Ⅱ.下列事实不能说明体系达到平衡状态的是_______(填选项字母)。A. | B.反应体系的平衡常数不变 |
| C.容器内气体的密度不变 | D.容器内气体的平均相对分子质量不变 |
(4)一定条件下,向容积为1.0L的密闭容器中通入2mol
 和3mol
和3mol  发生反应Ⅰ和反应Ⅱ,
发生反应Ⅰ和反应Ⅱ, 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度、压强的变化关系如图所示(已知:
的选择性随温度、压强的变化关系如图所示(已知: )。
)。

 (填“>”或“<”),理由是
(填“>”或“<”),理由是②压强为
 、温度为T K时,反应达平衡时,混合气体中
、温度为T K时,反应达平衡时,混合气体中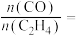
③M点时,反应Ⅰ的平衡常数为
 (保留2位有效数字)。
(保留2位有效数字)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
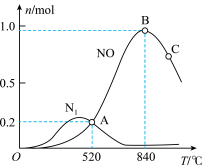
【推荐2】NH3可用于生产硝酸和尿素。
(1)生产硝酸:
①NH3催化氧化是工业制硝酸的第一步反应,其化学方程式是______________ 。
②除此之外,相同条件下还可能发生以下副反应:
4NH3(g)+4O2(g)=2N2O(g)+6H2O(g)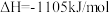
4NH3(g)+3O2(g)=2N2O(g)+6H2O(g)
两个副反应在理论上趋势均很大,但实际生产中影响并不大,原因是______________ 。
(2)生产尿素:
①尿素的合成分两步进行;
a.2NH3(g)+CO2(g) NH2COONH4(l)
NH2COONH4(l) 
b.NH2COONH4(l) CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l) 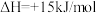
则总反应2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l)的
CO(NH2)2(l)+H2O(l)的 =
=_____________ 。
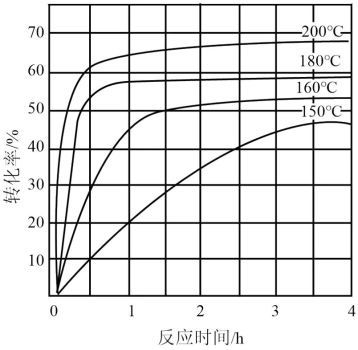
②下图为n(NH3):n(CO2)=4:1时,温度对CO2的转化率的影响。解释温度升高CO2的平衡转化率增大的原因:______________ 。
③测定尿素样品含氮量的方法如下:取a g尿素样品,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则尿素样品中氮元素的质量分数是______________ 。
(1)生产硝酸:
①NH3催化氧化是工业制硝酸的第一步反应,其化学方程式是
②除此之外,相同条件下还可能发生以下副反应:
4NH3(g)+4O2(g)=2N2O(g)+6H2O(g)
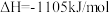
4NH3(g)+3O2(g)=2N2O(g)+6H2O(g)

两个副反应在理论上趋势均很大,但实际生产中影响并不大,原因是
(2)生产尿素:
①尿素的合成分两步进行;
a.2NH3(g)+CO2(g)
 NH2COONH4(l)
NH2COONH4(l) 
b.NH2COONH4(l)
 CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l) 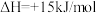
则总反应2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l)的
CO(NH2)2(l)+H2O(l)的 =
=②下图为n(NH3):n(CO2)=4:1时,温度对CO2的转化率的影响。解释温度升高CO2的平衡转化率增大的原因:

③测定尿素样品含氮量的方法如下:取a g尿素样品,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则尿素样品中氮元素的质量分数是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】党的二十大报告中强调“实现碳达峰碳中和是一-场广泛而深刻的经济社会系统性变革”。CO2的转化和利用是实现碳中和的有效途径。回答下列问题。
Ⅰ.利用CO2合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)  = -49kJ/mol
= -49kJ/mol
②CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)  =+41.17kJ/mol
=+41.17kJ/mol
③CO(g)+2H2(g) CH3OH(g)
CH3OH(g) 
(1)反应③中 =
=___________ ,该反应的自发条件是___________ (填“高温自发“低温自发”或“任何温度下都自发",该反应中活化能Ea (逆)___________ Ea(正)(填“>”或“<”)。
(2)在催化剂作用下,按n(CO2):n(H2)=1:3的比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时CO2的转化率、甲醇的选择性如图所示:

已知:甲醇的选择性=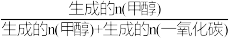 ×100%
×100%
T1K时,若反应从开始到达到a点所用时间为10min,则v(CH3OH)=___________ MPa· min-1,反应②的Kp=___________ (Kp指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压=A的物质的量分数×P,最终结果用分数表示)。
Ⅱ.已知CH3OH与的反应可将化学能转化为电能,其工作原理如图所示。

(3)图中O2从___________ (填A或B)通入,a极的电极反应式是___________ 。
Ⅰ.利用CO2合成淀粉的研究成果已经被我国科学家发表在Nature杂志上。其涉及的关键反应如下:
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)  = -49kJ/mol
= -49kJ/mol ②CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g)  =+41.17kJ/mol
=+41.17kJ/mol③CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g) 
(1)反应③中
 =
=(2)在催化剂作用下,按n(CO2):n(H2)=1:3的比例向某密闭容器中通入一定量的原料气只发生①②两个反应。维持压强为3.2MPa,测得不同温度下,反应经过相同时间时CO2的转化率、甲醇的选择性如图所示:

已知:甲醇的选择性=
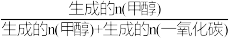 ×100%
×100%T1K时,若反应从开始到达到a点所用时间为10min,则v(CH3OH)=
Ⅱ.已知CH3OH与的反应可将化学能转化为电能,其工作原理如图所示。

(3)图中O2从
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】能源是国民经济和社会发展的重要物质基础,化学在能源开发利用中发挥着重要的作用。请按要求完成下列填空。
(1)在能源的分类中,直接从自然界取得的能源称为___________ 能源,如流水,风力等。这些能源经过加工转换得到的能源称为___________ 能源,如电力,蒸气等。
(2)2021年10月16日0时23分,搭载神舟十三号载人飞船的长征二号遥十三运载火箭发射圆满成功,该型火箭用液态四氧化二氮(N2O4)和偏二甲肼(C2H8N2)作推进剂,已知10g液态偏二甲肼与液态四氧化二氮燃烧生成CO2(g),H2O(g),N2(g)并放出425kJ热量,且H2O(l)=H2O(g) △H=+44.0kJ/mol,则液态C2H8N2与足量液态N2O4完全反应生成CO2(g),H2O(l),N2(g)的热化学方程式:___________ 。
(3)化学反应的本质是旧键的断裂,新键的形成并时伴有能量的变化,已知拆开1molN-N键,1molN-H键,1molN≡N键,1molO-H键,1molO=O键所需要的能量分别是akJ,bkJ,ckJ,dkJ,ekJ。则N2H4与O2反应生成N2和水蒸气的热化学方程式:___________ 。
(4)燃料电池的能量转换率远超普通的燃烧过程,请写出碱性条件下N2H4燃料电池(氧化剂为氧气,生成物均为无毒无害的物质)的电极反应式。正极___________ 负极___________ 。
(5)在化学的发展过程中电解技术的发展对科学和社会的进步起到了巨大的推动作用。如著名的氯碱工业,活泼金属的发现等。请写出用惰性电极电解饱和食盐水的电极反应式。阳极___________ 阴极___________ 。
(1)在能源的分类中,直接从自然界取得的能源称为
(2)2021年10月16日0时23分,搭载神舟十三号载人飞船的长征二号遥十三运载火箭发射圆满成功,该型火箭用液态四氧化二氮(N2O4)和偏二甲肼(C2H8N2)作推进剂,已知10g液态偏二甲肼与液态四氧化二氮燃烧生成CO2(g),H2O(g),N2(g)并放出425kJ热量,且H2O(l)=H2O(g) △H=+44.0kJ/mol,则液态C2H8N2与足量液态N2O4完全反应生成CO2(g),H2O(l),N2(g)的热化学方程式:
(3)化学反应的本质是旧键的断裂,新键的形成并时伴有能量的变化,已知拆开1molN-N键,1molN-H键,1molN≡N键,1molO-H键,1molO=O键所需要的能量分别是akJ,bkJ,ckJ,dkJ,ekJ。则N2H4与O2反应生成N2和水蒸气的热化学方程式:
(4)燃料电池的能量转换率远超普通的燃烧过程,请写出碱性条件下N2H4燃料电池(氧化剂为氧气,生成物均为无毒无害的物质)的电极反应式。正极
(5)在化学的发展过程中电解技术的发展对科学和社会的进步起到了巨大的推动作用。如著名的氯碱工业,活泼金属的发现等。请写出用惰性电极电解饱和食盐水的电极反应式。阳极
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】由化学能产生热能是目前人类使用能源的主要途径。回答下列问题:
(1)图1表示反应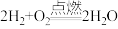 的能量变化。
的能量变化。
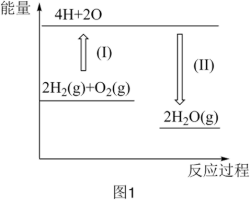
已知断开1molH—H键、1mol 键和1molH—O键分别需要消耗436kJ、496kJ和463kJ的能量。则反应过程(Ⅱ)中生成2mol
键和1molH—O键分别需要消耗436kJ、496kJ和463kJ的能量。则反应过程(Ⅱ)中生成2mol (g)时
(g)时_______ (填“吸收”或“放出”)_______ kJ能量。
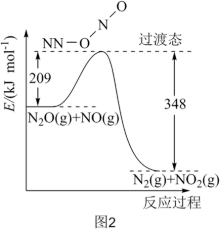
(2)由 和NO反应生成
和NO反应生成 和
和 的能量变化如图2所示。其正反应的活化能为
的能量变化如图2所示。其正反应的活化能为_______  ,若反应生成
,若反应生成 ,其
,其
_______  。
。
(3)在25℃、101kPa下,一定质量的CH3CH2OH(l)完全燃烧生成液态水时放出热量 kJ,其燃烧生成的
kJ,其燃烧生成的 用过量饱和石灰水吸收可得100g
用过量饱和石灰水吸收可得100g 沉淀,则CH3CH2OH燃烧的热化学方程式为
沉淀,则CH3CH2OH燃烧的热化学方程式为_______ 。
(1)图1表示反应
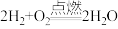 的能量变化。
的能量变化。
已知断开1molH—H键、1mol
 键和1molH—O键分别需要消耗436kJ、496kJ和463kJ的能量。则反应过程(Ⅱ)中生成2mol
键和1molH—O键分别需要消耗436kJ、496kJ和463kJ的能量。则反应过程(Ⅱ)中生成2mol (g)时
(g)时(2)由
 和NO反应生成
和NO反应生成 和
和 的能量变化如图2所示。其正反应的活化能为
的能量变化如图2所示。其正反应的活化能为 ,若反应生成
,若反应生成 ,其
,其
 。
。
(3)在25℃、101kPa下,一定质量的CH3CH2OH(l)完全燃烧生成液态水时放出热量
 kJ,其燃烧生成的
kJ,其燃烧生成的 用过量饱和石灰水吸收可得100g
用过量饱和石灰水吸收可得100g 沉淀,则CH3CH2OH燃烧的热化学方程式为
沉淀,则CH3CH2OH燃烧的热化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】碳是形成化合物种类最多的元素,其单质及其部分化合物是人类生产、生活的主要能源物质。回答下列问题:
(1)1molCO完全燃烧生成 放出283kJ热量,热化学方程式为
放出283kJ热量,热化学方程式为___________ 。
(2)12g固体碳完全燃烧时放出的热量为395kJ,则生成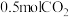 时放出的热量为
时放出的热量为___________ kJ。
(3)有机物M经过太阳光光照可转化成N,转化过程如下:

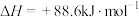 ,则M、N相比,较稳定的是
,则M、N相比,较稳定的是___________ 。
(4)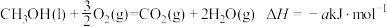 ,则a
,则a___________ (填“>”“<”或“=”)238.6.(已知甲醇的燃烧热为 )
)
(5)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料, ,则反应过程中,每转移1mol电子放出的热量为
,则反应过程中,每转移1mol电子放出的热量为___________ 。
(6)使 和
和 通过灼热的炭层,生成HCl和
通过灼热的炭层,生成HCl和 ,当有
,当有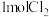 参与反应时释放出145kJ热量,写出该反应的热化学方程式:
参与反应时释放出145kJ热量,写出该反应的热化学方程式:___________ 。
(1)1molCO完全燃烧生成
 放出283kJ热量,热化学方程式为
放出283kJ热量,热化学方程式为(2)12g固体碳完全燃烧时放出的热量为395kJ,则生成
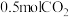 时放出的热量为
时放出的热量为(3)有机物M经过太阳光光照可转化成N,转化过程如下:

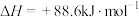 ,则M、N相比,较稳定的是
,则M、N相比,较稳定的是(4)
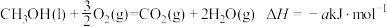 ,则a
,则a )
)(5)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,
 ,则反应过程中,每转移1mol电子放出的热量为
,则反应过程中,每转移1mol电子放出的热量为(6)使
 和
和 通过灼热的炭层,生成HCl和
通过灼热的炭层,生成HCl和 ,当有
,当有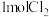 参与反应时释放出145kJ热量,写出该反应的热化学方程式:
参与反应时释放出145kJ热量,写出该反应的热化学方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】合成氨的发展体现了化学科学与技术的不断进步。
(1)1898年,化学家用氮气、碳化钙(CaC2)与水蒸气反应制备氨:
i.碳化钙和氮气在1000℃的高温下产生氰氨化钙(CaCN2);
ii.氰氨化钙与水蒸气反应生成氨气。
写出反应ii的化学方程式:___________ 。
(2)20世纪初,以N2和H2为原料的工业合成氨方法研制成功。其反应为: 。
。
①N2的化学性质稳定,即使在高温、高压下,N2和H2的化合反应仍然进行得十分缓慢。从分子结构角度解释原因:___________ 。
②压强对合成氨有较大影响。下图为不同压强下,以物质的量分数x(H2)=0.75、x(N2)=0.25进料(组成1),反应达平衡时,x(NH3)与温度的计算结果。

i.判断压强:p1___________ p2(填“>”或“<”),简述理由:___________ 。
ii.在p1、x(NH3)=0.20时,氮气的转化率为___________ 。
iii.合成氨原料气中存在不参与反应的Ar时会影响NH3的平衡含量。在p1时,以物质的量分数x(H2)=0.675、x(N2)=0.225、x(Ar)=0.10进料(组成2),反应达平衡时x(NH3)与温度的计算结果与组成1相比有一定变化,在上图中用虚线画出相应曲线__________ 。
(3)我国科学家研制出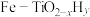 双催化剂,通过光辐射产生温差(如体系温度为495℃时,纳米Fe的温度为547℃,而
双催化剂,通过光辐射产生温差(如体系温度为495℃时,纳米Fe的温度为547℃,而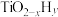 的温度为415℃,解决了温度对合成氨工业反应速率和平衡转化率影响矛盾的问题,其催化合成氨机理如图所示。
的温度为415℃,解决了温度对合成氨工业反应速率和平衡转化率影响矛盾的问题,其催化合成氨机理如图所示。

分析解释:与传统的催化合成氨(铁触媒、 )相比,
)相比,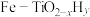 双催化剂双温催化合成氨具备优势的原因是
双催化剂双温催化合成氨具备优势的原因是___________ 。
(1)1898年,化学家用氮气、碳化钙(CaC2)与水蒸气反应制备氨:
i.碳化钙和氮气在1000℃的高温下产生氰氨化钙(CaCN2);
ii.氰氨化钙与水蒸气反应生成氨气。
写出反应ii的化学方程式:
(2)20世纪初,以N2和H2为原料的工业合成氨方法研制成功。其反应为:
 。
。①N2的化学性质稳定,即使在高温、高压下,N2和H2的化合反应仍然进行得十分缓慢。从分子结构角度解释原因:
②压强对合成氨有较大影响。下图为不同压强下,以物质的量分数x(H2)=0.75、x(N2)=0.25进料(组成1),反应达平衡时,x(NH3)与温度的计算结果。

i.判断压强:p1
ii.在p1、x(NH3)=0.20时,氮气的转化率为
iii.合成氨原料气中存在不参与反应的Ar时会影响NH3的平衡含量。在p1时,以物质的量分数x(H2)=0.675、x(N2)=0.225、x(Ar)=0.10进料(组成2),反应达平衡时x(NH3)与温度的计算结果与组成1相比有一定变化,在上图中用虚线画出相应曲线
(3)我国科学家研制出
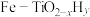 双催化剂,通过光辐射产生温差(如体系温度为495℃时,纳米Fe的温度为547℃,而
双催化剂,通过光辐射产生温差(如体系温度为495℃时,纳米Fe的温度为547℃,而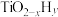 的温度为415℃,解决了温度对合成氨工业反应速率和平衡转化率影响矛盾的问题,其催化合成氨机理如图所示。
的温度为415℃,解决了温度对合成氨工业反应速率和平衡转化率影响矛盾的问题,其催化合成氨机理如图所示。
分析解释:与传统的催化合成氨(铁触媒、
 )相比,
)相比,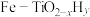 双催化剂双温催化合成氨具备优势的原因是
双催化剂双温催化合成氨具备优势的原因是
您最近一年使用:0次
【推荐2】2022年4月16日,中国空间站的3名航天员乘神舟十三号载人飞船平安返回地球。空间站处理CO2的一种重要方法是对CO2进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:
Ⅰ.固态胺吸收与浓缩CO2
在水蒸气存在下固态胺吸收CO2反应生成酸式碳酸盐(该反应是放热反应),再解吸出CO2的简单方法是加热。
Ⅱ.CO2的加氢甲烷化
H2还原CO2制CH4的部分反应如下:
i.CO2(g)+H2(g) CO(g)+H2O(g) △H1=+41kJ•mol-1
CO(g)+H2O(g) △H1=+41kJ•mol-1
ii.CO(g)+3H2(g) CH4(g)+H2O(g) △H2=-246kJ•mol-1
CH4(g)+H2O(g) △H2=-246kJ•mol-1
(1)反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的△H=
CH4(g)+2H2O(g)的△H=________ kJ•mol-1。
(2)向恒容绝热的密闭容器中充入amolCO与2amolH2(g),进行反应ii,下列能判断反应已达化学平衡状态的是________
a.容器中混合气体密度不变 b.混合气体中c(CH4)与c(H2O)之比不变
c.v正(H2)=3v逆(H2O) d.容器内温度不变
Ⅲ.CO2和H2合成甲烷也是CO2资源化利用的重要方法。对于上述(1)的反应CO2(g)+4H2(g) CH4(g)+2H2O(g) △H,催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如图所示:
CH4(g)+2H2O(g) △H,催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如图所示:_______ 。
(4)对比上述两种催化剂的催化性能,工业上应选择的催化剂是_______ ,使用的合适温度为_______ 。
(5)控制起始时 =4,p=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
=4,p=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:________ (填“a”、“b”或“c”);温度低于500℃时,CO的物质的量分数约为0,说明此条件下,反应________ (填“i”或“ii”)化学平衡常数大,反应完全。
②M点(T<500℃)时,平衡分压p(CO2)=________ atm,反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的平衡常数Kp=
CH4(g)+2H2O(g)的平衡常数Kp=________ atm-2(用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
Ⅰ.固态胺吸收与浓缩CO2
在水蒸气存在下固态胺吸收CO2反应生成酸式碳酸盐(该反应是放热反应),再解吸出CO2的简单方法是加热。
Ⅱ.CO2的加氢甲烷化
H2还原CO2制CH4的部分反应如下:
i.CO2(g)+H2(g)
 CO(g)+H2O(g) △H1=+41kJ•mol-1
CO(g)+H2O(g) △H1=+41kJ•mol-1ii.CO(g)+3H2(g)
 CH4(g)+H2O(g) △H2=-246kJ•mol-1
CH4(g)+H2O(g) △H2=-246kJ•mol-1(1)反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的△H=
CH4(g)+2H2O(g)的△H=(2)向恒容绝热的密闭容器中充入amolCO与2amolH2(g),进行反应ii,下列能判断反应已达化学平衡状态的是
a.容器中混合气体密度不变 b.混合气体中c(CH4)与c(H2O)之比不变
c.v正(H2)=3v逆(H2O) d.容器内温度不变
Ⅲ.CO2和H2合成甲烷也是CO2资源化利用的重要方法。对于上述(1)的反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g) △H,催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如图所示:
CH4(g)+2H2O(g) △H,催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如图所示: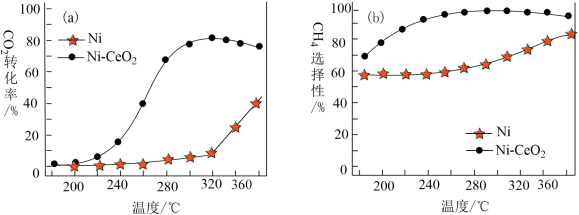
(4)对比上述两种催化剂的催化性能,工业上应选择的催化剂是
(5)控制起始时
 =4,p=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
=4,p=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示: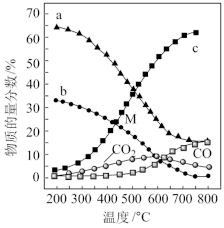
②M点(T<500℃)时,平衡分压p(CO2)=
 CH4(g)+2H2O(g)的平衡常数Kp=
CH4(g)+2H2O(g)的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】氮是一种重要的元素,含氮化合物是化工、能源、环保等领域的研究热点。回答下列问题:
(1)已知:
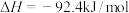

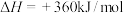

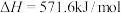
试写出表示氨气的燃烧热的热化学方程式:_______ 。
(2)已知:合成尿素 的反应为
的反应为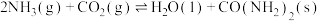
 。向恒容密闭容器中按物质的量之比4:1充入
。向恒容密闭容器中按物质的量之比4:1充入 和
和 ,使反应进行,保持温度不变,测得
,使反应进行,保持温度不变,测得 的转化率随时问的变化情况如图所示。
的转化率随时问的变化情况如图所示。

①若用 的浓度变化表示反应速率,则A点的逆反应速率
的浓度变化表示反应速率,则A点的逆反应速率_______ (填“>”“<”或“=”) B点的正反应速率。
②下列叙述中不能说明该反成达到平衡状态的是_______ (填选项字母)。
A.体系压强不再变化
B.气体平均摩尔质量不再变化
C. 的消耗速率和
的消耗速率和 的消耗速率之比为2:1
的消耗速率之比为2:1
D.固体质量不再发生变化
③工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有_______ (填选项字母)。
A.升高温度 B.充入氮气 C.将尿素及时分离出去 D.增大反应体系的压强
(3)传统的尿素生产,以二氧化碳和氨在高温、高压下,合成、转化得到,工艺耗能较高,且产率较低。最近我国科学家发现 纳米片负载的Pd-Cu合金纳米颗粒电催化剂可以将水溶液中的
纳米片负载的Pd-Cu合金纳米颗粒电催化剂可以将水溶液中的 和
和 直接转化为尿素(反应机理如下图所示,*表示催化剂活性中心原子)。
直接转化为尿素(反应机理如下图所示,*表示催化剂活性中心原子)。

根据以上反应机理,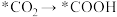 的过程中,断裂的是
的过程中,断裂的是_______ (填“极性键”或“非极性键”,下同),形成的是_______ 。与传统生产工艺相比,这种新方法的优点是_______ (答出一点即可)。
(4)氨催化氧化时会发生下列两个竞争反应I、II。
反应I: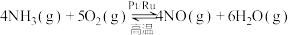 ;
;
反应II: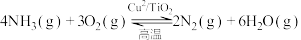 。
。
为分析某催化剂对该反成的选择性,在1L密闭容器中充入1mol 和2mol
和2mol ,测得有关物质的量关系如下图:
,测得有关物质的量关系如下图:
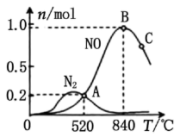
该催化剂在高温时选择反应_______ (填“I”或“II”)。
(1)已知:

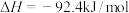

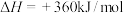

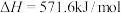
试写出表示氨气的燃烧热的热化学方程式:
(2)已知:合成尿素
 的反应为
的反应为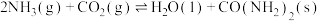
 。向恒容密闭容器中按物质的量之比4:1充入
。向恒容密闭容器中按物质的量之比4:1充入 和
和 ,使反应进行,保持温度不变,测得
,使反应进行,保持温度不变,测得 的转化率随时问的变化情况如图所示。
的转化率随时问的变化情况如图所示。
①若用
 的浓度变化表示反应速率,则A点的逆反应速率
的浓度变化表示反应速率,则A点的逆反应速率②下列叙述中不能说明该反成达到平衡状态的是
A.体系压强不再变化
B.气体平均摩尔质量不再变化
C.
 的消耗速率和
的消耗速率和 的消耗速率之比为2:1
的消耗速率之比为2:1 D.固体质量不再发生变化
③工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有
A.升高温度 B.充入氮气 C.将尿素及时分离出去 D.增大反应体系的压强
(3)传统的尿素生产,以二氧化碳和氨在高温、高压下,合成、转化得到,工艺耗能较高,且产率较低。最近我国科学家发现
 纳米片负载的Pd-Cu合金纳米颗粒电催化剂可以将水溶液中的
纳米片负载的Pd-Cu合金纳米颗粒电催化剂可以将水溶液中的 和
和 直接转化为尿素(反应机理如下图所示,*表示催化剂活性中心原子)。
直接转化为尿素(反应机理如下图所示,*表示催化剂活性中心原子)。
根据以上反应机理,
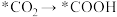 的过程中,断裂的是
的过程中,断裂的是(4)氨催化氧化时会发生下列两个竞争反应I、II。
反应I:
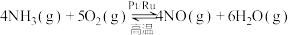 ;
;反应II:
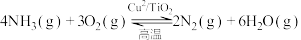 。
。为分析某催化剂对该反成的选择性,在1L密闭容器中充入1mol
 和2mol
和2mol ,测得有关物质的量关系如下图:
,测得有关物质的量关系如下图:
该催化剂在高温时选择反应
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】 作为一种重要的化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究着被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
作为一种重要的化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究着被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应Ⅰ: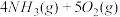

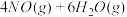 △H=
△H=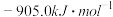
反应Ⅱ: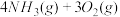
 2N2(g)+6H2O(g)
2N2(g)+6H2O(g) 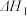
(1)在恒温恒容装置中充入一定量的 和
和 ,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是
,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是___________________ 。
A. 使用催化剂时,可降低该反应的活化能,加快其反应速率
B. 若测得容器内 时,说明反应已达平衡
时,说明反应已达平衡
C. 当容器内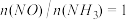 时,说明反应已达平衡
时,说明反应已达平衡
D. 当测得容器内氧气浓度不再变化时,说明反应已达达平衡
(2)氨催化氧化时会发生上述两个竞争反应Ⅰ、Ⅱ。为分析某催化剂对该反应的选择性,1L密闭容器中充入1 mol 和2 mol
和2 mol  ,测得有关物质的量关系如图
,测得有关物质的量关系如图
①该催化剂在高温时选择反应_______________ (填“Ⅰ”或“Ⅱ”)。
②520℃时,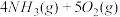

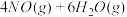 的平衡常数K表达式
的平衡常数K表达式________ 。
③有利于提高 转化为
转化为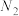 的速率的措施有
的速率的措施有_________________ 。
A. 使用催化剂
B. 将反应生成的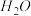 及时移出
及时移出
C. 充入稀有气体
D. 投料比不变,增加反应物的浓度
E. 降低反应温度
(3)最近华南理工大提出利用电解法制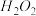 并用产生的
并用产生的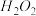 处理废氨水,装置如图
处理废氨水,装置如图

①为了不影响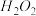 的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)
的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)_________ c(NO3-)(填>、=、<)。
②Ir-Ru惰性电极有吸附 作用,该电极上产生
作用,该电极上产生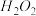 的反应为
的反应为_________ ,生成的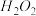 与废液反应的离子方程式为
与废液反应的离子方程式为_________________ 。
③理论上电路中每转移3 mol电子,最多可以处理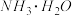 的物质的量为
的物质的量为__________ 。
 作为一种重要的化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究着被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
作为一种重要的化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究着被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:反应Ⅰ:
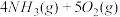

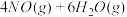 △H=
△H=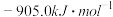
反应Ⅱ:
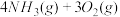
 2N2(g)+6H2O(g)
2N2(g)+6H2O(g) 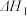
(1)在恒温恒容装置中充入一定量的
 和
和 ,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是
,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是A. 使用催化剂时,可降低该反应的活化能,加快其反应速率
B. 若测得容器内
 时,说明反应已达平衡
时,说明反应已达平衡C. 当容器内
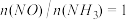 时,说明反应已达平衡
时,说明反应已达平衡D. 当测得容器内氧气浓度不再变化时,说明反应已达达平衡
(2)氨催化氧化时会发生上述两个竞争反应Ⅰ、Ⅱ。为分析某催化剂对该反应的选择性,1L密闭容器中充入1 mol
 和2 mol
和2 mol  ,测得有关物质的量关系如图
,测得有关物质的量关系如图
①该催化剂在高温时选择反应
②520℃时,
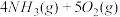

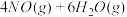 的平衡常数K表达式
的平衡常数K表达式③有利于提高
 转化为
转化为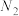 的速率的措施有
的速率的措施有A. 使用催化剂
B. 将反应生成的
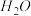 及时移出
及时移出C. 充入稀有气体
D. 投料比不变,增加反应物的浓度
E. 降低反应温度
(3)最近华南理工大提出利用电解法制
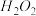 并用产生的
并用产生的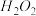 处理废氨水,装置如图
处理废氨水,装置如图
①为了不影响
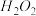 的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)
的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)②Ir-Ru惰性电极有吸附
 作用,该电极上产生
作用,该电极上产生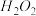 的反应为
的反应为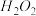 与废液反应的离子方程式为
与废液反应的离子方程式为③理论上电路中每转移3 mol电子,最多可以处理
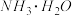 的物质的量为
的物质的量为
您最近一年使用:0次
【推荐2】乙基叔丁基酸(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂,用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为C2H5OH(g)+IB(g)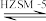 ETBE(g) ΔH。回答下列问题:
ETBE(g) ΔH。回答下列问题:
(1)反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的ΔH=a kJ/mol,下列选项正确的是_____________ (填序号)。
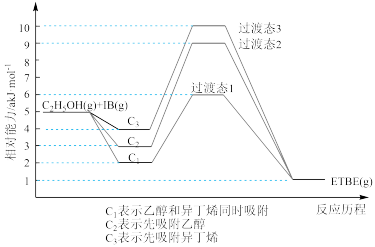
A.反应历程的最优途径是C1
B.HZSM-5没有参加化学反应
C.相同条件下,采用不同途径时,乙醇的平衡转化率C1>C2>C3
D.升高反应温度有利于提高平衡产率
(2)向刚性容器中按物质的量之比1∶1充入乙醇和异丁烯,在温度为378K与388K时异丁烯的转化率随时间变化如图所示。
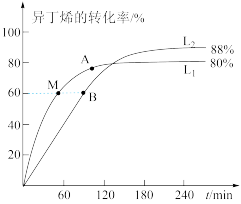
①图中A、M两点,正反应速率由大到小的顺序为_____ ,图中A、M、B三点其中逆反应速率最大的点是_______________ (用符号A、M、B填写)。
②388K时,容器内起始总压为P0Pa,用分压表示的该反应的平衡常数Kp=_________ Pa (用含有P0的式子表示,已知分压=总压×物质的量分数)。
③瑞典化学家阿累尼乌斯的化学反应速率经验定律为: (其中,K为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是
(其中,K为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是___ (填序号,K正、K逆为正、逆速率常数)。
A.其他条件不变,升高温度,K正增大,K逆变小
B.其他条件不变,使用催化剂,K正、K逆同倍数增大
C.其他条件不变,增大反应物浓度K正增大,K逆不变
D.其他条件不变,减小压强,K正、K逆都变小
已知反应速率v=v正-v逆=K正P(C2H5OH)·P(IB)-K逆P(ETBE),计算上图中M点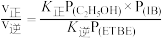 =
=_______________ (保留两位小数)。
 ETBE(g) ΔH。回答下列问题:
ETBE(g) ΔH。回答下列问题:(1)反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的ΔH=a kJ/mol,下列选项正确的是

A.反应历程的最优途径是C1
B.HZSM-5没有参加化学反应
C.相同条件下,采用不同途径时,乙醇的平衡转化率C1>C2>C3
D.升高反应温度有利于提高平衡产率
(2)向刚性容器中按物质的量之比1∶1充入乙醇和异丁烯,在温度为378K与388K时异丁烯的转化率随时间变化如图所示。

①图中A、M两点,正反应速率由大到小的顺序为
②388K时,容器内起始总压为P0Pa,用分压表示的该反应的平衡常数Kp=
③瑞典化学家阿累尼乌斯的化学反应速率经验定律为:
 (其中,K为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是
(其中,K为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是A.其他条件不变,升高温度,K正增大,K逆变小
B.其他条件不变,使用催化剂,K正、K逆同倍数增大
C.其他条件不变,增大反应物浓度K正增大,K逆不变
D.其他条件不变,减小压强,K正、K逆都变小
已知反应速率v=v正-v逆=K正P(C2H5OH)·P(IB)-K逆P(ETBE),计算上图中M点
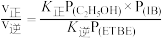 =
=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】研究化学反应速率与平衡原理有助于学科思维的提升。
(1)已知焓变与熵变有如下关系:△G=ΔH-TΔS,某反应当△G<0时自发,△G>0不自发。今有A、B、C、D四个反应的焓变、熵变数据如下:
①在任何温度下都能自发进行的反应是_______ (选填ABCD序号,下同);
②任何温度下都不能自发进行的反应是_______ 。
(2)利用图所示装置,可测定盐酸与碳酸钙反应生成CO2的反应速率。请根据要求填空:
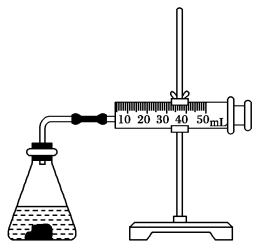
①连接仪器、检查装置气密后,在锥形瓶中加入5 g碳酸钙,迅速加入20 mL 1 mol·L-1盐酸,塞紧瓶塞。
②每隔10 s观测注射器中气体的体积,并以mL·s-1为反应速率的单位,计算每10 s内的反应速率。数据处理的结果见下表:
表格中的“?”处应填的数据是_______ ;从反应速率随时间变化的数据可知,本实验中反应速率与_______ 和_______ 有关。
(3)反应速率(v)和反应物浓度(c)的关系可以用实验方法测定。如化学反应 的正反应速率可表示为
的正反应速率可表示为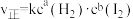 ,式中k为常数,a、b的值可用下表数据确定。据表中数据可推出a=
,式中k为常数,a、b的值可用下表数据确定。据表中数据可推出a=_______ 、b=_______ 。
(4)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),K为化学平衡常数,K和温度的关系如下表:
CO(g)+H2O(g),K为化学平衡常数,K和温度的关系如下表:
根据以上信息推断:
①该反应为_______ 热反应;
②达到平衡后,在其他条件不变情况下加入干燥剂无水氯化钙,氢气的转化率将_______ ;
③1000℃,某时刻CO2、H2、CO、H2O的物质的量分别为0.2mol、0.8mol、0.4mol、0.4mol,此时V正_______ V逆(填“>”、“<”或“=”)。
(5)在3种不同条件下,分别向容积为2 L的恒容密闭容器中充入2 mol A和1 mol B,发生反应:2A(g)+B(g) 2D(g) ΔH=Q kJ·mol-1。相关条件和数据见下表。回答:
2D(g) ΔH=Q kJ·mol-1。相关条件和数据见下表。回答:
①K1、K2和K3三者的关系为_______ ;
②实验Ⅱ改变的条件可能是:_______ ;
③分别达平衡后,实验Ⅰ与实验Ⅲ容器内的压强大小关系是:Ⅰ_______ Ⅲ(选填“大于”、“小于”、“等于”);
④实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,平衡将_______ (选填“朝正向移动”、“朝逆向移动”、“不移动”)。
(1)已知焓变与熵变有如下关系:△G=ΔH-TΔS,某反应当△G<0时自发,△G>0不自发。今有A、B、C、D四个反应的焓变、熵变数据如下:
| 反应 | A | B | C | D |
| ΔH/(kJ·mol-1) | 10.5 | 1.80 | -126 | -11.7 |
| ΔS/(J·mol-1·K-1) | 30.0 | -113.0 | 84.0 | -105.0 |
②任何温度下都不能自发进行的反应是
(2)利用图所示装置,可测定盐酸与碳酸钙反应生成CO2的反应速率。请根据要求填空:

①连接仪器、检查装置气密后,在锥形瓶中加入5 g碳酸钙,迅速加入20 mL 1 mol·L-1盐酸,塞紧瓶塞。
②每隔10 s观测注射器中气体的体积,并以mL·s-1为反应速率的单位,计算每10 s内的反应速率。数据处理的结果见下表:
| 时间/s | 10 | 20 | 30 | 40 | 50 | 60 |
| 气体体积/mL | 4 | 14 | 25 | 38 | 47 | 55 |
| 反应速率/(mL·s-1) | 0.4 | 1.0 | 1.1 | ? | 0.9 | 0.8 |
(3)反应速率(v)和反应物浓度(c)的关系可以用实验方法测定。如化学反应
 的正反应速率可表示为
的正反应速率可表示为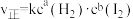 ,式中k为常数,a、b的值可用下表数据确定。据表中数据可推出a=
,式中k为常数,a、b的值可用下表数据确定。据表中数据可推出a=| c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | v/(mol·L-1·s-1) |
| 0.5 | 4.0 | 1.0k |
| 1.0 | 4.0 | 2.0k |
 CO(g)+H2O(g),K为化学平衡常数,K和温度的关系如下表:
CO(g)+H2O(g),K为化学平衡常数,K和温度的关系如下表:| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应为
②达到平衡后,在其他条件不变情况下加入干燥剂无水氯化钙,氢气的转化率将
③1000℃,某时刻CO2、H2、CO、H2O的物质的量分别为0.2mol、0.8mol、0.4mol、0.4mol,此时V正
(5)在3种不同条件下,分别向容积为2 L的恒容密闭容器中充入2 mol A和1 mol B,发生反应:2A(g)+B(g)
 2D(g) ΔH=Q kJ·mol-1。相关条件和数据见下表。回答:
2D(g) ΔH=Q kJ·mol-1。相关条件和数据见下表。回答:| 实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 700 | 700 | 750 |
| 达平衡时间/min | 40 | 5 | 30 |
| n(D)平衡/mol | 1.5 | 1.5 | 1 |
| 化学平衡常数 | K1 | K2 | K3 |
②实验Ⅱ改变的条件可能是:
③分别达平衡后,实验Ⅰ与实验Ⅲ容器内的压强大小关系是:Ⅰ
④实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,平衡将
您最近一年使用:0次



