I.化学反应原理对化学反应的研究具有指导意义。
(1) 还原
还原 的反应机理及相对能量如图所示(
的反应机理及相对能量如图所示( 表示过渡态):
表示过渡态):
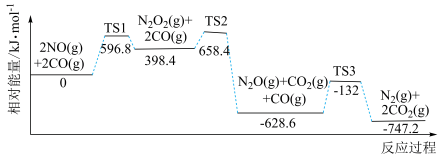
反应过程中速率最慢步骤的热化学方程式为_______ 。
(2)我国在2004年起已利用焦炉煤气制取甲醇及二甲醚。已知 中的C与O之间为三键连接,且合成甲醇的主要反应原理为
中的C与O之间为三键连接,且合成甲醇的主要反应原理为 。下表所列为常见化学键的键能数据:
。下表所列为常见化学键的键能数据:
则该反应的
_______  。
。
(3)甲醚( )是重要的化工原料,可用
)是重要的化工原料,可用 和
和 制得,总反应的热化学方程式如为
制得,总反应的热化学方程式如为
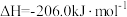 。该过程可分为以下两步反应完成:
。该过程可分为以下两步反应完成:
i.甲醇合成反应:
ii.甲醇脱水反应: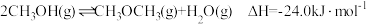
起始时向容器中投入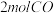 和
和 ,测得某时刻上述总反应中放出的热量为
,测得某时刻上述总反应中放出的热量为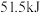 ,此时
,此时 的转化率为
的转化率为_______ 。
Ⅱ.我国力争于2030年前做到碳达峰,2060年前实现碳中和。
利用反应: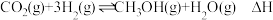 ,可减少
,可减少 排放,并合成清洁能源。
排放,并合成清洁能源。
(4)该反应一般认为通过如下步骤来实现:
①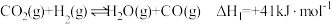
②
总反应的
_______  。;若反应①为慢反应,下列示意图中(图中物质都为气态)能体现上述反应能量变化的是
。;若反应①为慢反应,下列示意图中(图中物质都为气态)能体现上述反应能量变化的是_______ (填序号)。
A.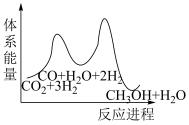 B.
B.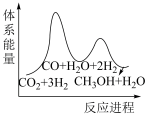 C.
C.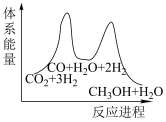 D.
D.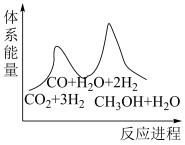
(5)在体积为 的密闭容器中,充入
的密闭容器中,充入 和
和 ,一定条件下发生反应:
,一定条件下发生反应: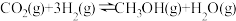 ,测得
,测得 和
和 的浓度随时间变化如图所示:
的浓度随时间变化如图所示:
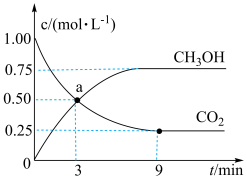
从 到
到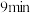 ,
,
_______ (结果保留两位有效数字);a点时v(正)_______ v(逆)(填“>”“<”或“=”,下同);第9分钟时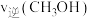
_______ 第3分钟时 。
。
(6)通过 传感器可监测
传感器可监测 的含量,其工作原理示意图如图所示:
的含量,其工作原理示意图如图所示:
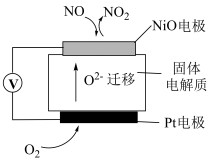
① 电极上发生的是
电极上发生的是_______ 反应(填“氧化”或“还原”)。
②写出 电极的电极反应式:
电极的电极反应式:_______ 。
(1)
 还原
还原 的反应机理及相对能量如图所示(
的反应机理及相对能量如图所示( 表示过渡态):
表示过渡态):
反应过程中速率最慢步骤的热化学方程式为
(2)我国在2004年起已利用焦炉煤气制取甲醇及二甲醚。已知
 中的C与O之间为三键连接,且合成甲醇的主要反应原理为
中的C与O之间为三键连接,且合成甲醇的主要反应原理为 。下表所列为常见化学键的键能数据:
。下表所列为常见化学键的键能数据:| 化学键 | 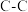 |  |  | 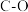 |  |  |
键能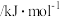 | 348 | 414 | 436 | 326.8 | 1032 | 464 |

 。
。(3)甲醚(
 )是重要的化工原料,可用
)是重要的化工原料,可用 和
和 制得,总反应的热化学方程式如为
制得,总反应的热化学方程式如为
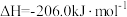 。该过程可分为以下两步反应完成:
。该过程可分为以下两步反应完成:i.甲醇合成反应:
ii.甲醇脱水反应:
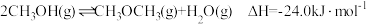
起始时向容器中投入
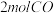 和
和 ,测得某时刻上述总反应中放出的热量为
,测得某时刻上述总反应中放出的热量为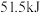 ,此时
,此时 的转化率为
的转化率为Ⅱ.我国力争于2030年前做到碳达峰,2060年前实现碳中和。
利用反应:
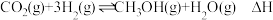 ,可减少
,可减少 排放,并合成清洁能源。
排放,并合成清洁能源。(4)该反应一般认为通过如下步骤来实现:
①
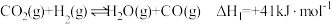
②

总反应的

 。;若反应①为慢反应,下列示意图中(图中物质都为气态)能体现上述反应能量变化的是
。;若反应①为慢反应,下列示意图中(图中物质都为气态)能体现上述反应能量变化的是A.
 B.
B. C.
C. D.
D.
(5)在体积为
 的密闭容器中,充入
的密闭容器中,充入 和
和 ,一定条件下发生反应:
,一定条件下发生反应: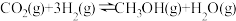 ,测得
,测得 和
和 的浓度随时间变化如图所示:
的浓度随时间变化如图所示:
从
 到
到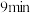 ,
,
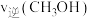
 。
。(6)通过
 传感器可监测
传感器可监测 的含量,其工作原理示意图如图所示:
的含量,其工作原理示意图如图所示:
①
 电极上发生的是
电极上发生的是②写出
 电极的电极反应式:
电极的电极反应式:
更新时间:2023-10-02 16:56:38
|
相似题推荐
【推荐1】甲醛常温下为气态,易液化,极易溶于水,是一种重要的化工原料。生产甲醛的原料是甲醇或甲烷。
(1)已知:i.CH3OH(g) HCHO(g)+H2(g)ΔH=+85.7kJ/mol;
HCHO(g)+H2(g)ΔH=+85.7kJ/mol;
ii.H2(g)+ O2(g)=H2O(g)ΔH=-241.83kJ/mol。
O2(g)=H2O(g)ΔH=-241.83kJ/mol。
则CH3OH(g)+ O2(g)
O2(g) HCHO(g)+H2O(g)ΔH=
HCHO(g)+H2O(g)ΔH=_______ kJ/mol。
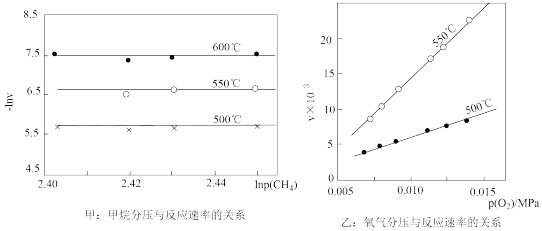
(2)甲烷氧化制备甲醛的反应为CH4(g)+O2(g) HCHO(g)+H2O(g)ΔH<0,该反应的速率方程可表示为:v=kpm(CH4)pn(O2),一定条件下测得甲烷和氧气分压对反应速率的影响如图甲、乙所示,则m=
HCHO(g)+H2O(g)ΔH<0,该反应的速率方程可表示为:v=kpm(CH4)pn(O2),一定条件下测得甲烷和氧气分压对反应速率的影响如图甲、乙所示,则m=_______ ,n=_______ 。
(3)甲烷氧化制备甲醛的副产物主要有CO、CO2,反应过程包含6部反应,如下图所示。
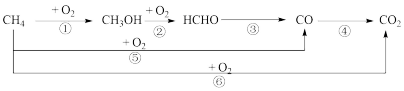
反应过程中并未检测到甲醇的存在,说明决定主反应速率的关键步骤是第_______ 步。
(4)在一定容积的密闭容器中加入某催化剂,按物质的量之比1:1投入甲烷和氧气,分别于不同温度下反应相同时间,测得甲醛、CO的选择性及甲烷的转化率随温度的变化情况如下图所示。
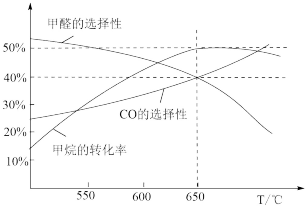
①低于650℃时,随着温度的升高,甲烷的转化率增大的原因是_______ 。
②假定650℃时恰好为平衡状态,容器内总压强为pkpa,容器内含碳微粒只有CH4、CO、CO2、HCHO,则该温度下甲醛的平衡产率为_______ ;CH4(g)+O2(g)=HCHO(g)+H2O(g)的平衡常数Kp=_______ (用平衡分压表示)。
③提出一条能提高甲醛产率的措施:_______ 。
(1)已知:i.CH3OH(g)
 HCHO(g)+H2(g)ΔH=+85.7kJ/mol;
HCHO(g)+H2(g)ΔH=+85.7kJ/mol;ii.H2(g)+
 O2(g)=H2O(g)ΔH=-241.83kJ/mol。
O2(g)=H2O(g)ΔH=-241.83kJ/mol。则CH3OH(g)+
 O2(g)
O2(g) HCHO(g)+H2O(g)ΔH=
HCHO(g)+H2O(g)ΔH=(2)甲烷氧化制备甲醛的反应为CH4(g)+O2(g)
 HCHO(g)+H2O(g)ΔH<0,该反应的速率方程可表示为:v=kpm(CH4)pn(O2),一定条件下测得甲烷和氧气分压对反应速率的影响如图甲、乙所示,则m=
HCHO(g)+H2O(g)ΔH<0,该反应的速率方程可表示为:v=kpm(CH4)pn(O2),一定条件下测得甲烷和氧气分压对反应速率的影响如图甲、乙所示,则m=
(3)甲烷氧化制备甲醛的副产物主要有CO、CO2,反应过程包含6部反应,如下图所示。

反应过程中并未检测到甲醇的存在,说明决定主反应速率的关键步骤是第
(4)在一定容积的密闭容器中加入某催化剂,按物质的量之比1:1投入甲烷和氧气,分别于不同温度下反应相同时间,测得甲醛、CO的选择性及甲烷的转化率随温度的变化情况如下图所示。

①低于650℃时,随着温度的升高,甲烷的转化率增大的原因是
②假定650℃时恰好为平衡状态,容器内总压强为pkpa,容器内含碳微粒只有CH4、CO、CO2、HCHO,则该温度下甲醛的平衡产率为
③提出一条能提高甲醛产率的措施:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】根据《中华人民共和国环境保护法》,国家制订了地区的“废气排放标准”,以减轻大气污染保护人民健康。特别是对石化企业、酸碱盐化工业、钢铁工业会排放硫化氢、二氧化硫等大气污染物进行了限制。同时回收利用硫化氢、二氧化硫也是环境保护的重要举措。
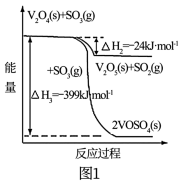
(1)接触法制硫酸生产中的关键工序是 的催化氧化:
的催化氧化: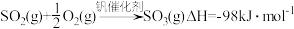 。钒催化剂参与反应的能量变化如图1所示,
。钒催化剂参与反应的能量变化如图1所示,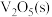 与
与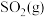 反应生成
反应生成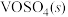 和
和 的热化学方程式为:
的热化学方程式为:___________ 。
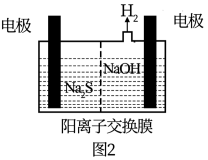
(2) 的废气可用烧碱溶液吸收,将烧碱吸收
的废气可用烧碱溶液吸收,将烧碱吸收 后的溶液加入到如图2所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
后的溶液加入到如图2所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应: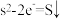 。写出电解时阴极的电极反应式:
。写出电解时阴极的电极反应式:___________ 。
(3)已知 与
与 在高温下发生反应:
在高温下发生反应: 。在温度为
。在温度为 时,将
时,将 与
与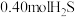 充入
充入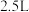 的空钢瓶中,经过
的空钢瓶中,经过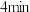 反应达到平衡,平衡时
反应达到平衡,平衡时 的物质的量分数为2%,则下列说法不正确的是
的物质的量分数为2%,则下列说法不正确的是( )
A. 内用
内用 表示该反应的速率为
表示该反应的速率为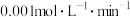
B. 的平衡转化率
的平衡转化率
C.上述条件下反应达到平衡时放出的热量为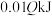
D.其他条件不变,若该反应在温度为 条件下进行,达到平衡所需时间小于
条件下进行,达到平衡所需时间小于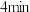 ,则
,则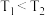
(4)常温下,向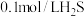 溶液中通入
溶液中通入 或加入
或加入 固体,如图3所示,测得
固体,如图3所示,测得 与溶液
与溶液 的关系图(忽略溶液体积的变化及
的关系图(忽略溶液体积的变化及 的挥发)。
的挥发)。
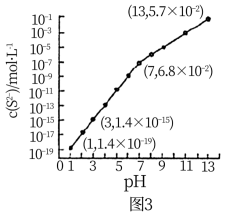
①当溶液中 时,溶液中水电离产生的
时,溶液中水电离产生的
___________ 。
②当 时,溶液中的
时,溶液中的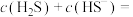
___________ 。
③常温下浓度为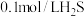 溶液,其电离方程式为
溶液,其电离方程式为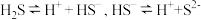 ,若要使溶液中的
,若要使溶液中的 值增大同时使
值增大同时使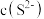 减小,可采取的措施是
减小,可采取的措施是___________ 。
A.加入适量水 B.加入适量 固体
固体
C.通入适量的 D.加入适量的
D.加入适量的
(5)通过下列反应可从烟气中回收硫。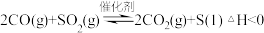 ,在模拟回收硫的实验中,向某恒容密闭容器通入
,在模拟回收硫的实验中,向某恒容密闭容器通入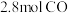 和
和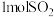 ,反应在不同条件下进行,反应体系总压强随时间的变化如图4所示:
,反应在不同条件下进行,反应体系总压强随时间的变化如图4所示:
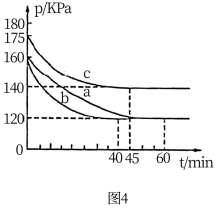
①与实验a相比,实验c改变的实验条件可能是___________ 。
②实验b中的平衡转化率
___________ 。
(1)接触法制硫酸生产中的关键工序是
 的催化氧化:
的催化氧化: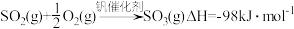 。钒催化剂参与反应的能量变化如图1所示,
。钒催化剂参与反应的能量变化如图1所示,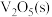 与
与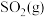 反应生成
反应生成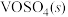 和
和 的热化学方程式为:
的热化学方程式为:

(2)
 的废气可用烧碱溶液吸收,将烧碱吸收
的废气可用烧碱溶液吸收,将烧碱吸收 后的溶液加入到如图2所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
后的溶液加入到如图2所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应: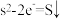 。写出电解时阴极的电极反应式:
。写出电解时阴极的电极反应式:(3)已知
 与
与 在高温下发生反应:
在高温下发生反应: 。在温度为
。在温度为 时,将
时,将 与
与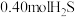 充入
充入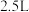 的空钢瓶中,经过
的空钢瓶中,经过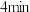 反应达到平衡,平衡时
反应达到平衡,平衡时 的物质的量分数为2%,则下列说法不正确的是
的物质的量分数为2%,则下列说法不正确的是A.
 内用
内用 表示该反应的速率为
表示该反应的速率为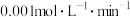
B.
 的平衡转化率
的平衡转化率
C.上述条件下反应达到平衡时放出的热量为
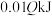
D.其他条件不变,若该反应在温度为
 条件下进行,达到平衡所需时间小于
条件下进行,达到平衡所需时间小于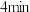 ,则
,则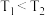
(4)常温下,向
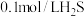 溶液中通入
溶液中通入 或加入
或加入 固体,如图3所示,测得
固体,如图3所示,测得 与溶液
与溶液 的关系图(忽略溶液体积的变化及
的关系图(忽略溶液体积的变化及 的挥发)。
的挥发)。
①当溶液中
 时,溶液中水电离产生的
时,溶液中水电离产生的
②当
 时,溶液中的
时,溶液中的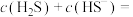
③常温下浓度为
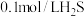 溶液,其电离方程式为
溶液,其电离方程式为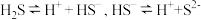 ,若要使溶液中的
,若要使溶液中的 值增大同时使
值增大同时使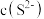 减小,可采取的措施是
减小,可采取的措施是A.加入适量水 B.加入适量
 固体
固体C.通入适量的
 D.加入适量的
D.加入适量的
(5)通过下列反应可从烟气中回收硫。
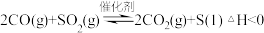 ,在模拟回收硫的实验中,向某恒容密闭容器通入
,在模拟回收硫的实验中,向某恒容密闭容器通入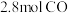 和
和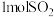 ,反应在不同条件下进行,反应体系总压强随时间的变化如图4所示:
,反应在不同条件下进行,反应体系总压强随时间的变化如图4所示:
①与实验a相比,实验c改变的实验条件可能是
②实验b中的平衡转化率

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】甲烷是天然气的主要成分,是一种重要的清洁能源和化工原料。
(1)用煤制天然气时会发生多个反应,通过多种途径生成CH4。
已知:C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g) C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
CO(g)+3H2(g) CH4(g)+H2O (g) ΔH=-203 kJ·mol-1
CH4(g)+H2O (g) ΔH=-203 kJ·mol-1
写出CO与H2O (g)反应生成H2和CO2的热化学方程式____________________________________ 。
(2)天然气中含有H2S杂质,某科研小组用氨水吸收得到NH4HS溶液,已知T℃k(NH3•H2O)=1.74×10-5,k1(H2S)=1.07×10-7,k2(H2S)=1.74×10-13,NH4HS溶液中所含粒子浓度大小关系正确的是______________ 。
a.c(NH4+)>c(HS-)>c(OH-)>c(H+) b. c(HS-)>c(NH4+)>c(S2-)>c(H+)
c.c(NH4+)>c(HS-)>c(H2S)>c(H+) d.c(HS-)>c(S2-)>c(H+)>c(OH-)
(3)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为:CH4(g)+H2O(g) CO(g)+3H2(g)。
CO(g)+3H2(g)。
①一定温度时,在一个体积为2L的恒容密闭容器中,加入1molCH4和1.4mol水蒸气发生上述反应,5min后达平衡,生成0.2molCO,用H2表示该反应的速率为_______________ ,此反应的平衡常数为__________________ (结果保留到小数点后三位)
②下列说法中能说明此反应达到平衡状态的是____________ 。
A.体系的压强不再发生变化 B.生成1mol CH4的同时消耗3mol H2
C.各组分的物质的量浓度不再改变 D.体系的密度不再发生变化
E.反应速率V(CH4) :V(H2O) :v(CO) :v(H2)= 1:1:1:3
(4)甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g) CO2(g) +3H2(g) ΔH = +49kJ·mol-1
CO2(g) +3H2(g) ΔH = +49kJ·mol-1
①分析适当增大水醇比[n(H2O) ∶n (CH3OH)]对甲醇水蒸气重整制氢的好处____________ 。
②某温度下,将[n(H2O) ∶n (CH3OH)]=l∶1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为______________________ 。
(1)用煤制天然气时会发生多个反应,通过多种途径生成CH4。
已知:C(s)+2H2(g)
 CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-12CO(g)
 C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1CO(g)+3H2(g)
 CH4(g)+H2O (g) ΔH=-203 kJ·mol-1
CH4(g)+H2O (g) ΔH=-203 kJ·mol-1写出CO与H2O (g)反应生成H2和CO2的热化学方程式
(2)天然气中含有H2S杂质,某科研小组用氨水吸收得到NH4HS溶液,已知T℃k(NH3•H2O)=1.74×10-5,k1(H2S)=1.07×10-7,k2(H2S)=1.74×10-13,NH4HS溶液中所含粒子浓度大小关系正确的是
a.c(NH4+)>c(HS-)>c(OH-)>c(H+) b. c(HS-)>c(NH4+)>c(S2-)>c(H+)
c.c(NH4+)>c(HS-)>c(H2S)>c(H+) d.c(HS-)>c(S2-)>c(H+)>c(OH-)
(3)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为:CH4(g)+H2O(g)
 CO(g)+3H2(g)。
CO(g)+3H2(g)。①一定温度时,在一个体积为2L的恒容密闭容器中,加入1molCH4和1.4mol水蒸气发生上述反应,5min后达平衡,生成0.2molCO,用H2表示该反应的速率为
②下列说法中能说明此反应达到平衡状态的是
A.体系的压强不再发生变化 B.生成1mol CH4的同时消耗3mol H2
C.各组分的物质的量浓度不再改变 D.体系的密度不再发生变化
E.反应速率V(CH4) :V(H2O) :v(CO) :v(H2)= 1:1:1:3
(4)甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)
 CO2(g) +3H2(g) ΔH = +49kJ·mol-1
CO2(g) +3H2(g) ΔH = +49kJ·mol-1①分析适当增大水醇比[n(H2O) ∶n (CH3OH)]对甲醇水蒸气重整制氢的好处
②某温度下,将[n(H2O) ∶n (CH3OH)]=l∶1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为
您最近一年使用:0次
【推荐1】 和
和 是重要的化工原料,其综合利用具有重要意义。
是重要的化工原料,其综合利用具有重要意义。
(1) 与
与 经催化重整,制得合成气:
经催化重整,制得合成气:
①已知上述反应中相关的化学键键能数据如下:
则该反应的
___________ 。
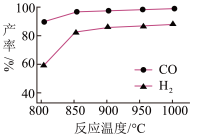
②按一定体积比加入 和
和 ,在恒压下发生反应,温度对CO和
,在恒压下发生反应,温度对CO和 产率的影响如图所示。此反应优选温度为900℃的原因是
产率的影响如图所示。此反应优选温度为900℃的原因是___________ 。
(2)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应:
I.
Ⅱ.
①某温度下,体积为1L的密闭容器中,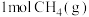 和
和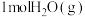 反应达平衡时,
反应达平衡时, 的转化率为
的转化率为 ,
, 的物质的量为
的物质的量为 ,则反应I的平衡常数
,则反应I的平衡常数
___________ 。(写出含有 、b的计算式)
、b的计算式)
②在允许 自由迁移的固体电解质燃料电池中,
自由迁移的固体电解质燃料电池中,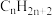 放电的电极反应式为
放电的电极反应式为___________ 。
(3)电催化还原法是 的有机资源化的研究热点。控制其他条件相同,将一定量的
的有机资源化的研究热点。控制其他条件相同,将一定量的 通入盛有酸性溶液的电催化装置中,
通入盛有酸性溶液的电催化装置中, 可转化为有机物。阴极所得产物及其物质的量与电压的关系如图所示。
可转化为有机物。阴极所得产物及其物质的量与电压的关系如图所示。

①电解电压为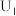 时,电解时转移电子的物质的量为
时,电解时转移电子的物质的量为___________ 。
②电解电压为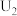 时,阴极由
时,阴极由 生成甲醇的电极反应式为
生成甲醇的电极反应式为___________ 。
③在实际生产中发现当 过低时,有机物产率降低,可能的原因是
过低时,有机物产率降低,可能的原因是___________ 。
 和
和 是重要的化工原料,其综合利用具有重要意义。
是重要的化工原料,其综合利用具有重要意义。(1)
 与
与 经催化重整,制得合成气:
经催化重整,制得合成气:
①已知上述反应中相关的化学键键能数据如下:
| 化学键 |  |  |  | 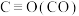 |
键能/ | 413 | 745 | 436 | 1075 |

②按一定体积比加入
 和
和 ,在恒压下发生反应,温度对CO和
,在恒压下发生反应,温度对CO和 产率的影响如图所示。此反应优选温度为900℃的原因是
产率的影响如图所示。此反应优选温度为900℃的原因是
(2)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应:
I.

Ⅱ.

①某温度下,体积为1L的密闭容器中,
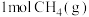 和
和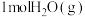 反应达平衡时,
反应达平衡时, 的转化率为
的转化率为 ,
, 的物质的量为
的物质的量为 ,则反应I的平衡常数
,则反应I的平衡常数
 、b的计算式)
、b的计算式)②在允许
 自由迁移的固体电解质燃料电池中,
自由迁移的固体电解质燃料电池中,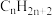 放电的电极反应式为
放电的电极反应式为(3)电催化还原法是
 的有机资源化的研究热点。控制其他条件相同,将一定量的
的有机资源化的研究热点。控制其他条件相同,将一定量的 通入盛有酸性溶液的电催化装置中,
通入盛有酸性溶液的电催化装置中, 可转化为有机物。阴极所得产物及其物质的量与电压的关系如图所示。
可转化为有机物。阴极所得产物及其物质的量与电压的关系如图所示。
①电解电压为
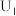 时,电解时转移电子的物质的量为
时,电解时转移电子的物质的量为②电解电压为
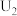 时,阴极由
时,阴极由 生成甲醇的电极反应式为
生成甲醇的电极反应式为③在实际生产中发现当
 过低时,有机物产率降低,可能的原因是
过低时,有机物产率降低,可能的原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】 催化加氢制备甲醇可以减少
催化加氢制备甲醇可以减少 的排放,有利于实现碳中和。在一定条件下,
的排放,有利于实现碳中和。在一定条件下, 和H₂可发生如下反应:
和H₂可发生如下反应:
Ⅰ.

Ⅱ.

Ⅲ.
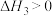
回答下列问题:
(1)已知部分化学键键能如下表:
依据表中信息, =
=___________  。
。
(2)反应Ⅰ的速率常数k与反应温度T的关系遵循Arrhenius方程,实验数据如图所示。

已知Arrhenius方程为 (其中k为速率常数,Ea为活化能,R、A均为常数)。
(其中k为速率常数,Ea为活化能,R、A均为常数)。
①反应Ⅰ的活化能Ea=___________  (保留整数)。
(保留整数)。
②下列措施能使速率常数k增大的是___________ (填序号)。
A.增大压强 B.升高温度 C.增大 的浓度 D.更换适宜催化剂
的浓度 D.更换适宜催化剂
(3)不同压强下, 的平衡转化率
的平衡转化率 随温度的变化如图所示。
随温度的变化如图所示。

0.5MPa条件下, 的平衡转化率随温度升高先减小后增大的原因是
的平衡转化率随温度升高先减小后增大的原因是___________ 。
(4)一定条件下,向体积为1L的恒容密闭容器中通入1.0mol 和3.0mol
和3.0mol ,发生反应I、Ⅱ、Ⅲ,达到平衡时,容器中
,发生反应I、Ⅱ、Ⅲ,达到平衡时,容器中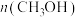 为0.15mol,
为0.15mol,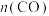 为0.07mol,
为0.07mol,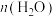 为0.22mol,则
为0.22mol,则 的平衡转化率为
的平衡转化率为___________ ,反应I的平衡常数为___________  (用代数式表示,无需化简)。
(用代数式表示,无需化简)。
(5)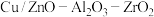 可用于
可用于 催化加氢制备甲醇。立方
催化加氢制备甲醇。立方 晶胞中,
晶胞中, 处于晶胞的顶点和面心,晶胞参数a=515pm,该晶体的密度为
处于晶胞的顶点和面心,晶胞参数a=515pm,该晶体的密度为___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 催化加氢制备甲醇可以减少
催化加氢制备甲醇可以减少 的排放,有利于实现碳中和。在一定条件下,
的排放,有利于实现碳中和。在一定条件下, 和H₂可发生如下反应:
和H₂可发生如下反应:Ⅰ.


Ⅱ.


Ⅲ.

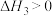
回答下列问题:
(1)已知部分化学键键能如下表:
| 化学键 |  |  |  |  |  |
| 键能(kJ/mol) | a | b | c | d | e |
 =
= 。
。(2)反应Ⅰ的速率常数k与反应温度T的关系遵循Arrhenius方程,实验数据如图所示。

已知Arrhenius方程为
 (其中k为速率常数,Ea为活化能,R、A均为常数)。
(其中k为速率常数,Ea为活化能,R、A均为常数)。①反应Ⅰ的活化能Ea=
 (保留整数)。
(保留整数)。②下列措施能使速率常数k增大的是
A.增大压强 B.升高温度 C.增大
 的浓度 D.更换适宜催化剂
的浓度 D.更换适宜催化剂(3)不同压强下,
 的平衡转化率
的平衡转化率 随温度的变化如图所示。
随温度的变化如图所示。
0.5MPa条件下,
 的平衡转化率随温度升高先减小后增大的原因是
的平衡转化率随温度升高先减小后增大的原因是(4)一定条件下,向体积为1L的恒容密闭容器中通入1.0mol
 和3.0mol
和3.0mol ,发生反应I、Ⅱ、Ⅲ,达到平衡时,容器中
,发生反应I、Ⅱ、Ⅲ,达到平衡时,容器中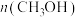 为0.15mol,
为0.15mol,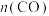 为0.07mol,
为0.07mol,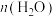 为0.22mol,则
为0.22mol,则 的平衡转化率为
的平衡转化率为 (用代数式表示,无需化简)。
(用代数式表示,无需化简)。(5)
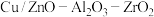 可用于
可用于 催化加氢制备甲醇。立方
催化加氢制备甲醇。立方 晶胞中,
晶胞中, 处于晶胞的顶点和面心,晶胞参数a=515pm,该晶体的密度为
处于晶胞的顶点和面心,晶胞参数a=515pm,该晶体的密度为 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】CS2是一种常见溶剂,还可用于生产人造粘胶纤维等。回答下列问题:
(1)CS2与酸性KMnO4溶液反应,产物为CO2和硫酸盐,该反应中还原剂与氧化剂的物质的量之比为_______ (MnO4-被还原为Mn2+)
(2)甲烷硫磺法制取CS2的反应为CH4(g)+2S2(g) CS2(g)+2H2S(g) △H。
CS2(g)+2H2S(g) △H。
① 在恒温恒容密闭容器中进行该反应时,能说明该反应已达到平衡状态的是_______ (填字母)
A.v正(S2)=2v逆(CS2)
B.容器内气体的密度不再随时间变化
C.容器内气体的总压强不再随时间变化
D.单位时间内断裂C-H键数目与断裂H—S键数目相等
②已知下列键能数据:
该反应的△H_______ kJ•mol-1
(3)在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S):n(CH4)=2:1,发生反应:CH4(g) +2H2S(g)⇌CS2(g) + 4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
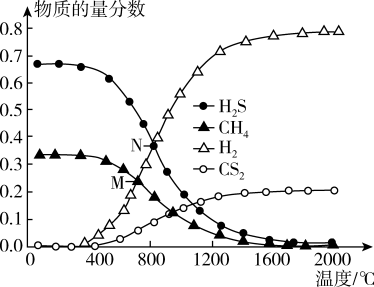
①该反应△H_______ (填“>”或“<”)0。
②M点,H2S的平衡转化率为_______ ,为提高H2S的平衡转化率,除改变温度外,还可采取的措施是_______ (列举一条)。
③N点,平衡分压p(CS2)=_______ MPa,对应温度下,该反应的KP =_______ (MPa)2。(KP为以分压表示的平衡常数)
(1)CS2与酸性KMnO4溶液反应,产物为CO2和硫酸盐,该反应中还原剂与氧化剂的物质的量之比为
(2)甲烷硫磺法制取CS2的反应为CH4(g)+2S2(g)
 CS2(g)+2H2S(g) △H。
CS2(g)+2H2S(g) △H。① 在恒温恒容密闭容器中进行该反应时,能说明该反应已达到平衡状态的是
A.v正(S2)=2v逆(CS2)
B.容器内气体的密度不再随时间变化
C.容器内气体的总压强不再随时间变化
D.单位时间内断裂C-H键数目与断裂H—S键数目相等
②已知下列键能数据:
| 共价键 | C—H | S=S | C=S | H—S |
| 律能/kJ∙mol-1 | 411 | 425 | 573 | 363 |
该反应的△H
(3)在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S):n(CH4)=2:1,发生反应:CH4(g) +2H2S(g)⇌CS2(g) + 4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:

①该反应△H
②M点,H2S的平衡转化率为
③N点,平衡分压p(CS2)=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】将 和
和 重整转化为合成气一直是减少温室气体排放的研究方向之一,涉及如下反应:
重整转化为合成气一直是减少温室气体排放的研究方向之一,涉及如下反应:
主反应:

副反应: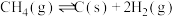
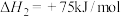
回答下列问题:
(1)已知: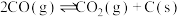
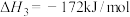 ,则
,则
_______  。
。
(2)恒温恒容密闭容器中仅发生主反应,能说明反应达到平衡状态的是_______(填标号)。
(3)在体积为 恒容密闭容器中充入
恒容密闭容器中充入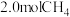 和
和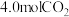 ,
, 下仅发生主反应,
下仅发生主反应, 、
、 的物质的量随时间变化如下表所示:
的物质的量随时间变化如下表所示:
① 在
在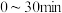 内的平均反应速率
内的平均反应速率
_______ 。
②若在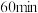 时再充入
时再充入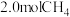 ,达到新平衡后
,达到新平衡后 的转化率
的转化率_______ (填“增大”、“减小”或“不变”,下同),此时平衡常数
_______ 。
③若相同条件下改为充入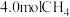 和
和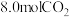 反应,平衡后
反应,平衡后 的转化率
的转化率_______  (填“<”、“=”或“>”)。
(填“<”、“=”或“>”)。
(4) 催化加
催化加 可以制备
可以制备 ,保持反应气中
,保持反应气中 与
与 的体积比为
的体积比为 ,以
,以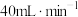 的流速通过催化剂,甲烷化过程中,含碳产物
的流速通过催化剂,甲烷化过程中,含碳产物 的物质的量百分数
的物质的量百分数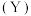 及
及 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。 时
时 反应速率为
反应速率为_______  。
。

 和
和 重整转化为合成气一直是减少温室气体排放的研究方向之一,涉及如下反应:
重整转化为合成气一直是减少温室气体排放的研究方向之一,涉及如下反应:主反应:


副反应:
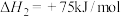
回答下列问题:
(1)已知:
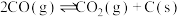
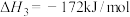 ,则
,则
 。
。(2)恒温恒容密闭容器中仅发生主反应,能说明反应达到平衡状态的是_______(填标号)。
| A.容器内的压强不变 |
B. |
| C.混合气体的密度不再变化 |
D.断开 键同时断开 键同时断开 键 键 |
(3)在体积为
 恒容密闭容器中充入
恒容密闭容器中充入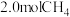 和
和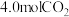 ,
, 下仅发生主反应,
下仅发生主反应, 、
、 的物质的量随时间变化如下表所示:
的物质的量随时间变化如下表所示:时间/min 反应物 | 0 | 15 | 30 | 45 | 60 | 75 |
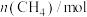 | 2.0 | 1.3 | 0.8 | 0.4 | 0.2 | 0.2 |
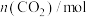 | 4.0 | 3.3 | 2.8 | 2.4 | 2.2 | 2.2 |
 在
在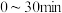 内的平均反应速率
内的平均反应速率
②若在
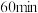 时再充入
时再充入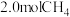 ,达到新平衡后
,达到新平衡后 的转化率
的转化率
③若相同条件下改为充入
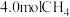 和
和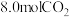 反应,平衡后
反应,平衡后 的转化率
的转化率 (填“<”、“=”或“>”)。
(填“<”、“=”或“>”)。(4)
 催化加
催化加 可以制备
可以制备 ,保持反应气中
,保持反应气中 与
与 的体积比为
的体积比为 ,以
,以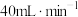 的流速通过催化剂,甲烷化过程中,含碳产物
的流速通过催化剂,甲烷化过程中,含碳产物 的物质的量百分数
的物质的量百分数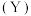 及
及 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。 时
时 反应速率为
反应速率为 。
。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】化学兴趣小组同学用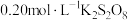 、
、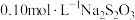 、
、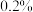 淀粉溶液、
淀粉溶液、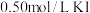 等试剂探究影响化学反应速率的因素。
等试剂探究影响化学反应速率的因素。
已知: (慢)
(慢)
 (快)
(快)
(1)向 、
、 与淀粉的混合溶液中加入一定量的
与淀粉的混合溶液中加入一定量的 溶液,当溶液中的
溶液,当溶液中的___________ (填化学式)耗尽后,溶液颜色将由无色变为蓝色。为确保能观察到蓝色, 与
与 物质的量需满足的关系为
物质的量需满足的关系为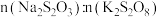
___________ (填“ ”、“
”、“ ”或“
”或“ ”)
”) 。出现蓝色之前,
。出现蓝色之前, 在反应中起到的作用是
在反应中起到的作用是___________ 。
(2)为探究反应物浓度对化学反应速率的影响,设计如下实验方案:
①表中 、
、 和
和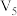 均取
均取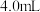 ,目的是
,目的是___________ 。
②表中的
___________ ,理由是___________ 。
③若实验①中观察到溶液变蓝的时间为 ,则用
,则用 的浓度变化表示的平均反应速率
的浓度变化表示的平均反应速率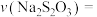
___________ 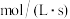 。
。
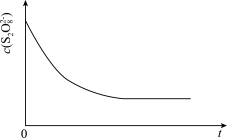
(3)已知某条件下, 随反应时间(t)的变化曲线如图,若保持其它条件不变,分别画出降低反应温度和加入催化剂时
随反应时间(t)的变化曲线如图,若保持其它条件不变,分别画出降低反应温度和加入催化剂时 随反应时间(t)的变化曲线示意图(进行相应的标注)。
随反应时间(t)的变化曲线示意图(进行相应的标注)。________
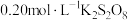 、
、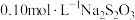 、
、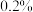 淀粉溶液、
淀粉溶液、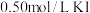 等试剂探究影响化学反应速率的因素。
等试剂探究影响化学反应速率的因素。已知:
 (慢)
(慢)  (快)
(快)(1)向
 、
、 与淀粉的混合溶液中加入一定量的
与淀粉的混合溶液中加入一定量的 溶液,当溶液中的
溶液,当溶液中的 与
与 物质的量需满足的关系为
物质的量需满足的关系为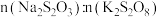
 ”、“
”、“ ”或“
”或“ ”)
”) 。出现蓝色之前,
。出现蓝色之前, 在反应中起到的作用是
在反应中起到的作用是(2)为探究反应物浓度对化学反应速率的影响,设计如下实验方案:
| 实验序号 | 溶液体积 | ||||
 溶液 溶液 |  |  溶液 溶液 |  溶液 溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 |  |  | 4.0 | 2.0 |
| ③ | 8.0 |  |  | 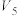 | 2.0 |
 、
、 和
和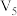 均取
均取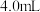 ,目的是
,目的是②表中的

③若实验①中观察到溶液变蓝的时间为
 ,则用
,则用 的浓度变化表示的平均反应速率
的浓度变化表示的平均反应速率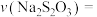
 。
。(3)已知某条件下,
 随反应时间(t)的变化曲线如图,若保持其它条件不变,分别画出降低反应温度和加入催化剂时
随反应时间(t)的变化曲线如图,若保持其它条件不变,分别画出降低反应温度和加入催化剂时 随反应时间(t)的变化曲线示意图(进行相应的标注)。
随反应时间(t)的变化曲线示意图(进行相应的标注)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和H2O。已知CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,CH4和SO2反应的热化学方程式为________________ 。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:

①分析可知X为____________ (写化学式),0~t1时间段的温度为_________________ ,0~t1时间段用SO2 表示的化学反应速率为________________________________ 。
②总反应的化学方程式为_______________________________ 。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g) S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
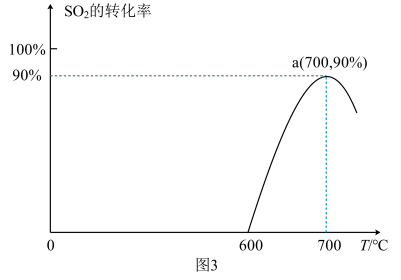
①该反应的ΔH_______________ 0 (填“>”或“<”)。
②计算a点的平衡常数为_______________________ 。
(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为__________________________ ,25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为__________________ 。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和H2O。已知CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,CH4和SO2反应的热化学方程式为
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:

①分析可知X为
②总反应的化学方程式为
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)
 S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
①该反应的ΔH
②计算a点的平衡常数为
(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】以分子中含有一个碳原子的物质为原料的化学工业称为“碳一化工”,甲醇是碳一化工的支柱。回答下列问题:
(1)以甲醇生产甲胺的化学方程式为 CH3OH(l)+NH3(g)═CH3NH2(g)+H2O(g), 该反应在高温下才能自发进行,则该反应的ΔH_______ 0(填“>”“<”或“=”)。
(2)利用甲醇(CH₃OH)制备甲醛可以使人类的基础化学品摆脱对石油的依赖。目前常用的方法有以下两种。
脱氢法: CH3OH(g) HCHO(g)+H2(g) ΔH= +46.203kJ·mol-1
HCHO(g)+H2(g) ΔH= +46.203kJ·mol-1
氧化法:CH3OH(g)+ O2(g)
O2(g)  HCHO(g)+ H2O(g) ΔH= -149.73kJ·mol-1
HCHO(g)+ H2O(g) ΔH= -149.73kJ·mol-1
已知几种共价键的键能如下表:
如图为甲醇制备甲醛两种方法对应的lg K(K为浓度平衡常数)随温度(T)的变化曲线。
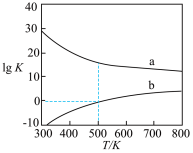
①表中n=_______ 。
②曲线_______ (填“a”或“b”)对应氧化法,其理由是_______ 。
③在一个体积为1L的恒容密闭容器中加入2 mol CH3OH,在500K时发生脱氢反应,经5min达到平衡状态,则体系压强变为原来的_______ 倍。若平衡时体系压强为3.6MPa,则平衡时压强平衡常数 Kp=_______ MPa。
(3)以CO、CH3OH 为原料生产醋酸是碳一化工的成功范例,产品中乙酸含量≥99.8%。
①根据下表数据分析,实际工业生产中采用低压羰基合成反应制备醋酸的原因是_______ 。
甲醇合成醋酸消耗定额的比较(以生产1t醋酸计)
②该羰基合成反应采用不同组分的铑系催化剂,它们的催化性能比较如下表。其中性能最优的催化剂是_______ 。
(4)一种甲醇燃料电池采用碳化钨作为电极催化剂,在稀硫酸电解液中加入纯化的甲醇,同时向另一个电极通入空气,负极的电极反应式为 _______ 。
(1)以甲醇生产甲胺的化学方程式为 CH3OH(l)+NH3(g)═CH3NH2(g)+H2O(g), 该反应在高温下才能自发进行,则该反应的ΔH
(2)利用甲醇(CH₃OH)制备甲醛可以使人类的基础化学品摆脱对石油的依赖。目前常用的方法有以下两种。
脱氢法: CH3OH(g)
 HCHO(g)+H2(g) ΔH= +46.203kJ·mol-1
HCHO(g)+H2(g) ΔH= +46.203kJ·mol-1氧化法:CH3OH(g)+
 O2(g)
O2(g)  HCHO(g)+ H2O(g) ΔH= -149.73kJ·mol-1
HCHO(g)+ H2O(g) ΔH= -149.73kJ·mol-1已知几种共价键的键能如下表:
| 共价键 | C-O | C-H | O-H | C═O | H—H |
| 键能/(kJ·mol-1) | 413.4 | n | 462.8. | 745 | 436 |

①表中n=
②曲线
③在一个体积为1L的恒容密闭容器中加入2 mol CH3OH,在500K时发生脱氢反应,经5min达到平衡状态,则体系压强变为原来的
(3)以CO、CH3OH 为原料生产醋酸是碳一化工的成功范例,产品中乙酸含量≥99.8%。
①根据下表数据分析,实际工业生产中采用低压羰基合成反应制备醋酸的原因是
甲醇合成醋酸消耗定额的比较(以生产1t醋酸计)
| 名称 | 高压羰基合成 | 低压羰基合成 |
| 甲醇/kg | 610 | 545 |
| 一氧化碳/m3(标准状况) | 630 | 454 |
| 电/kWh | 350 | 29 |
| 催化剂 | 铑的百分含量/% | 相对催化速率 |
| RhCl3-NaX | 0.25 | 50 |
| RhCl(CO)(PPh3)-Al2O3 | 1.39 | 40 |
| Rh(NO3)3/C | 3.00 | 25 |
| Rh/Ys | 1.00 | 900 |
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】ZnO和 在工业生产中具有广泛的应用,它们均可作为合成工业常用的催化剂。某实验小组利用废旧锌锰电池为原料回收ZnO和
在工业生产中具有广泛的应用,它们均可作为合成工业常用的催化剂。某实验小组利用废旧锌锰电池为原料回收ZnO和 ,并测定产品
,并测定产品 的纯度。其回收制备流程如下:
的纯度。其回收制备流程如下: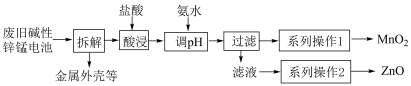
已知:碱性锌锰电池的总反应为: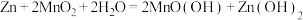 ,电解质是KOH。
,电解质是KOH。
回答下列问题:
(1)废旧电池拆解前要充分放电,放电时正极反应式为_________ 。
(2)酸浸时加快反应速率的方法有_______ (写出2种即可)。
(3)用氨水调节酸浸后溶液的pH可以使溶液中的锌锰元素分离,依据下表合理pH为______ 。
使用返滴法来测定回收产品 的纯度。取mg产品于锥形瓶中,在硫酸酸化环境下,加入ng过量草酸钠(Na2C2O4)与二氧化锰反应,最后用cmol/L酸性高锰酸钾标准液滴定未反应完的草酸钠,消耗VmL。
的纯度。取mg产品于锥形瓶中,在硫酸酸化环境下,加入ng过量草酸钠(Na2C2O4)与二氧化锰反应,最后用cmol/L酸性高锰酸钾标准液滴定未反应完的草酸钠,消耗VmL。
(4)在硫酸酸化环境下,草酸钠( )与二氧化锰反应的离子方程式为:
)与二氧化锰反应的离子方程式为:_______ 。
(5)用酸性高锰酸钾标准液滴定未反应完的草酸钠溶液,达到滴定终点的依据是___________ 。
(6)产品 的纯度为
的纯度为_______ (列出计算式,不用化简)。
(7)下列操作会导致 的纯度测定结果偏高的是________。
的纯度测定结果偏高的是________。
 在工业生产中具有广泛的应用,它们均可作为合成工业常用的催化剂。某实验小组利用废旧锌锰电池为原料回收ZnO和
在工业生产中具有广泛的应用,它们均可作为合成工业常用的催化剂。某实验小组利用废旧锌锰电池为原料回收ZnO和 ,并测定产品
,并测定产品 的纯度。其回收制备流程如下:
的纯度。其回收制备流程如下:
已知:碱性锌锰电池的总反应为:
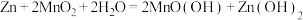 ,电解质是KOH。
,电解质是KOH。回答下列问题:
(1)废旧电池拆解前要充分放电,放电时正极反应式为
(2)酸浸时加快反应速率的方法有
(3)用氨水调节酸浸后溶液的pH可以使溶液中的锌锰元素分离,依据下表合理pH为
| pH | 沉淀中氢氧化锌的含量/% | 沉淀中氢氧化锰的含量/% | 滤液中锌的含量 | 滤液中锰的含量 |
| 3 | - | - | 8.5 | 27.6 |
| 8 | 0.1 | 98.5 | 8.5 | 0.1 |
| 9 | 0.2 | 98.6 | 8.5 | 0.1 |
| 11 | 18.2 | 78.8 | 6.5 | 4.1 |
使用返滴法来测定回收产品
 的纯度。取mg产品于锥形瓶中,在硫酸酸化环境下,加入ng过量草酸钠(Na2C2O4)与二氧化锰反应,最后用cmol/L酸性高锰酸钾标准液滴定未反应完的草酸钠,消耗VmL。
的纯度。取mg产品于锥形瓶中,在硫酸酸化环境下,加入ng过量草酸钠(Na2C2O4)与二氧化锰反应,最后用cmol/L酸性高锰酸钾标准液滴定未反应完的草酸钠,消耗VmL。(4)在硫酸酸化环境下,草酸钠(
 )与二氧化锰反应的离子方程式为:
)与二氧化锰反应的离子方程式为:(5)用酸性高锰酸钾标准液滴定未反应完的草酸钠溶液,达到滴定终点的依据是
(6)产品
 的纯度为
的纯度为(7)下列操作会导致
 的纯度测定结果偏高的是________。
的纯度测定结果偏高的是________。| A.盛装标准液的滴定管没有用标准液润洗 |
| B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出 |
| C.滴定前仰视,滴定后俯视液面 |
| D.滴定前滴定管尖嘴处有气泡,滴定后消失 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】煤炭是我国最主要能源。煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)已知该产业链中,有炭参与的某反应平衡常数表达式为:K=c(H2)∙c(CO)/c(H2O),写出它所对应反应的化学方程式(含物质状态):_______ ,若该反应只有在持续高温下才能自发进行,则该反应为_______ (“吸热”或“放热”)反应。
(2)向2 L密闭容器中加入2 mol CO2和6 mol H2,在适当的催化剂作用下发生如下反应:CO2(g)+3H2(g) ⇌CH3OH(l)+H2O(l),下列条件可以判定该反应到达平衡状态的是_______ (填字母)。
A.混合气体的平均相对分子质量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H-H键断裂
(3)在四个不同容积的恒容密闭容器中按表充入相应的气体,发生反应:2N2O(g)⇌2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图所示:
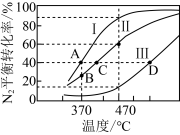
①若容器Ⅰ的体积为2 L,反应在370 ℃下进行,20 s后达到平衡,则0~20 s内容器Ⅰ中用O2表示的反应速率为_______ 。B点对应的平衡常数K=_______ (保留两位有效数字)。
②图中A、C、D三点容器内气体密度由大到小的顺序是_______ 。
③若容器Ⅳ体积为1 L,反应在370 ℃下进行,则起始时反应_______ 移动(填“向正反应方向”“向逆反应方向”或“不”)。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。若产物只有H2O和一种酸式盐,则该电池的负极反应式为_______ 。
(1)已知该产业链中,有炭参与的某反应平衡常数表达式为:K=c(H2)∙c(CO)/c(H2O),写出它所对应反应的化学方程式(含物质状态):
(2)向2 L密闭容器中加入2 mol CO2和6 mol H2,在适当的催化剂作用下发生如下反应:CO2(g)+3H2(g) ⇌CH3OH(l)+H2O(l),下列条件可以判定该反应到达平衡状态的是
A.混合气体的平均相对分子质量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H-H键断裂
(3)在四个不同容积的恒容密闭容器中按表充入相应的气体,发生反应:2N2O(g)⇌2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图所示:
| 起始物质的量/mol | N2O | N2 | O2 |
| Ⅰ | 0.1 | 0 | 0 |
| Ⅱ | 0.1 | 0 | 0 |
| Ⅲ | 0.1 | 0 | 0 |
| Ⅳ | 0.06 | 0.06 | 0.04 |

①若容器Ⅰ的体积为2 L,反应在370 ℃下进行,20 s后达到平衡,则0~20 s内容器Ⅰ中用O2表示的反应速率为
②图中A、C、D三点容器内气体密度由大到小的顺序是
③若容器Ⅳ体积为1 L,反应在370 ℃下进行,则起始时反应
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。若产物只有H2O和一种酸式盐,则该电池的负极反应式为
您最近一年使用:0次



