 可用于合成甲醇,化学方程式为
可用于合成甲醇,化学方程式为 。
。(1)在不同温度下
 的转化率随时间变化的曲线如图:
的转化率随时间变化的曲线如图: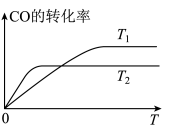
反应
 的
的

 。
。(2)在T1温度下,向容积为2L的恒容密闭容器中充入2mol
 和amol
和amol ,实验测得
,实验测得 和
和 的浓度随时间变化如图所示:
的浓度随时间变化如图所示: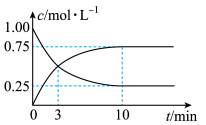
在T1温度下,0~10min内,H2(g)的平均反应速率为
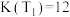 ,则a=
,则a=(3)在容积为10L的恒容密闭容器中,研究在三种不同温度(210℃、230℃和250℃)下
 合成甲醇的规律。这三种不同温度下
合成甲醇的规律。这三种不同温度下 和
和 的起始投料比与
的起始投料比与 平衡转化率的关系如图[已知:起始时
平衡转化率的关系如图[已知:起始时 的物质的量均为1mol]:
的物质的量均为1mol]: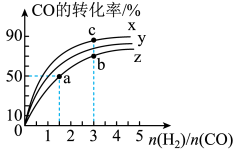
曲线x对应的温度是
相似题推荐
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),酸性K2Cr2O7溶液可将这种碳纳米颗粒氧化为无毒气体而除去,该反应的还原产物为Cr3+,请写出相应的离子方程式:
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO (g) + 2H2 (g)
 CH3OH (g) ΔH1=-116 kJ·mol-1
CH3OH (g) ΔH1=-116 kJ·mol-1 ①下列措施中可增大H2的平衡转化率的是
A.升高反应温度 B.增大体系压强
C.使用高效催化剂 D.及时将CH3OH与反应混合物分离
②向2L的恒容密闭容器中充入1mol CO和2mol H2,进行上述反应,5min后达到平衡状态,此时体系的压强变为原来的 。则此段时间v(H2)=
。则此段时间v(H2)=
③已知:
2CO (g) + O2 (g)  2CO2 (g) ΔH2=-566 kJ·mol-1
2CO2 (g) ΔH2=-566 kJ·mol-1
2H2 (g) + O2 (g)  2H2O (g) ΔH3=-484 kJ·mol-1
2H2O (g) ΔH3=-484 kJ·mol-1
则气态甲醇燃烧生成CO2和水蒸气时的热化学方程式为
④在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
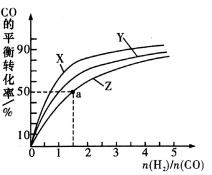
请回答:
ⅰ.在上述三种温度中,曲线Z对应的温度是
ⅱ.利用图中a点对应的数据,计算出曲线Z在对应温度下
CO (g) + 2H2 (g) CH3OH (g)的平衡常数K的值为 =
CH3OH (g)的平衡常数K的值为 =
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5 mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为
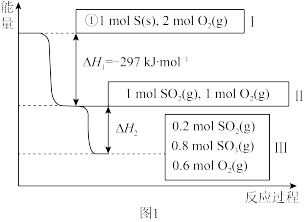
(1)在恒温,容积为1 L容器中,硫可以发生如下转化,其反应过程和能量关系如图1所示。已知:2SO2(g)+O2(g)
 2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:①写出能表示硫的燃烧热的热化学方程式:
②ΔH2=
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为
(2)中国政府承诺,到2020年单位GDP二氧化碳排放比2005年下降40%~50% 。
①CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=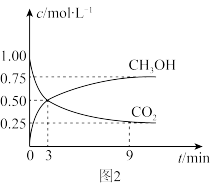
②能说明上述反应达到平衡状态的是
A、反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B、混合气体的密度不随时间的变化而变化
C、CO2的体积分数在混合气体中保持不变
D、单位时间内消耗3 mol H2,同时消耗1 mol H2O
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有
A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂
(1)① 把含有较高浓度CO2的空气通入饱和K2CO3溶液。
② 在①的吸收液中通高温水蒸气得到高浓度的CO2气体。
写出②中反应的化学方程式
(2)如将CO2与H2以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是
A.烷烃 B.烯烃 C.炔烃 D.苯的同系物
② 适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

从反应开始到平衡,v(H2)=
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
已知:
CH4(g) + 2O2(g)
 CO2(g)+ 2H2O(l) ΔH1=― 890.3 kJ/mol
CO2(g)+ 2H2O(l) ΔH1=― 890.3 kJ/molH2(g) + 1/2O2(g)
 H2O(l) ΔH2=-285.8 kJ/mol
H2O(l) ΔH2=-285.8 kJ/mol则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
| 溶解度(S)/g | 溶度积(Ksp) | ||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 |
(说明:Ksp越小,表示该物质在水溶液中越易沉淀)
吸收CO2最合适的试剂是
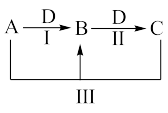
I.若以上各反应均为氧化还原反应,且A、B、C均含有同一种元素。则若A为一种有刺激性气味的氢化物,则A和D反应生成B的化学方程式为
II.若以上各反应均为非氧化还原反应。则
①若D为强碱,B有两性,则A和C反应的离子方程式是
②若D为一种酸性氧化物,则A和C反应的离子方程式是
(2)已知:2C(s)+O2(g)=2CO(g) ΔH= - 221 kJ/mol
C(s)+O2(g)=CO2(g) ∆H= - 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH=+181kJ/mol
回答下列问题:
①若某反应的平衡常数表达式为K=
 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式②下列措施能够增大此反应中NO转化率的是(填字母代号)
A.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
③向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)
 N2(g)+CO2(g),NO和N2的物质的量变化如表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如表所示。| 物质的量/mol | T1/℃ | T2/℃ | |||||
| 0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
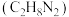 和
和 作推进剂,反应为:
作推进剂,反应为: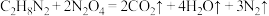 。请回答:
。请回答:(1)一定条件下,已知:
①
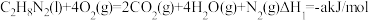
②
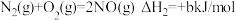
③
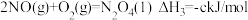
则:
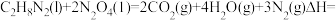
(2)100℃时,将
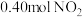 气体充入
气体充入 的真空密闭容器中发生反应:
的真空密闭容器中发生反应: ,每隔一段时间就对该容器内的物质进行测量,得到下表数据:
,每隔一段时间就对该容器内的物质进行测量,得到下表数据:| 时间/s | 0 | 20 | 40 | 60 | 80 |
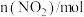 | 0.40 | a | 0.26 | b | c |
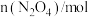 | 0.00 | 0.05 | d | 0.08 | 0.08 |
①从反应开始至
 内,用
内,用 表示的平均反应速率为
表示的平均反应速率为②100℃时,该反应的化学平衡常数的数值为
③达到平衡后,若降低温度,气体颜色变浅,则该反应的

 ,则该反应将
,则该反应将(3)下图是科学家制造出的一种效率更高的燃料电池,可用于航空航天。以稀土金属材料作惰性电极,固体电解质能传导
 ,两极分别通入
,两极分别通入 和
和 (空气)。则c电极上发生的电极反应式为
(空气)。则c电极上发生的电极反应式为
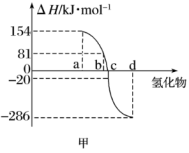
(1)请你归纳非金属元素氢化物的稳定性与氢化物的生成热ΔH的关系:
(2)在25℃、101kPa下,已知SiH4气体在氧气中完全燃烧后恢复至原状态,平均每转移1mol电子放热190.0kJ,写出SiH4燃烧热的热化学方程式是
Ⅱ.可逆反应FeO(s)+CO(g)
 Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如表:| T/K | 938 | 1100 |
| K | 0.68 | 0.40 |
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量
(5)CH4—CO2催化重整反应为CH4—CO2催化重整反应为CH4(g)+CO2(g)
 2CO(g)+2H2(g)。某温度下,在体积为2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为
2CO(g)+2H2(g)。某温度下,在体积为2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为(6)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇。发生的主要反应之一为CO(g)+2H2(g)
 CH3OH(g) ΔH<0,如图,能正确反映平衡常数K随温度变化关系的曲线为
CH3OH(g) ΔH<0,如图,能正确反映平衡常数K随温度变化关系的曲线为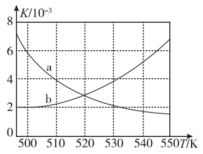
(1)以废气中的CO2为原料可制取甲醇。在恒容密闭容器中,298 K和101 kPa下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。①已知:H2(g)、CH3OH(l)的燃烧热△H分别为-285.8 kJ/ mol和 -726.5 kJ/mol;
CH3OH(l)= CH3OH(g) △H= +38 kJ /mo;
H2O(l)=H2O(g) △H=+44 kJ/mol;
则CO2(g)+3H2 (g)
 CH3OH(g) +H2O(g) △H=
CH3OH(g) +H2O(g) △H=②某温度下,在体积为2 L的恒容密闭容器中加入6 mol H2、2.4 mol CO2进行反应:CO2(g)+3H2 (g)
 CH3OH(g) +H2O(g),达到平衡时H2的转化率是50% ,则平衡时容器内的压强与起始压强之比为
CH3OH(g) +H2O(g),达到平衡时H2的转化率是50% ,则平衡时容器内的压强与起始压强之比为③起始温度、容器体积相同(T1℃、2 L密闭容器),一定条件下,反应I 、II起始CO2、H2、CH3OH(g)、H2O(g)的物质的量如下表所示:
| n(CO2)/mol | n(H2)/mol | n[CH3OH(g)]/mol | n[H2O(g)]/mol | |
| 反应I(恒温恒容) | 2 | 6 | 0 | 0 |
| 反应II(绝热恒容) | 0 | 0 | 2 | 2 |
对比反应I、II平衡常数:K(I)
(2)CO2可用来合成低碳烯烃:2CO2(g)+6H2 (g)
 CH2=CH2(g) +4H2O(g) △H=- 127.8 kJ/mol;在0.1 MPa下,CO2和H2以n(CO2):n(H2)=1:3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度下,反应达到平衡时的四种气态物质的物质的量分数如图1所示:
CH2=CH2(g) +4H2O(g) △H=- 127.8 kJ/mol;在0.1 MPa下,CO2和H2以n(CO2):n(H2)=1:3的投料比充入体积固定的密闭容器中,发生上述反应,不同温度下,反应达到平衡时的四种气态物质的物质的量分数如图1所示:
①曲线b、c表示的物质分别为
②保持某一温度不变,在体积为V L的恒容容器中以n(CO2):n(H2)=2:3的投料比加入反应物,t0时达到化学平衡。t1时将容器体积瞬间扩大至2V L并保持不变,t2时重新达到平衡。请在图2中作出容器内混合气体的平均相对分子质量
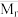 随时间变化的图象。
随时间变化的图象。
 。
。(1)在恒容条件下发生上述反应,达到平衡后除改变温度、压强外,提高
 平衡转化率的措施还有
平衡转化率的措施还有(2)一定温度下,在某催化剂表面发生反应
 ,该反应的速率方程为
,该反应的速率方程为 (k是速率常数,只与温度、催化剂有关;
(k是速率常数,只与温度、催化剂有关; 、
、 、
、 可以取整数、分数或负数,它们的和为反应级数)。某温度下,不同浓度下测得的该反应速率如表所示:
可以取整数、分数或负数,它们的和为反应级数)。某温度下,不同浓度下测得的该反应速率如表所示:| 序号 | 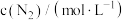 |  | 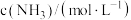 | 反应速率 |
| Ⅰ | 0.1 | 0.1 | 2 |  |
| Ⅱ | 0.1 | 0.4 | 2 | 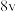 |
| Ⅲ | 0.2 | 0.4 | 2 |  |
| Ⅳ | 0.4 | 0.1 | 4 | 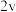 |
| Ⅴ | 0.2 | 0.1 | x | 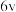 |
②该反应体系的三种物质中,
(3)在体积相等的甲、乙两个密闭容器中分别充入
 和
和 ,一个在绝热恒容、一个在恒温恒容条件下合成氨,测得气体的压强与时间的关系如图所示。
,一个在绝热恒容、一个在恒温恒容条件下合成氨,测得气体的压强与时间的关系如图所示。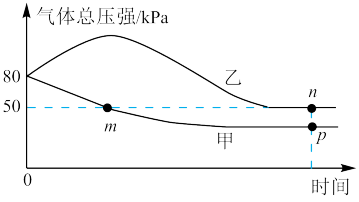
提示:净反应速率等于正、逆反应速率之差;
 为用分压表示的平衡常数,分压=总压×物质的量分数。
为用分压表示的平衡常数,分压=总压×物质的量分数。①p点的压强平衡常数

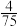 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②下列说法正确的是
A.m点气体的总物质的量大于n点
B.反应速率:n点的逆反应速率小于p点的正反应速率
C.甲为恒温恒容容器
D.净反应速率:n点大于p点
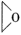 )可用作生产一次性口罩的灭菌剂。工业上常用乙烯氧化法生产环氧乙烷,反应原理为2CH2=CH2(g)+O2(g)
)可用作生产一次性口罩的灭菌剂。工业上常用乙烯氧化法生产环氧乙烷,反应原理为2CH2=CH2(g)+O2(g) 2
2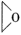 (g) ∆H=-210 kJ·mol-1。
(g) ∆H=-210 kJ·mol-1。(1)若CH2=CH2(g)的燃烧热∆H1=a kJ·mol-1,则
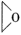 (g)的燃烧热∆H2=
(g)的燃烧热∆H2=(2)实验测得2CH2=CH2(g)+O2(g)
 2
2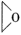 (g),v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2(
(g),v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2(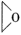 )(k正、k逆均为速率常数,只与温度有关)。
)(k正、k逆均为速率常数,只与温度有关)。①一定温度下,在容积恒为1 L的密闭容器中充入2 mol CH2=CH2(g)和1 mol O2(g)(不考虑其他副反应的发生,下同),反应达到平衡时CH2=CH2的转化率为75%,则该反应的
 =
=②达到平衡后,仅升高温度,k正增大的倍数
③保持温度不变,将①中容器压缩至0.5 L,CH2=CH2的平衡转化率将
(3)工业生产中常用高选择性的YS-8810银催化剂催化上述反应,其反应机理如下:
i.Ag+O2=AgO2 慢
ii.CH2=CH2+AgO2→
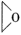 +AgO 快
+AgO 快ii.CH2=CH2+6AgO→2CO2+2H2O+6Ag 快
①增大CH2=CH2的浓度
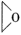 的生成速率,其原因为
的生成速率,其原因为②按上述反应机理,
 的选择性为
的选择性为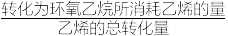 ×100%)。
×100%)。



