二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
①
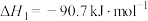

②
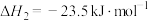

③
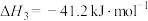

回答下列问题:
(1)反应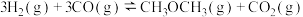 的
的
___________  ;该反应在
;该反应在___________ (填“低温”或“高温”)下能够自发进行,反应的平衡常数K=___________ (用含 、
、 、
、 的式子表示)。
的式子表示)。
(2)将合成气以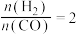 通入1L的反应器中,一定条件下发生反应:
通入1L的反应器中,一定条件下发生反应: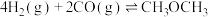

 ,其中CO的平衡转化率随温度、压强的变化关系如下图所示,下列说法正确的是(填字母)
,其中CO的平衡转化率随温度、压强的变化关系如下图所示,下列说法正确的是(填字母)___________ 。
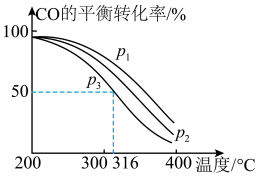
A.
B.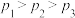
C.若在 和316℃时,起始时
和316℃时,起始时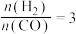 ,则平衡时,
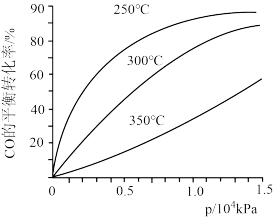
,则平衡时,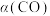 小于50%
小于50%
(3)CO合成甲醇时,在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在250℃、 kPa左右,选择此压强的理由是
kPa左右,选择此压强的理由是___________ 。
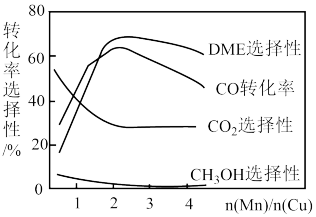
(4)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和 制备二甲醚(DME)。观察下图,当
制备二甲醚(DME)。观察下图,当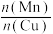 约为
约为___________ 时最有利于二甲醚的合成。
(5)高温时二甲醚蒸气发生分解反应: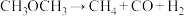 。迅速将二甲醚引入一个504℃的抽成真空的瓶中,在不同时刻测定瓶内压强
。迅速将二甲醚引入一个504℃的抽成真空的瓶中,在不同时刻测定瓶内压强 如下表:
如下表:
①该反应达到平衡状态时,二甲醚的转化率为___________ 。
②该反应的平衡常数
___________ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
①

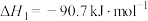

②

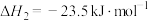

③

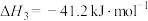

回答下列问题:
(1)反应
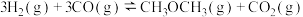 的
的
 ;该反应在
;该反应在 、
、 、
、 的式子表示)。
的式子表示)。(2)将合成气以
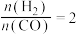 通入1L的反应器中,一定条件下发生反应:
通入1L的反应器中,一定条件下发生反应: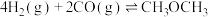

 ,其中CO的平衡转化率随温度、压强的变化关系如下图所示,下列说法正确的是(填字母)
,其中CO的平衡转化率随温度、压强的变化关系如下图所示,下列说法正确的是(填字母)
A.

B.
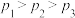
C.若在
 和316℃时,起始时
和316℃时,起始时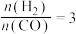 ,则平衡时,
,则平衡时,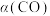 小于50%
小于50%(3)CO合成甲醇时,在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在250℃、
 kPa左右,选择此压强的理由是
kPa左右,选择此压强的理由是
(4)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和
 制备二甲醚(DME)。观察下图,当
制备二甲醚(DME)。观察下图,当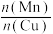 约为
约为
(5)高温时二甲醚蒸气发生分解反应:
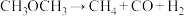 。迅速将二甲醚引入一个504℃的抽成真空的瓶中,在不同时刻测定瓶内压强
。迅速将二甲醚引入一个504℃的抽成真空的瓶中,在不同时刻测定瓶内压强 如下表:
如下表:| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
 /kPa /kPa | 50.0 | 78.0 | 92.0 | 99.0 | 100 | 100 |
②该反应的平衡常数

更新时间:2023-11-09 16:30:35
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)反应:N2(g)+O2(g)⇌2NO(g) △H1=+180.5kJ·mol-1
2NO(g)+2CO(g)⇌N2(g)+2CO2(g) △H2
已知CO的燃烧热为283.0 kJ·mol-1,则△H2=________ 。
(2)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)⇌2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g) ⇌2NO2(g)的反应历程分两步:
Ⅰ.2NO(g)⇌N2O2(g)(快);v1正=k1正·c2(NO);v1逆=k1逆·c(N2O2) △H1<0
Ⅱ.N2O2(g)+O2(g)=2NO2(g)(慢);v2正=k2正·c(N2O2)c(O2);v2逆=k2逆·c2(NO2) △H2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=_________ 。
②决定2NO(g)+O2(g)⇌2NO2(g)速率的是反应_________ (填“Ⅰ”或“Ⅱ”),反应Ⅰ的活化能E1与反应Ⅱ的活化能E2的大小关系为E1______ E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是______ 。
A.k2正增大,c(N2O2)增大 B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小 D.k2正减小,c(N2O2)增大
(3)在一定温度下向容积为2L的密闭容器中加入0.5molNO、0.5molCO,此时容器总压为P0kPa,发生反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g),4min时达平衡,此时测得氮气的物质的量为0.2mol,则0-4min内用CO2表示的的平均速率为_______ kPa·min-1,用平衡分压表示的平衡常数KP=__________ (用含有P0的代数式表示)。达平衡后,若改变下列条件,既能加快反应速率又能提高NO的转化率的是_______
A.增大压强 B.降低温度 C.再加入0.5molNO、0.5molCO D.分离出部分N2
(1)反应:N2(g)+O2(g)⇌2NO(g) △H1=+180.5kJ·mol-1
2NO(g)+2CO(g)⇌N2(g)+2CO2(g) △H2
已知CO的燃烧热为283.0 kJ·mol-1,则△H2=
(2)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)⇌2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g) ⇌2NO2(g)的反应历程分两步:
Ⅰ.2NO(g)⇌N2O2(g)(快);v1正=k1正·c2(NO);v1逆=k1逆·c(N2O2) △H1<0
Ⅱ.N2O2(g)+O2(g)=2NO2(g)(慢);v2正=k2正·c(N2O2)c(O2);v2逆=k2逆·c2(NO2) △H2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=
②决定2NO(g)+O2(g)⇌2NO2(g)速率的是反应
A.k2正增大,c(N2O2)增大 B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小 D.k2正减小,c(N2O2)增大
(3)在一定温度下向容积为2L的密闭容器中加入0.5molNO、0.5molCO,此时容器总压为P0kPa,发生反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g),4min时达平衡,此时测得氮气的物质的量为0.2mol,则0-4min内用CO2表示的的平均速率为
A.增大压强 B.降低温度 C.再加入0.5molNO、0.5molCO D.分离出部分N2
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】硫及其化合物在日常生活、工业生产中都非常普遍。
(1)变废为宝是治理污染的常用手段。以 为催化剂,将
为催化剂,将 氧化为
氧化为 ,再进一步转化为硫酸,是工业上制取硫酸的常用方法。该过程可分为如下步骤:
,再进一步转化为硫酸,是工业上制取硫酸的常用方法。该过程可分为如下步骤:
(i)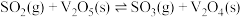
(ii)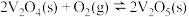
能量变化如图所示。
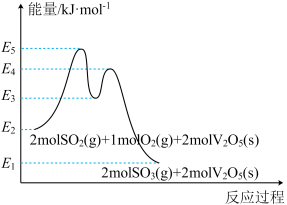
总反应 的
的
_____  (用
(用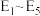 中的合理数据组成的代数式表示)。决定
中的合理数据组成的代数式表示)。决定 催化氧化总反应速率的是步骤
催化氧化总反应速率的是步骤____ (填i或ii),其活化能为______  (用
(用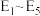 中的合理数据组成的代数式表示)。
中的合理数据组成的代数式表示)。
(2)在水中,硫酸是一种强酸,但实际上只有第一步电离是完全的,第二步电离并不完全,电离方程式可表示为: ,
, 。
。
① 时,
时, 溶液的
溶液的
_____ 7(填“>”“<”或“=”)。
② 的稀硫酸中,
的稀硫酸中,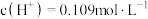 ,则硫酸第二步电离的电离常数
,则硫酸第二步电离的电离常数
_______ (只列式,不计算)。
(3)液态水中,水存在自偶电离: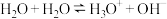 。平常书写的
。平常书写的 ,实际上是纯水或水溶液中
,实际上是纯水或水溶液中 的缩写。如
的缩写。如 在水中电离,完整写法是
在水中电离,完整写法是 。
。
①液态的醋酸(用 表示)中,同样存在
表示)中,同样存在 的自偶电离,其方程式可表示为
的自偶电离,其方程式可表示为____ 。
②用醋酸作溶剂时,硫酸是一种二元弱酸。将少量 溶于冰醋酸中,第一步电离的完整写法是
溶于冰醋酸中,第一步电离的完整写法是____ 。若保持温度不变,关于该所得溶液,下列说法正确的是____ 。
A.加入少量冰醋酸,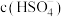 与
与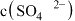 均减小
均减小
B.加入少量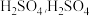 的电离程度增大
的电离程度增大
C.加入少量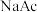 固体,
固体,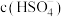 与
与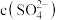 的比值减小
的比值减小
D.加入少量 固体,
固体,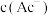 减小
减小
(1)变废为宝是治理污染的常用手段。以
 为催化剂,将
为催化剂,将 氧化为
氧化为 ,再进一步转化为硫酸,是工业上制取硫酸的常用方法。该过程可分为如下步骤:
,再进一步转化为硫酸,是工业上制取硫酸的常用方法。该过程可分为如下步骤:(i)
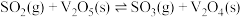
(ii)
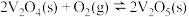
能量变化如图所示。

总反应
 的
的
 (用
(用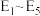 中的合理数据组成的代数式表示)。决定
中的合理数据组成的代数式表示)。决定 催化氧化总反应速率的是步骤
催化氧化总反应速率的是步骤 (用
(用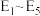 中的合理数据组成的代数式表示)。
中的合理数据组成的代数式表示)。(2)在水中,硫酸是一种强酸,但实际上只有第一步电离是完全的,第二步电离并不完全,电离方程式可表示为:
 ,
, 。
。①
 时,
时, 溶液的
溶液的
②
 的稀硫酸中,
的稀硫酸中,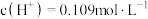 ,则硫酸第二步电离的电离常数
,则硫酸第二步电离的电离常数
(3)液态水中,水存在自偶电离:
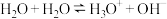 。平常书写的
。平常书写的 ,实际上是纯水或水溶液中
,实际上是纯水或水溶液中 的缩写。如
的缩写。如 在水中电离,完整写法是
在水中电离,完整写法是 。
。①液态的醋酸(用
 表示)中,同样存在
表示)中,同样存在 的自偶电离,其方程式可表示为
的自偶电离,其方程式可表示为②用醋酸作溶剂时,硫酸是一种二元弱酸。将少量
 溶于冰醋酸中,第一步电离的完整写法是
溶于冰醋酸中,第一步电离的完整写法是A.加入少量冰醋酸,
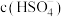 与
与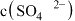 均减小
均减小B.加入少量
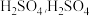 的电离程度增大
的电离程度增大C.加入少量
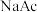 固体,
固体,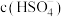 与
与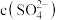 的比值减小
的比值减小D.加入少量
 固体,
固体,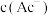 减小
减小
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】诺贝尔化学奖获得者GeorgeA.Olah提出了“甲醇经济”的概念,他建议使用甲醇来代替目前广泛使用的化石燃料。工业上用天然气为原料,分为两个阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206.0 kJ·mol-1
CO(g)+3H2(g) △H=+206.0 kJ·mol-1
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g) △H=-90.67 kJ·mol-1
CH3OH(g) △H=-90.67 kJ·mol-1
回答下列问题:
(1)制备合成气反应中,平衡混合物中CO的体积分数与压强的关系如图1所示,判断T1和T2的大小关系:T1___________ T2(填“>”“<”或“=”),理由是___________ 。
(2)工业生产中为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应 CO2(g)+H2(g) CO(g)+H2O(g) △H=+41.17 kJ·mol-1。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳的体积比为
CO(g)+H2O(g) △H=+41.17 kJ·mol-1。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳的体积比为___________ 。
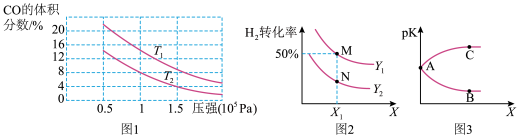
(3)在体积不变的密闭容器中投入0.5 mol CO和1 mol H2,不同条件下发生反应:CO(g)+2H2(g) CH3OH(g) △H。实验测得平衡时H2的转化率随温度、压强的变化如图2所示。
CH3OH(g) △H。实验测得平衡时H2的转化率随温度、压强的变化如图2所示。
①图2中X代表___________ (填“温度”或“压强”)。图3中正确表示该反应的平衡常数的负对数pK(pK=-lgK)与X的关系的曲线是___________ (填“AC”或“AB”)。
②若图2中M点对应的容器体积为5 L,则N点的平衡常数为___________ L2·mol-2。
(4)为节约化石能源、减少碳排放,用CO2代替CO作为制备甲醇的碳源正成为当前研究的焦点。
①二氧化碳加氢合成甲醇和水蒸气的热化学方程式为___________ 。
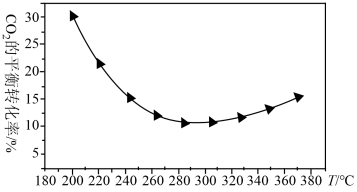
②研究表明在二氧化碳合成甲醇的原料气中加入一氧化碳可以降低CO2与H2反应的活化能。在200~360℃、9 MPa时,合成气初始组成H2、CO、CO2物质的量之比为7:2:1的条件下研究甲醇的合成反应(如图4所示)。CO2的平衡转化率随温度的升高先减小后增大,先减小的原因是___________ ,后增大的原因是___________ 。
(i)制备合成气:CH4(g)+H2O(g)
 CO(g)+3H2(g) △H=+206.0 kJ·mol-1
CO(g)+3H2(g) △H=+206.0 kJ·mol-1(ii)合成甲醇:CO(g)+2H2(g)
 CH3OH(g) △H=-90.67 kJ·mol-1
CH3OH(g) △H=-90.67 kJ·mol-1回答下列问题:
(1)制备合成气反应中,平衡混合物中CO的体积分数与压强的关系如图1所示,判断T1和T2的大小关系:T1
(2)工业生产中为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应 CO2(g)+H2(g)
 CO(g)+H2O(g) △H=+41.17 kJ·mol-1。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳的体积比为
CO(g)+H2O(g) △H=+41.17 kJ·mol-1。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳的体积比为
(3)在体积不变的密闭容器中投入0.5 mol CO和1 mol H2,不同条件下发生反应:CO(g)+2H2(g)
 CH3OH(g) △H。实验测得平衡时H2的转化率随温度、压强的变化如图2所示。
CH3OH(g) △H。实验测得平衡时H2的转化率随温度、压强的变化如图2所示。①图2中X代表
②若图2中M点对应的容器体积为5 L,则N点的平衡常数为
(4)为节约化石能源、减少碳排放,用CO2代替CO作为制备甲醇的碳源正成为当前研究的焦点。
①二氧化碳加氢合成甲醇和水蒸气的热化学方程式为
②研究表明在二氧化碳合成甲醇的原料气中加入一氧化碳可以降低CO2与H2反应的活化能。在200~360℃、9 MPa时,合成气初始组成H2、CO、CO2物质的量之比为7:2:1的条件下研究甲醇的合成反应(如图4所示)。CO2的平衡转化率随温度的升高先减小后增大,先减小的原因是

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。
Ⅰ. CO还原法
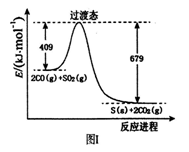
(1)一定条件下,由SO2和CO反应生成S和CO2的能量变化如右图I所示,每生成16gS(s) ,该反应_______ (填“放出”或“吸收”)的热量为_________ 。
(2)在绝热恒容的密闭容器中,进行反应:
2CO(g)+SO2(g) S(s)+2CO2(g),该反应的平衡常数表达式为
S(s)+2CO2(g),该反应的平衡常数表达式为_______ 。对此反应下列说法正确的是__________
A.若混合气体密度保持不变,则已达平衡状态
B.反应开始到平衡时,容器内气体的压强保持不变
C.达平衡后若再充人一定量CO2,平衡常数保持不变
D.分离出S,正、逆反应速率均保持不变
(3)向2L恒温恒容密闭容器中通入2molCO和lmolSO2,分别进行a、b、c三组实验。在不同条件下发生反应:2CO(g)+SO2(g) S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a
S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a ______ b ______ c (填“> ”、“< ”、或“=”) ;实验a从反应开始至平衡时,反应速率v(SO2)=____________ 。
Ⅱ.Na2SO3溶液吸收法
常温下,用300mL1.0mol·L-1,Na2SO3溶液吸收SO2的过程中,溶液pH随吸收SO2物质的量的变化曲线如上图Ⅲ所示。
(4)1.0mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为_________
(5)若用等体积、等物质的量浓度的下列溶液分别吸收SO2,则理论上吸收量最多的是____
A. NH3·H2O B. Na2S C. Na2CO3 D. FeCl3
(6)常温下,H2SO3的二级电离平衡常数Ka2的数值为_________ 。
Ⅰ. CO还原法
(1)一定条件下,由SO2和CO反应生成S和CO2的能量变化如右图I所示,每生成16gS(s) ,该反应
(2)在绝热恒容的密闭容器中,进行反应:
2CO(g)+SO2(g)
 S(s)+2CO2(g),该反应的平衡常数表达式为
S(s)+2CO2(g),该反应的平衡常数表达式为A.若混合气体密度保持不变,则已达平衡状态
B.反应开始到平衡时,容器内气体的压强保持不变
C.达平衡后若再充人一定量CO2,平衡常数保持不变
D.分离出S,正、逆反应速率均保持不变
(3)向2L恒温恒容密闭容器中通入2molCO和lmolSO2,分别进行a、b、c三组实验。在不同条件下发生反应:2CO(g)+SO2(g)
 S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a
S(s)+2CO2,反应体系总压强随时间的变化曲线如下图Ⅱ所示,则三组实验温度的关系是a 
Ⅱ.Na2SO3溶液吸收法
常温下,用300mL1.0mol·L-1,Na2SO3溶液吸收SO2的过程中,溶液pH随吸收SO2物质的量的变化曲线如上图Ⅲ所示。

(4)1.0mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为
(5)若用等体积、等物质的量浓度的下列溶液分别吸收SO2,则理论上吸收量最多的是
A. NH3·H2O B. Na2S C. Na2CO3 D. FeCl3
(6)常温下,H2SO3的二级电离平衡常数Ka2的数值为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】热解耦合化学链制氢工艺是一种将生物质废物转变为高纯 的环境友好型技术路线,如图。
的环境友好型技术路线,如图。
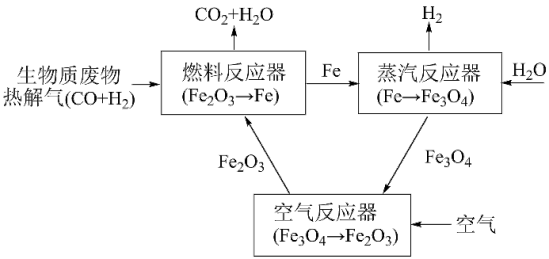
(1)在燃料反应器中,研究人员对纯 作为燃料气与铁基载氧体(
作为燃料气与铁基载氧体( )的还原反应进行了理论研究,得到了还原阶段
)的还原反应进行了理论研究,得到了还原阶段 平衡浓度和固体成分随温度变化的图象,如图。
平衡浓度和固体成分随温度变化的图象,如图。
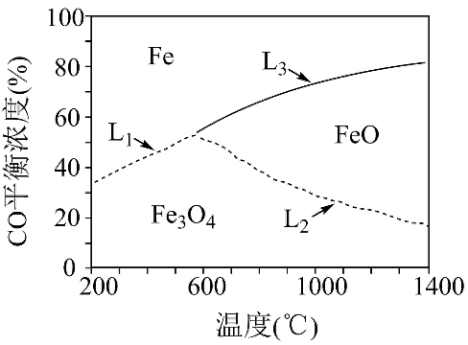
已知:a.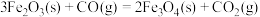
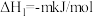
b.

c.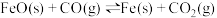
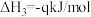
①反应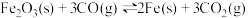 的
的
_______  (用m、n、q表示)。
(用m、n、q表示)。
②当温度低于 时,燃料还原阶段得到的固体主要是
时,燃料还原阶段得到的固体主要是 和
和_______ 。
③曲线 代表的反应为
代表的反应为_______ (填“b”或“c”),曲线 随温度升高而降低的原因是
随温度升高而降低的原因是_______ 。
④纯 作燃料气反应时发生歧化反应[
作燃料气反应时发生歧化反应[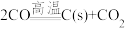 ]使铁基载氧体的固定床内大量积碳。对
]使铁基载氧体的固定床内大量积碳。对 歧化反应进行独立研究:
歧化反应进行独立研究: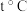 时,向一固定容器中通入一定量
时,向一固定容器中通入一定量 ,测得平衡后
,测得平衡后 的浓度为
的浓度为 ,已知该温度下反应的平衡常数
,已知该温度下反应的平衡常数 ,
, 的平衡转化率是
的平衡转化率是_______ (写出计算过程,保留一位小数)。
(2) 深度还原
深度还原 的过程为:
的过程为: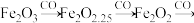
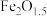
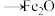 。该过程中,在不同铁基载氧体(
。该过程中,在不同铁基载氧体( )表面的能垒变化如图所示:
)表面的能垒变化如图所示: 在各表面稳定吸附为初始状态(
在各表面稳定吸附为初始状态( ),
), 从各表面脱附进入气相为最终状态(
从各表面脱附进入气相为最终状态( )。
)。

① 在
在_______ 表面反应释放 的速率最快;释放等量
的速率最快;释放等量 时,在
时,在_______ 表面反应放出能量最多(填“Ⅰ”、“Ⅱ”、“ⅢI”或“Ⅳ”)。
② 在Ⅰ表面上的反应路径分三步:
在Ⅰ表面上的反应路径分三步:
i.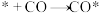 ;(*为活性点位)
;(*为活性点位)
ⅱ. ;
;
ⅲ._______ 。
(3)在蒸汽反应器中,研究表明:压强对出口气体百分含量的影响不大,其原因是_______ 。
 的环境友好型技术路线,如图。
的环境友好型技术路线,如图。
(1)在燃料反应器中,研究人员对纯
 作为燃料气与铁基载氧体(
作为燃料气与铁基载氧体( )的还原反应进行了理论研究,得到了还原阶段
)的还原反应进行了理论研究,得到了还原阶段 平衡浓度和固体成分随温度变化的图象,如图。
平衡浓度和固体成分随温度变化的图象,如图。
已知:a.
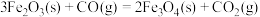
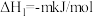
b.


c.
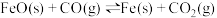
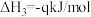
①反应
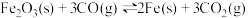 的
的
 (用m、n、q表示)。
(用m、n、q表示)。②当温度低于
 时,燃料还原阶段得到的固体主要是
时,燃料还原阶段得到的固体主要是 和
和③曲线
 代表的反应为
代表的反应为 随温度升高而降低的原因是
随温度升高而降低的原因是④纯
 作燃料气反应时发生歧化反应[
作燃料气反应时发生歧化反应[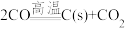 ]使铁基载氧体的固定床内大量积碳。对
]使铁基载氧体的固定床内大量积碳。对 歧化反应进行独立研究:
歧化反应进行独立研究: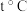 时,向一固定容器中通入一定量
时,向一固定容器中通入一定量 ,测得平衡后
,测得平衡后 的浓度为
的浓度为 ,已知该温度下反应的平衡常数
,已知该温度下反应的平衡常数 ,
, 的平衡转化率是
的平衡转化率是(2)
 深度还原
深度还原 的过程为:
的过程为: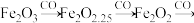
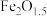
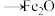 。该过程中,在不同铁基载氧体(
。该过程中,在不同铁基载氧体( )表面的能垒变化如图所示:
)表面的能垒变化如图所示: 在各表面稳定吸附为初始状态(
在各表面稳定吸附为初始状态( ),
), 从各表面脱附进入气相为最终状态(
从各表面脱附进入气相为最终状态( )。
)。
①
 在
在 的速率最快;释放等量
的速率最快;释放等量 时,在
时,在②
 在Ⅰ表面上的反应路径分三步:
在Ⅰ表面上的反应路径分三步:i.
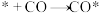 ;(*为活性点位)
;(*为活性点位)ⅱ.
 ;
;ⅲ.
(3)在蒸汽反应器中,研究表明:压强对出口气体百分含量的影响不大,其原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】硫和氮是生物必需的营养元素,含硫和氮的化合物在自然界中广泛存在。
(1)火山喷发产生 在大气中发生如下反应:
在大气中发生如下反应:
①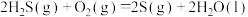 ;
;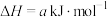
② ;
;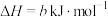
写出 燃烧的热化学方程式:
燃烧的热化学方程式:______ 。
(2)工业上可用NaClO碱性溶液吸收 。为了提高吸收效率,常用
。为了提高吸收效率,常用 作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力可加快对
作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力可加快对 的吸收。该催化过程的示意图如图所示。
的吸收。该催化过程的示意图如图所示。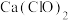 也可用于脱硫,原因是
也可用于脱硫,原因是______ 。 和NO。已知:
和NO。已知: 是一种弱酸。
是一种弱酸。______ 。
②若无能量损失,相同条件下, 和NO的体积比为
和NO的体积比为______ 时,两种气体都能被完全处理。
(4)在起始温度为T℃、容积均为10L的密闭容器A(恒温)、B(绝热)中均加入1mol 和4mol
和4mol  ,发生反应
,发生反应
 。已知:
。已知: 、
、 分别是正、逆反应速率常数,
分别是正、逆反应速率常数,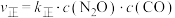 ,
,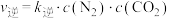 ,A、B容器中
,A、B容器中 的转化率随时间的变化关系如图所示。
的转化率随时间的变化关系如图所示。______ 。
②T℃时
______ 。
(5)太阳能光电催化-化学耦合分解 的装置如图所示.该太阳能光电催化—化学耦合分解
的装置如图所示.该太阳能光电催化—化学耦合分解 的过程可描述为
的过程可描述为______ 。
(1)火山喷发产生
 在大气中发生如下反应:
在大气中发生如下反应:①
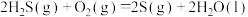 ;
;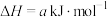
②
 ;
;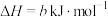
写出
 燃烧的热化学方程式:
燃烧的热化学方程式:(2)工业上可用NaClO碱性溶液吸收
 。为了提高吸收效率,常用
。为了提高吸收效率,常用 作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力可加快对
作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力可加快对 的吸收。该催化过程的示意图如图所示。
的吸收。该催化过程的示意图如图所示。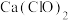 也可用于脱硫,原因是
也可用于脱硫,原因是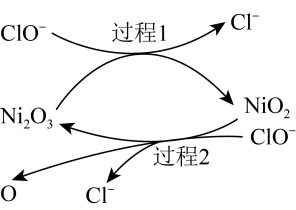
 和NO。已知:
和NO。已知: 是一种弱酸。
是一种弱酸。
②若无能量损失,相同条件下,
 和NO的体积比为
和NO的体积比为(4)在起始温度为T℃、容积均为10L的密闭容器A(恒温)、B(绝热)中均加入1mol
 和4mol
和4mol  ,发生反应
,发生反应
 。已知:
。已知: 、
、 分别是正、逆反应速率常数,
分别是正、逆反应速率常数,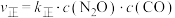 ,
,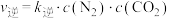 ,A、B容器中
,A、B容器中 的转化率随时间的变化关系如图所示。
的转化率随时间的变化关系如图所示。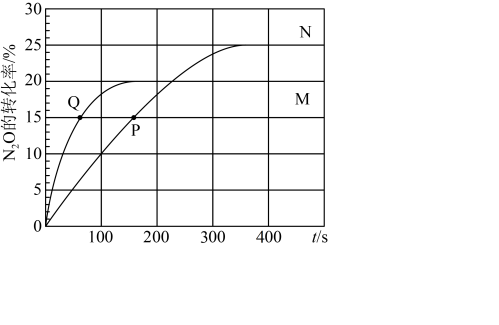
②T℃时

(5)太阳能光电催化-化学耦合分解
 的装置如图所示.该太阳能光电催化—化学耦合分解
的装置如图所示.该太阳能光电催化—化学耦合分解 的过程可描述为
的过程可描述为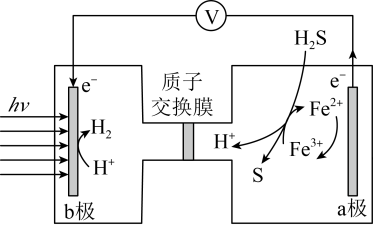
您最近一年使用:0次
【推荐1】乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心。
(1)甲醇制备乙烯的主要反应:
i. 2CH3OH(g)=C2H4(g)+2H2O(g) ∆H1=—20.9 kJ/mol
ii. 3CH3OH(g)=C3H6(g)+3H2O(g) ∆H2=—98.1 kJ/mol
iii. 4CH3OH(g)=C4H8(g)+4H2O(g) ∆H3=—118.1 kJ/mol
①C3H6转化为C2H4的热化学方程式iv:2C3H6(g) =3C2H4(g) ∆H4=___________ ,该反应能自发进行的条件是___________ (填“较低”“较高”或“任意”)温度。
②加入N2作为稀释剂,反应i中C2H4的产率将___________ (填“增大”、减小”或“不变”)。
(2)乙炔在Pd表面选择加氢生成乙烯的反应机理如图。其中吸附在Pd表面上的物种用*标注。
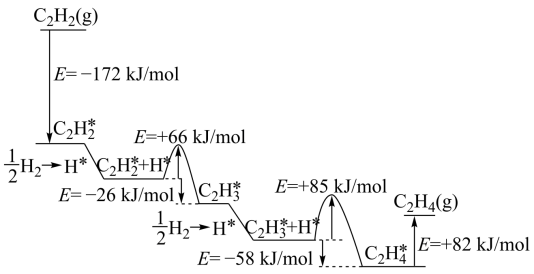
该历程中最大能垒(活化能)Ea(正)=___________ kJ/mol,该步骤的化学方程式为___________ 。
(3)Warker法是目前工业上生产乙醛的最重要方法。其反应如下:
CH2=CH2(g)+ O2(g)
O2(g)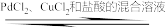 CH3CHO(g) ∆H= -243.68kJ/mol
CH3CHO(g) ∆H= -243.68kJ/mol
某温度下,物质的量之比为2:1的CH=CH2和O2在刚性容器内发生反应该反应,若起始总压为1.5 MPa,反应达到平衡时总压减少了25 %,则CH2=CH2的平衡转化率为___________ ,用各物质的平衡分压表示该反应的平衡常数,则Kp=___________ MPa-0.5(只要列出计算式,分压=总压×物质的量分数)。
(4)电解法处理含乙醛的工业废水的总反应为2CH3CHO+H2O CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛和H2SO4溶液为电解质溶液,模拟含乙醛的工业废水,用惰性电极进行电解,其装置如图所示。
CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛和H2SO4溶液为电解质溶液,模拟含乙醛的工业废水,用惰性电极进行电解,其装置如图所示。
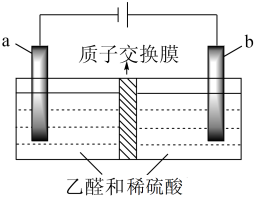
①b上的电极反应式为___________ 。
②在处理过程中,当外电路中的电流I= a A(A为电流单位)时,b分钟处理掉乙醛 c克,则该电解装置的电流效率η=___________ (用含a、b、c的代数式表示)。[已知:F=96500C∙mol-1,η=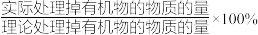 ]
]
(1)甲醇制备乙烯的主要反应:
i. 2CH3OH(g)=C2H4(g)+2H2O(g) ∆H1=—20.9 kJ/mol
ii. 3CH3OH(g)=C3H6(g)+3H2O(g) ∆H2=—98.1 kJ/mol
iii. 4CH3OH(g)=C4H8(g)+4H2O(g) ∆H3=—118.1 kJ/mol
①C3H6转化为C2H4的热化学方程式iv:2C3H6(g) =3C2H4(g) ∆H4=
②加入N2作为稀释剂,反应i中C2H4的产率将
(2)乙炔在Pd表面选择加氢生成乙烯的反应机理如图。其中吸附在Pd表面上的物种用*标注。

该历程中最大能垒(活化能)Ea(正)=
(3)Warker法是目前工业上生产乙醛的最重要方法。其反应如下:
CH2=CH2(g)+
 O2(g)
O2(g)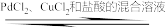 CH3CHO(g) ∆H= -243.68kJ/mol
CH3CHO(g) ∆H= -243.68kJ/mol某温度下,物质的量之比为2:1的CH=CH2和O2在刚性容器内发生反应该反应,若起始总压为1.5 MPa,反应达到平衡时总压减少了25 %,则CH2=CH2的平衡转化率为
(4)电解法处理含乙醛的工业废水的总反应为2CH3CHO+H2O
 CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛和H2SO4溶液为电解质溶液,模拟含乙醛的工业废水,用惰性电极进行电解,其装置如图所示。
CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛和H2SO4溶液为电解质溶液,模拟含乙醛的工业废水,用惰性电极进行电解,其装置如图所示。
①b上的电极反应式为
②在处理过程中,当外电路中的电流I= a A(A为电流单位)时,b分钟处理掉乙醛 c克,则该电解装置的电流效率η=
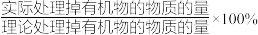 ]
]
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】 是一种主要的温室气体,我国力争于2030年做到碳达峰,2060年实现碳中和,
是一种主要的温室气体,我国力争于2030年做到碳达峰,2060年实现碳中和, 催化加氢制甲醇,降低空气中
催化加氢制甲醇,降低空气中 含量,是当前研究的热点之一。
含量,是当前研究的热点之一。
已知:Ⅰ.
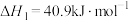
Ⅱ.

Ⅲ.
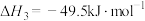
(1)
__________  。
。
(2)向300℃、体积为VL的恒容密闭容器中通入 和
和 发生上述3个反应,达到平衡时,容器中
发生上述3个反应,达到平衡时,容器中 为amol,
为amol, 为bmol,此时CO的浓度为
为bmol,此时CO的浓度为__________  (用含a、b、V的代数式表示)。
(用含a、b、V的代数式表示)。
(3)研究反应Ⅱ发现:该反应速率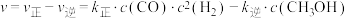 ,其中
,其中 、
、 分别为正、逆反应速率常数,c为物质的量浓度,若某平衡体系中只存在反应Ⅱ。
分别为正、逆反应速率常数,c为物质的量浓度,若某平衡体系中只存在反应Ⅱ。
①已知 ,下图中A点所处状态在温度升高后pK数值将变为
,下图中A点所处状态在温度升高后pK数值将变为__________ 点(填“B”、“C”或“D”)。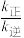 的值
的值__________ (填“增大”“减小”或“不变”) 。
(4)向某密闭容器中按 通入两种反应物(假设只发生反应Ⅲ),在不同条件下达到平衡,假设体系中甲醇的物质的量分数为
通入两种反应物(假设只发生反应Ⅲ),在不同条件下达到平衡,假设体系中甲醇的物质的量分数为 ,分别在恒温(t=250℃)下改变压强、在恒压(
,分别在恒温(t=250℃)下改变压强、在恒压( )下改变温度,获得数据如下图所示:
)下改变温度,获得数据如下图所示:____________________ ,判断依据是______________________________ 。
②当 时,
时, 的平衡转化率为
的平衡转化率为__________ 。(保留三位有效数字)
(5)某温度下将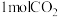 和
和 充入某恒容密闭容器中(假设只发生反应Ⅲ),初始压强为p,保持温度不变,平衡时
充入某恒容密闭容器中(假设只发生反应Ⅲ),初始压强为p,保持温度不变,平衡时 的转化率为50%,则该温度下的平衡常数
的转化率为50%,则该温度下的平衡常数 为
为__________ (用含p的关系式表示)。
 是一种主要的温室气体,我国力争于2030年做到碳达峰,2060年实现碳中和,
是一种主要的温室气体,我国力争于2030年做到碳达峰,2060年实现碳中和, 催化加氢制甲醇,降低空气中
催化加氢制甲醇,降低空气中 含量,是当前研究的热点之一。
含量,是当前研究的热点之一。已知:Ⅰ.

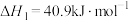
Ⅱ.


Ⅲ.

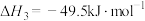
(1)

 。
。(2)向300℃、体积为VL的恒容密闭容器中通入
 和
和 发生上述3个反应,达到平衡时,容器中
发生上述3个反应,达到平衡时,容器中 为amol,
为amol, 为bmol,此时CO的浓度为
为bmol,此时CO的浓度为 (用含a、b、V的代数式表示)。
(用含a、b、V的代数式表示)。(3)研究反应Ⅱ发现:该反应速率
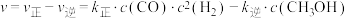 ,其中
,其中 、
、 分别为正、逆反应速率常数,c为物质的量浓度,若某平衡体系中只存在反应Ⅱ。
分别为正、逆反应速率常数,c为物质的量浓度,若某平衡体系中只存在反应Ⅱ。①已知
 ,下图中A点所处状态在温度升高后pK数值将变为
,下图中A点所处状态在温度升高后pK数值将变为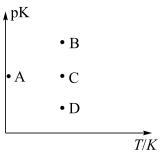
 的值
的值(4)向某密闭容器中按
 通入两种反应物(假设只发生反应Ⅲ),在不同条件下达到平衡,假设体系中甲醇的物质的量分数为
通入两种反应物(假设只发生反应Ⅲ),在不同条件下达到平衡,假设体系中甲醇的物质的量分数为 ,分别在恒温(t=250℃)下改变压强、在恒压(
,分别在恒温(t=250℃)下改变压强、在恒压( )下改变温度,获得数据如下图所示:
)下改变温度,获得数据如下图所示: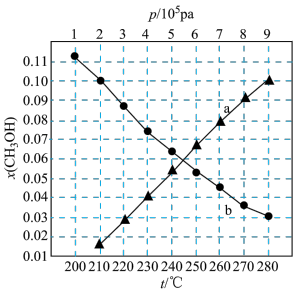
②当
 时,
时, 的平衡转化率为
的平衡转化率为(5)某温度下将
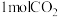 和
和 充入某恒容密闭容器中(假设只发生反应Ⅲ),初始压强为p,保持温度不变,平衡时
充入某恒容密闭容器中(假设只发生反应Ⅲ),初始压强为p,保持温度不变,平衡时 的转化率为50%,则该温度下的平衡常数
的转化率为50%,则该温度下的平衡常数 为
为
您最近一年使用:0次
【推荐3】硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050molSO2和0.030molO2放入容积为1L的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1
①从平衡角度分析采用过量O2的目的是___ 。
②该条件下反应的平衡常数K=___ 。
③已知:K(300℃)>K(350℃),正反应是___ (填“吸”或“放”)热反应。若反应温度升高,SO2的转化率___ (填“增大”“减小”或“不变”)。
(2)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图I所示。平衡状态由A变到B时,平衡常数K(A)___ K(B)(填“大于”“等于”或“小于”,下同)。
(3)如图II所示,保持温度不变,将2molSO2和1molO2加入甲容器中,将4molSO3加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲___ 乙。
②若保持乙中压强不变,向甲、乙容器中通入等质量的氦气,达到新平衡时,SO3的体积分数甲___ 乙。

(1)将0.050molSO2和0.030molO2放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)
 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1①从平衡角度分析采用过量O2的目的是
②该条件下反应的平衡常数K=
③已知:K(300℃)>K(350℃),正反应是
(2)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图I所示。平衡状态由A变到B时,平衡常数K(A)
(3)如图II所示,保持温度不变,将2molSO2和1molO2加入甲容器中,将4molSO3加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲
②若保持乙中压强不变,向甲、乙容器中通入等质量的氦气,达到新平衡时,SO3的体积分数甲
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】已知, 生产甲醇过程主要发生以下反应:
生产甲醇过程主要发生以下反应:
反应I.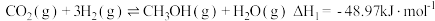
反应II.
反应III.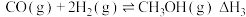
(1)反应III中, H=
H=_____________  ,该反应在
,该反应在_______ 条件下能自发进行。
A.在低温条件下自发进行 B.在高温条件下自发进行
C.在任何条件下都能自发进行 D.在任何条件下都不能自发进行
(2)反应III中, 的平衡转化率与温度的关系如图所示:
的平衡转化率与温度的关系如图所示: 两点压强大小关系是pA
两点压强大小关系是pA_____________ pB(填“ 、
、 、
、 ”)。
”)。
② 三点平衡常数
三点平衡常数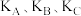 的大小关系为
的大小关系为_____________ 。 时,由D点到A点过程中正、逆反应速率之间的关系:v正
时,由D点到A点过程中正、逆反应速率之间的关系:v正_____________ v逆。(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(3)完成下列问题。
①向某恒温恒压密闭容器中充入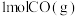 和
和 ,下列能说明反应III达到平衡的是
,下列能说明反应III达到平衡的是_______ 。
A.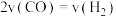
B.两种反应物转化率的比值不再改变
C.容器内混合气体的平均相对分子质量不再改变
D.容器内混合气体的密度不再改变
②在 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,在
,在 和
和 条件下经
条件下经 达到平衡状态。在该条件下,v(H2)=
达到平衡状态。在该条件下,v(H2)=_______ 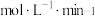 。
。
(4)已知: 的选择性
的选择性 ,不考虑催化剂活性温度,为同时提高
,不考虑催化剂活性温度,为同时提高 的平衡转化率和甲醇的选择性,应选择的反应条件是
的平衡转化率和甲醇的选择性,应选择的反应条件是_______ ,说明其原因_____________________ 。
A.低温低压 B.低温高压 C.高温高压 D.高温低压
 生产甲醇过程主要发生以下反应:
生产甲醇过程主要发生以下反应:反应I.
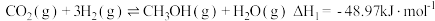
反应II.

反应III.
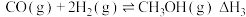
(1)反应III中,
 H=
H= ,该反应在
,该反应在A.在低温条件下自发进行 B.在高温条件下自发进行
C.在任何条件下都能自发进行 D.在任何条件下都不能自发进行
(2)反应III中,
 的平衡转化率与温度的关系如图所示:
的平衡转化率与温度的关系如图所示: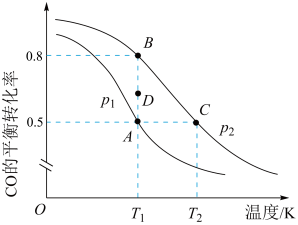
 两点压强大小关系是pA
两点压强大小关系是pA 、
、 、
、 ”)。
”)。②
 三点平衡常数
三点平衡常数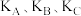 的大小关系为
的大小关系为 时,由D点到A点过程中正、逆反应速率之间的关系:v正
时,由D点到A点过程中正、逆反应速率之间的关系:v正 ”、“
”、“ ”或“
”或“ ”)。
”)。(3)完成下列问题。
①向某恒温恒压密闭容器中充入
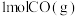 和
和 ,下列能说明反应III达到平衡的是
,下列能说明反应III达到平衡的是A.
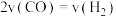
B.两种反应物转化率的比值不再改变
C.容器内混合气体的平均相对分子质量不再改变
D.容器内混合气体的密度不再改变
②在
 恒容密闭容器中充入
恒容密闭容器中充入 和
和 ,在
,在 和
和 条件下经
条件下经 达到平衡状态。在该条件下,v(H2)=
达到平衡状态。在该条件下,v(H2)=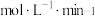 。
。(4)已知:
 的选择性
的选择性 ,不考虑催化剂活性温度,为同时提高
,不考虑催化剂活性温度,为同时提高 的平衡转化率和甲醇的选择性,应选择的反应条件是
的平衡转化率和甲醇的选择性,应选择的反应条件是A.低温低压 B.低温高压 C.高温高压 D.高温低压
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】我国煤炭资源丰富。以煤炭为原料可生产甲醇、二甲醚、丙烯等重要化工产品。
(1)煤的气化:
 ,反应能自发进行的条件是
,反应能自发进行的条件是___________ (填“高温”、“低温”或“任意温度)。
(2)制备甲醇:用CO合成甲醇( )的化学方程式为
)的化学方程式为
 。
。
①在一定条件下将2mol CO和6mol 充入2L的密闭容器中发生该反应,5min后测得
充入2L的密闭容器中发生该反应,5min后测得 ,则此段时间的反应速率(用
,则此段时间的反应速率(用 表示)为
表示)为_____  。
。
②该投料时,测得CO在不同温度下的平衡转化率与压强的关系如图。下列说法错误的是_____ 。
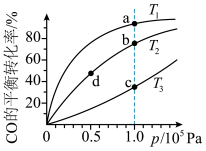
A.平均摩尔质量:M(a)>M(b)>M(d)>M(c) B.正反应速率:v(b)>v(d)
C.温度: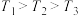 D.平衡常数:K(a)<K(b)=K(d)<K(c)
D.平衡常数:K(a)<K(b)=K(d)<K(c)
③若容器容积不变,可以使CO转化率增大的措施是_____ 。(任写两种)
(3)制备丙烯:气化产生的CO、 转化为二甲醚后,再转化为丙烯。主要反应为:
转化为二甲醚后,再转化为丙烯。主要反应为:
Ⅰ.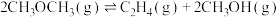
Ⅱ.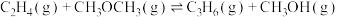
一定温度下,在体积为VL的密闭容器中投入2mol 发生反应,初始总压为
发生反应,初始总压为 ,平衡时测定
,平衡时测定 、
、 的物质的量分数
的物质的量分数 与温度(T)的关系如图
与温度(T)的关系如图 。
。
则温度为 时,容器内总压强为
时,容器内总压强为_______ ,此时反应Ⅱ的分压平衡常数
___________ 。(分压p=气体总压 ×物质的量分数)
×物质的量分数)
(4)制备乙醛:在 K、
K、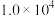 kPa下,等物质的量的CO与
kPa下,等物质的量的CO与 混合气体发生如下反应:
混合气体发生如下反应: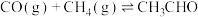
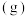 ,反应速率
,反应速率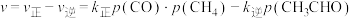 ,
, 、
、 分别为正、逆向反应速率常数,p为气体的分压。分压平衡常数
分别为正、逆向反应速率常数,p为气体的分压。分压平衡常数 ,则CO的转化率为20%时,
,则CO的转化率为20%时,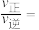
___________ 。
(1)煤的气化:

 ,反应能自发进行的条件是
,反应能自发进行的条件是(2)制备甲醇:用CO合成甲醇(
 )的化学方程式为
)的化学方程式为
 。
。①在一定条件下将2mol CO和6mol
 充入2L的密闭容器中发生该反应,5min后测得
充入2L的密闭容器中发生该反应,5min后测得 ,则此段时间的反应速率(用
,则此段时间的反应速率(用 表示)为
表示)为 。
。②该投料时,测得CO在不同温度下的平衡转化率与压强的关系如图。下列说法错误的是

A.平均摩尔质量:M(a)>M(b)>M(d)>M(c) B.正反应速率:v(b)>v(d)
C.温度:
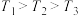 D.平衡常数:K(a)<K(b)=K(d)<K(c)
D.平衡常数:K(a)<K(b)=K(d)<K(c)③若容器容积不变,可以使CO转化率增大的措施是
(3)制备丙烯:气化产生的CO、
 转化为二甲醚后,再转化为丙烯。主要反应为:
转化为二甲醚后,再转化为丙烯。主要反应为:Ⅰ.
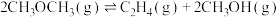
Ⅱ.
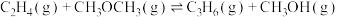
一定温度下,在体积为VL的密闭容器中投入2mol
 发生反应,初始总压为
发生反应,初始总压为 ,平衡时测定
,平衡时测定 、
、 的物质的量分数
的物质的量分数 与温度(T)的关系如图
与温度(T)的关系如图 。
。则温度为
 时,容器内总压强为
时,容器内总压强为
 ×物质的量分数)
×物质的量分数)(4)制备乙醛:在
 K、
K、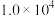 kPa下,等物质的量的CO与
kPa下,等物质的量的CO与 混合气体发生如下反应:
混合气体发生如下反应: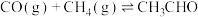
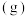 ,反应速率
,反应速率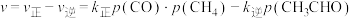 ,
, 、
、 分别为正、逆向反应速率常数,p为气体的分压。分压平衡常数
分别为正、逆向反应速率常数,p为气体的分压。分压平衡常数 ,则CO的转化率为20%时,
,则CO的转化率为20%时,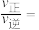
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】苯乙烯是用于生产苯乙烯系列树脂、丁苯橡胶、离子交换树脂及医药品的原料之一,可通过乙苯的分解制备。
(1)标准状态时,由指定单质生成 物质的焓变称为标准摩尔生成焓,如氨气的标准摩尔生成焓可用
物质的焓变称为标准摩尔生成焓,如氨气的标准摩尔生成焓可用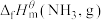 表示。规定
表示。规定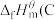 ,石墨
,石墨 和
和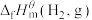 为0,利用标准摩尔生成焓可以求出化学反应热,已知相关物质的标准摩尔生成焓如下表:
为0,利用标准摩尔生成焓可以求出化学反应热,已知相关物质的标准摩尔生成焓如下表:
乙苯分解反应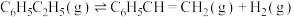 的
的
_______  ,该反应在
,该反应在___________ (填标号)下有利于自发进行。
a.高温 b.低温 c.任何温度
(2)向密闭容器中充入 气态乙苯发生反应
气态乙苯发生反应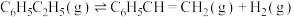 ,其平衡转化率随温度和压强变化的情况如图所示。
,其平衡转化率随温度和压强变化的情况如图所示。
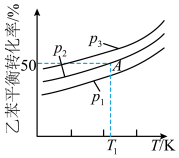
① 由大到小的顺序是
由大到小的顺序是___________ 。
②A点对应的条件下,H2的体积分数为___________ (保留三位有效数字)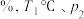 下,该反应的物质的量分数平衡常数[用平衡时各物质的物质的量分数(物质的量分数
下,该反应的物质的量分数平衡常数[用平衡时各物质的物质的量分数(物质的量分数 某组分的物质的量
某组分的物质的量 总物质的量)来代替各物质的平衡浓度,得到的平衡常数称为物质的量分数平衡常数]
总物质的量)来代替各物质的平衡浓度,得到的平衡常数称为物质的量分数平衡常数]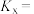
___________ ; 与压强平衡常数
与压强平衡常数 (以分压装示,分压=总压×物质的量分数,
(以分压装示,分压=总压×物质的量分数, 表示总压)的关系为
表示总压)的关系为
___________ (用含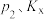 的式子表示)。
的式子表示)。
③向 点平衡体系中加入
点平衡体系中加入 可提高平衡转化率,欲将平衡转化率提高至
可提高平衡转化率,欲将平衡转化率提高至 ,需要向反应器中充入
,需要向反应器中充入___________ 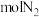 作为稀释气。
作为稀释气。
(1)标准状态时,由指定单质生成
 物质的焓变称为标准摩尔生成焓,如氨气的标准摩尔生成焓可用
物质的焓变称为标准摩尔生成焓,如氨气的标准摩尔生成焓可用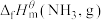 表示。规定
表示。规定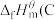 ,石墨
,石墨 和
和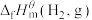 为0,利用标准摩尔生成焓可以求出化学反应热,已知相关物质的标准摩尔生成焓如下表:
为0,利用标准摩尔生成焓可以求出化学反应热,已知相关物质的标准摩尔生成焓如下表:| 物质 | 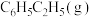 |  |
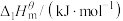 | +29.8 | +147.5 |
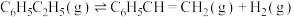 的
的
 ,该反应在
,该反应在a.高温 b.低温 c.任何温度
(2)向密闭容器中充入
 气态乙苯发生反应
气态乙苯发生反应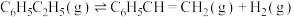 ,其平衡转化率随温度和压强变化的情况如图所示。
,其平衡转化率随温度和压强变化的情况如图所示。
①
 由大到小的顺序是
由大到小的顺序是②A点对应的条件下,H2的体积分数为
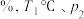 下,该反应的物质的量分数平衡常数[用平衡时各物质的物质的量分数(物质的量分数
下,该反应的物质的量分数平衡常数[用平衡时各物质的物质的量分数(物质的量分数 某组分的物质的量
某组分的物质的量 总物质的量)来代替各物质的平衡浓度,得到的平衡常数称为物质的量分数平衡常数]
总物质的量)来代替各物质的平衡浓度,得到的平衡常数称为物质的量分数平衡常数]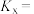
 与压强平衡常数
与压强平衡常数 (以分压装示,分压=总压×物质的量分数,
(以分压装示,分压=总压×物质的量分数, 表示总压)的关系为
表示总压)的关系为
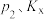 的式子表示)。
的式子表示)。③向
 点平衡体系中加入
点平衡体系中加入 可提高平衡转化率,欲将平衡转化率提高至
可提高平衡转化率,欲将平衡转化率提高至 ,需要向反应器中充入
,需要向反应器中充入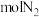 作为稀释气。
作为稀释气。
您最近一年使用:0次



