氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)以甲烷和 为原料制取氢气是工业上常用的制氢方法。
为原料制取氢气是工业上常用的制氢方法。
已知: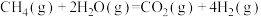

①甲烷与 制取氢气时,常向反应器中通入一定比例空气,其目的是
制取氢气时,常向反应器中通入一定比例空气,其目的是___________ 。
② 的热分解也可得到
的热分解也可得到 ,高温下水分解体系中各种微粒的体积分数与温度的关系如图所示。图中A、B表示的微粒依次是
,高温下水分解体系中各种微粒的体积分数与温度的关系如图所示。图中A、B表示的微粒依次是___________ 。 的电化学储氢(忽略其它有机物的反应)。
的电化学储氢(忽略其它有机物的反应)。 与
与 的相互转化实现
的相互转化实现 的储存与释放,其释放
的储存与释放,其释放 的一种机理如图-1所示,该过程中使用的
的一种机理如图-1所示,该过程中使用的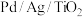 复合催化剂的结构及各部分所带电荷如图-2所示。
复合催化剂的结构及各部分所带电荷如图-2所示。___________ 。
②根据元素电负性的变化规律,步骤Ⅱ、Ⅲ可以描述为___________ ,1个氢氧键断裂后带正电的氢与催化剂表面带负电的Pd成键。
③70~80℃,利用相同的催化剂,调节压强能够实现上述释氢的逆转化,达到储氢的目的。从能源利用、环境保护和物质转化角度分析,该储氢与(2)中电化学储氢方法相比,其优点有___________ 。
(1)以甲烷和
 为原料制取氢气是工业上常用的制氢方法。
为原料制取氢气是工业上常用的制氢方法。已知:
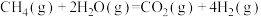

①甲烷与
 制取氢气时,常向反应器中通入一定比例空气,其目的是
制取氢气时,常向反应器中通入一定比例空气,其目的是②
 的热分解也可得到
的热分解也可得到 ,高温下水分解体系中各种微粒的体积分数与温度的关系如图所示。图中A、B表示的微粒依次是
,高温下水分解体系中各种微粒的体积分数与温度的关系如图所示。图中A、B表示的微粒依次是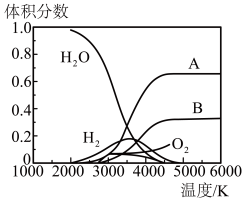
 的电化学储氢(忽略其它有机物的反应)。
的电化学储氢(忽略其它有机物的反应)。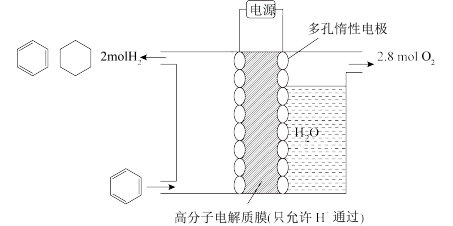
①写出由 生成
生成 的电极反应式:
的电极反应式:
②该装置的电流效率

 ×100%)
×100%)
 与
与 的相互转化实现
的相互转化实现 的储存与释放,其释放
的储存与释放,其释放 的一种机理如图-1所示,该过程中使用的
的一种机理如图-1所示,该过程中使用的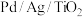 复合催化剂的结构及各部分所带电荷如图-2所示。
复合催化剂的结构及各部分所带电荷如图-2所示。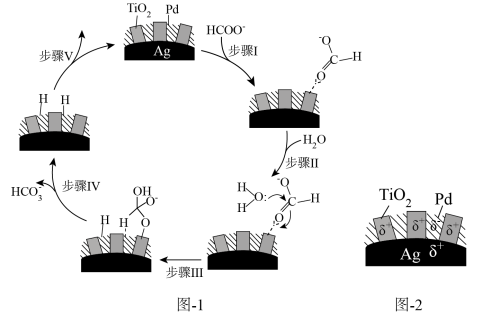
②根据元素电负性的变化规律,步骤Ⅱ、Ⅲ可以描述为
③70~80℃,利用相同的催化剂,调节压强能够实现上述释氢的逆转化,达到储氢的目的。从能源利用、环境保护和物质转化角度分析,该储氢与(2)中电化学储氢方法相比,其优点有
23-24高三上·江苏苏州·期中 查看更多[3]
更新时间:2023-11-13 23:58:05
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】我国高含硫天然气资源丰富,天然气脱硫和甲烷与硫化氢重整制氢具有重要的现实意义。回答下列问题:
(1)天然气脱硫工艺涉及如下反应:
H2S(g)+ O2(g)=SO2(g)+H2O(g) ΔH=akJ·mol-1
O2(g)=SO2(g)+H2O(g) ΔH=akJ·mol-1
2H2S(g)+SO2(g)= S2(g)+2H2O(g) ΔH=bkJ·mol-1
S2(g)+2H2O(g) ΔH=bkJ·mol-1
H2S(g)+ O2(g)=S(g)+H2O(g) ΔH=ckJ·mol-1
O2(g)=S(g)+H2O(g) ΔH=ckJ·mol-1
则2S(g)=S2(g) ΔH=___________ kJ·mol-l。
(2)甲烷与H2S重整制氢是一条全新的H2S转化与制氢技术路线。为了研究甲烷对H2S制氢的影响,理论计算表明,原料初始组成n(CH4):n(H2S)=1:2,在体系压强为0.1 MPa,反应CH4(g)+2H2S(g)→CS2(g)+4H2(g)达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示:___________ 、___________ 。反应达平衡的标志是___________ (填标号)。
A.2v正(H2S)=4v逆(H2) B.CH4的体积分数不再变化
C. 不再变化 D.混合气体的密度不再改变
不再变化 D.混合气体的密度不再改变
②由图可知该反应的ΔH___________ 0(填“>”“<”或“=”),判断的理由是___________ 。
③M点对应温度下,CH4的转化率为___________ ;950℃时该反应的Kp=___________ (MPa)2。
(3)H2S燃料电池的原理如图所示。电池的正极是___________ ,负极的电极反应式为___________ 。
(1)天然气脱硫工艺涉及如下反应:
H2S(g)+
 O2(g)=SO2(g)+H2O(g) ΔH=akJ·mol-1
O2(g)=SO2(g)+H2O(g) ΔH=akJ·mol-12H2S(g)+SO2(g)=
 S2(g)+2H2O(g) ΔH=bkJ·mol-1
S2(g)+2H2O(g) ΔH=bkJ·mol-1H2S(g)+
 O2(g)=S(g)+H2O(g) ΔH=ckJ·mol-1
O2(g)=S(g)+H2O(g) ΔH=ckJ·mol-1则2S(g)=S2(g) ΔH=
(2)甲烷与H2S重整制氢是一条全新的H2S转化与制氢技术路线。为了研究甲烷对H2S制氢的影响,理论计算表明,原料初始组成n(CH4):n(H2S)=1:2,在体系压强为0.1 MPa,反应CH4(g)+2H2S(g)→CS2(g)+4H2(g)达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示:

A.2v正(H2S)=4v逆(H2) B.CH4的体积分数不再变化
C.
 不再变化 D.混合气体的密度不再改变
不再变化 D.混合气体的密度不再改变②由图可知该反应的ΔH
③M点对应温度下,CH4的转化率为
(3)H2S燃料电池的原理如图所示。电池的正极是

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】任何化学反应都伴随着能量的变化,通过化学反应,化学能可以与热能、电能等不同形式的能量相互转化,用于生产、生活和科研。请回答下列问题:
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋利用_____ (填“放热”或“吸热”)的化学变化或物理变化的原理。
(2)世博会中国馆、主题馆等建筑所使用的光伏电池,总功率达4兆瓦,是历届世博会之最。光伏电池能将_____ 直接转变为电能(填:“化学能”“太阳能”“热能”等)
(3)氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过氨热分解法制氢气。相关化学键的键能数据
一定温度下,利用催化剂将 分解为
分解为 和3 mol
和3 mol  ,吸收90.8 kJ热量,则
,吸收90.8 kJ热量,则
_____ 。
(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“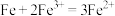 ”设计一个原电池,并在下面方框内画出简单原电池实验装置图,注明电极材料和电解质溶液
”设计一个原电池,并在下面方框内画出简单原电池实验装置图,注明电极材料和电解质溶液_____ 。______ (填“正”或“负”)极,其电极反应式为_____ 。
②电池工作过程中,若A极区产生14 g ,则转移的电子数目为
,则转移的电子数目为______ 。
③有人提出可用甲烷去替代肼,此时惰性电极A发生的电极反应式为______ 。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋利用
(2)世博会中国馆、主题馆等建筑所使用的光伏电池,总功率达4兆瓦,是历届世博会之最。光伏电池能将
(3)氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过氨热分解法制氢气。相关化学键的键能数据
| 化学键 |  |  |  |
键能E/(kJ·mol ) ) | 946.0 | a | 390.8 |
 分解为
分解为 和3 mol
和3 mol  ,吸收90.8 kJ热量,则
,吸收90.8 kJ热量,则
(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“
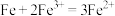 ”设计一个原电池,并在下面方框内画出简单原电池实验装置图,注明电极材料和电解质溶液
”设计一个原电池,并在下面方框内画出简单原电池实验装置图,注明电极材料和电解质溶液
②电池工作过程中,若A极区产生14 g
 ,则转移的电子数目为
,则转移的电子数目为③有人提出可用甲烷去替代肼,此时惰性电极A发生的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】化学反应是人类获取能量的重要途径,我们可以通过化学反应实现化学能向热能、电能的直接转化。氨气是一种重要的工业原料,可用于制取硝酸和肥料。
(1)已知:NH3(g)
 N2(g)+
N2(g)+ H2(g)ΔH=+46.2kJ · mol-1,则 N2(g)+3H2(g)
H2(g)ΔH=+46.2kJ · mol-1,则 N2(g)+3H2(g) 2NH3(g)ΔH=
2NH3(g)ΔH=___________ kJ·mol-1。
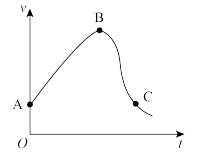
(2)在某恒容绝热容器中充入一定量的N2和H2,发生合成氨反应,化学反应速率随时间的变化关系如图所示,AB段化学反应速率增大的主要原因可能是___________ 。
①0~50s内的平均反应速率v(N2)=___________ mol·L-1·s-1,平衡时氢气的转化率为___________
②为加快反应速率,可采取的措施是___________ (填标号)。
a.升高温度 b.增大容器体积 c.加入合适的催化剂
(4)若将合成氨反应设计原电池(如图),则气体b是___________ (填化学式),电极2发生的电极反应为___________ 。
(1)已知:NH3(g)

 N2(g)+
N2(g)+ H2(g)ΔH=+46.2kJ · mol-1,则 N2(g)+3H2(g)
H2(g)ΔH=+46.2kJ · mol-1,则 N2(g)+3H2(g) 2NH3(g)ΔH=
2NH3(g)ΔH=(2)在某恒容绝热容器中充入一定量的N2和H2,发生合成氨反应,化学反应速率随时间的变化关系如图所示,AB段化学反应速率增大的主要原因可能是
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
②为加快反应速率,可采取的措施是
a.升高温度 b.增大容器体积 c.加入合适的催化剂
(4)若将合成氨反应设计原电池(如图),则气体b是
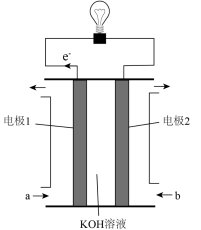
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌,以某硫化锌精矿(主要成分是ZnS,还含有少量FeS等其他成分)为原料冶炼锌的工艺流程如图所示:
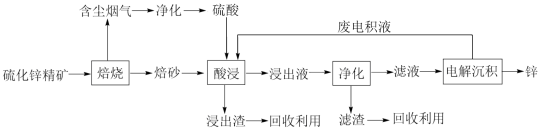
回答下列问题:
(1)“焙烧”过程在氧气气氛的沸腾炉中进行,“焙砂”中铁元素主要以Fe3O4形式存在,写出“焙烧”过程中FeS主要发生反应的化学方程式:_______ ;“含尘烟气”中的SO2可用氨水吸收,经循环利用后制取硫酸,用氨水吸收SO2至溶液的pH=5时,所得溶液中的 =
=_______ 。[已知:Ka1(H2SO3)=l。4×10-2;Ka2(H2SO3)=6.0×10-8]
(2)浸出液“净化”过程中加入的主要物质为锌粉,所得“滤渣”的成分为_______ (填化学式),分离“滤液”'“滤渣”的操作名称为_______ 。
(3)在该流程中可循环使用的物质是Zn和_______ (填化学式)。
(4)改进的锌冶炼工艺,采用了“氧压酸(稀硫酸)浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。
①下列设想的加快浸取反应速率的措施中不合理的是_______ (填标号)。
A.将稀硫酸更换为98%的浓硫酸
B.将硫化锌精矿粉碎
C.适当升高温度
②硫化锌精矿的主要成分ZnS遇到硫酸铜溶液可慢慢地转化为铜蓝(CuS):ZnS(s)+Cu2+(aq) CuS(s)+Zn2+(aq),该反应的平衡常数K=
CuS(s)+Zn2+(aq),该反应的平衡常数K=_______ 。[已知:Ksp(ZnS)=1.6×10-24,Ksp(CuS)=6.4×10-36]
(5)金属锌化学性质活泼,可用于多种化学电源的电极材料。一种3D打印机的柔性电池以碳纳米管作电极材料,以吸收了ZnSO4溶液的有机高聚物为固态电解质,电池总反应为MnO2+ Zn+(1+
Zn+(1+ )H2O+
)H2O+ ZnSO4
ZnSO4 MnOOH+
MnOOH+ [ZnSO4·3Zn(OH)2·xH2O]。放电时正极的电极反应式为
[ZnSO4·3Zn(OH)2·xH2O]。放电时正极的电极反应式为_______ 。

回答下列问题:
(1)“焙烧”过程在氧气气氛的沸腾炉中进行,“焙砂”中铁元素主要以Fe3O4形式存在,写出“焙烧”过程中FeS主要发生反应的化学方程式:
 =
=(2)浸出液“净化”过程中加入的主要物质为锌粉,所得“滤渣”的成分为
(3)在该流程中可循环使用的物质是Zn和
(4)改进的锌冶炼工艺,采用了“氧压酸(稀硫酸)浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。
①下列设想的加快浸取反应速率的措施中不合理的是
A.将稀硫酸更换为98%的浓硫酸
B.将硫化锌精矿粉碎
C.适当升高温度
②硫化锌精矿的主要成分ZnS遇到硫酸铜溶液可慢慢地转化为铜蓝(CuS):ZnS(s)+Cu2+(aq)
 CuS(s)+Zn2+(aq),该反应的平衡常数K=
CuS(s)+Zn2+(aq),该反应的平衡常数K=(5)金属锌化学性质活泼,可用于多种化学电源的电极材料。一种3D打印机的柔性电池以碳纳米管作电极材料,以吸收了ZnSO4溶液的有机高聚物为固态电解质,电池总反应为MnO2+
 Zn+(1+
Zn+(1+ )H2O+
)H2O+ ZnSO4
ZnSO4 MnOOH+
MnOOH+ [ZnSO4·3Zn(OH)2·xH2O]。放电时正极的电极反应式为
[ZnSO4·3Zn(OH)2·xH2O]。放电时正极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】 二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气相似,被誉为“21 世纪的清洁燃料”。制备原理如下:
(I)由天然气催化制备二甲醚:①2CH4(g)+O2(g) CH3OCH3(g)+H2O(g) △H1
CH3OCH3(g)+H2O(g) △H1
(II)由合成气制备二甲醚:②CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
③2CH3OH(g) CH3OCH3(g)+H2O(g) △H3
CH3OCH3(g)+H2O(g) △H3
回答下列问题:
(1)若甲醇与二甲醚的燃烧热分别是△H=-760.5 kJ/mol和△H=-1453.0 kJ/mol;1 mol 液态水变为气态水要吸收44.0 kJ的热量。则△H3=__________ kJ/ mol。
(2)一定温度下,在容积固定的密闭容器中按I制备二甲醚,下列情况能说明反应①达到平衡状态的是_________ (填序号)。
A.混合气体的密度保持不变
B. CH4与O2的物质的量之比保持不变
C.混合气体的平均相对分子质量保持不变
D. CH4的生成速率等于与CH3OCH3消耗速率的2倍
(3)在恒容密闭容器中按原理( I )制备二甲醚,若起始时c(CH4)= 0.20 mol/L,c(O2)= 0.10 mol/L,平衡时CH4的平衡转化率为50%,则平衡时CH3OCH3的体积分数为__________ 。
(4)工业上按原理(II)制备二甲醚时,反应②合成甲醇时常以Cu2O作催化剂。研究表明,反应体系中少量CO2有利于维持催化剂Cu2O的量不变,请结合平衡移动原理分析其原因是_______________________________________________________ (写出相关的化学方程式并辅以必要的文字说明)。
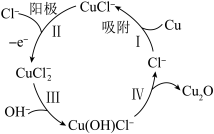
(5)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如图所示。则阳极的电极反应式为_____________ ;溶液中III、IV二步总反应的离子方程式为_________________________ 。
(6)有人模拟工业上按原理(II)制备二甲醚,在1000K时的2 L密闭容器中充入2 mol CO和6 mol H2,此时体系总压强是3.2×105kPa。达到平衡时c(H2)= 1.4 mo/L,c(CH3OCH3)=0.3 mol/L,则用平衡分压表示反应③的平衡常数Kp=_________ (分压=总压×物质的量分数)。
(I)由天然气催化制备二甲醚:①2CH4(g)+O2(g)
 CH3OCH3(g)+H2O(g) △H1
CH3OCH3(g)+H2O(g) △H1(II)由合成气制备二甲醚:②CO(g)+2H2(g)
 CH3OH(g) △H2
CH3OH(g) △H2③2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H3
CH3OCH3(g)+H2O(g) △H3回答下列问题:
(1)若甲醇与二甲醚的燃烧热分别是△H=-760.5 kJ/mol和△H=-1453.0 kJ/mol;1 mol 液态水变为气态水要吸收44.0 kJ的热量。则△H3=
(2)一定温度下,在容积固定的密闭容器中按I制备二甲醚,下列情况能说明反应①达到平衡状态的是
A.混合气体的密度保持不变
B. CH4与O2的物质的量之比保持不变
C.混合气体的平均相对分子质量保持不变
D. CH4的生成速率等于与CH3OCH3消耗速率的2倍
(3)在恒容密闭容器中按原理( I )制备二甲醚,若起始时c(CH4)= 0.20 mol/L,c(O2)= 0.10 mol/L,平衡时CH4的平衡转化率为50%,则平衡时CH3OCH3的体积分数为
(4)工业上按原理(II)制备二甲醚时,反应②合成甲醇时常以Cu2O作催化剂。研究表明,反应体系中少量CO2有利于维持催化剂Cu2O的量不变,请结合平衡移动原理分析其原因是
(5)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如图所示。则阳极的电极反应式为

(6)有人模拟工业上按原理(II)制备二甲醚,在1000K时的2 L密闭容器中充入2 mol CO和6 mol H2,此时体系总压强是3.2×105kPa。达到平衡时c(H2)= 1.4 mo/L,c(CH3OCH3)=0.3 mol/L,则用平衡分压表示反应③的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】研究二氧化碳的回收对我国2060年实现碳中和具有现实意义:
(1)以 与
与 为原料可合成尿素[
为原料可合成尿素[ ]回收
]回收 并为农业服务,
并为农业服务,
已知:反应I.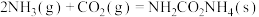
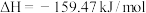
反应II.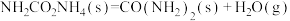
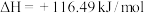
在相同条件下,反应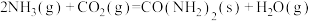 正反应的活化能
正反应的活化能 为8179kJ/mol,则逆反应的活化能
为8179kJ/mol,则逆反应的活化能 为
为_______ 。
(2)向一体积为1L的密闭容器中通入 和
和 发生反应:
发生反应:

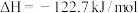 。
。 的平衡转化率与压强、温度及氢碳比m[
的平衡转化率与压强、温度及氢碳比m[ ]的关系分别如图a和图b所示。
]的关系分别如图a和图b所示。

图a中压强从大到小的顺序为_______ ,图b中氢碳比m从大到小的顺序为_______ 。
(3)工业上也可利用NaOH溶液捕获 。
。
①1L 1mol/L的NaOH溶液捕获标准状况下16.8L 所得溶液中,所有离子浓度由大到小的顺序为
所得溶液中,所有离子浓度由大到小的顺序为_______ 。
②若所得溶液中 ,溶液pH=
,溶液pH=_______ 。(室温下, 的
的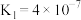 ;
;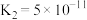 )
)
(4)工业上也可以用电解法捕获 ,如图,
,如图, 在酸性水溶液中用惰性电极电解制得乙烯,其原理如图所示,则b电极上的电极反应为
在酸性水溶液中用惰性电极电解制得乙烯,其原理如图所示,则b电极上的电极反应为_______ 。

(1)以
 与
与 为原料可合成尿素[
为原料可合成尿素[ ]回收
]回收 并为农业服务,
并为农业服务,已知:反应I.
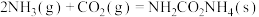
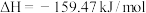
反应II.
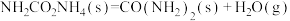
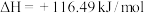
在相同条件下,反应
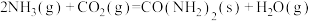 正反应的活化能
正反应的活化能 为8179kJ/mol,则逆反应的活化能
为8179kJ/mol,则逆反应的活化能 为
为(2)向一体积为1L的密闭容器中通入
 和
和 发生反应:
发生反应:

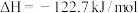 。
。 的平衡转化率与压强、温度及氢碳比m[
的平衡转化率与压强、温度及氢碳比m[ ]的关系分别如图a和图b所示。
]的关系分别如图a和图b所示。
图a中压强从大到小的顺序为
(3)工业上也可利用NaOH溶液捕获
 。
。①1L 1mol/L的NaOH溶液捕获标准状况下16.8L
 所得溶液中,所有离子浓度由大到小的顺序为
所得溶液中,所有离子浓度由大到小的顺序为②若所得溶液中
 ,溶液pH=
,溶液pH= 的
的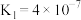 ;
;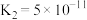 )
)(4)工业上也可以用电解法捕获
 ,如图,
,如图, 在酸性水溶液中用惰性电极电解制得乙烯,其原理如图所示,则b电极上的电极反应为
在酸性水溶液中用惰性电极电解制得乙烯,其原理如图所示,则b电极上的电极反应为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
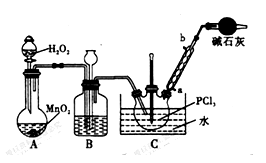
【推荐1】POC13常用作半导体掺杂剂及光导纤维原料,实验室制备POC13并测定产品含量的实验过程如下:
I.实验室制备POC13。
采用氧气氧化液态PCl3法制取POC13,实验装置(加热及夹持仪器略)如图:
资料:①Ag+SCN-==AgSCN↓:Ksp(AgCl)>Ksp(AgSCN);
②PCl3和POC13的相关信息如下表:
(1)B中所盛的试剂是________ ,干燥管的作用是_____________________ 。
(2)POC13遇水反应的化学方程式为____________________________ 。
(3)装置B的作用除干燥O2外,还有_____________________________ 。
(4)反应温度要控制在60~65℃,原因是:____________________________ 。
II.测定POC13产品的含量。
实验步骤:
①制备POC13实验结束后,待三颈瓶中的液体冷却至室温,准确称取30.7g POC13产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100. 00 mL溶液。
②取10. 00 mL溶液于锥形瓶中,加入10.00 mL 3.2mol/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2 mol/L KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去l0.00 mLKSCN溶液。
(5)步骤③中加入硝基苯的作用是__________________________ 。
(6)步骤④中X为____________________ 。
(7)反应中POC13的百分含量为_________ ,通过__________ (填操作)可以提高产品的纯度。
I.实验室制备POC13。
采用氧气氧化液态PCl3法制取POC13,实验装置(加热及夹持仪器略)如图:

资料:①Ag+SCN-==AgSCN↓:Ksp(AgCl)>Ksp(AgSCN);
②PCl3和POC13的相关信息如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
| POC13 | 2.0 | 106.0 | 153.5 |
(2)POC13遇水反应的化学方程式为
(3)装置B的作用除干燥O2外,还有
(4)反应温度要控制在60~65℃,原因是:
II.测定POC13产品的含量。
实验步骤:
①制备POC13实验结束后,待三颈瓶中的液体冷却至室温,准确称取30.7g POC13产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100. 00 mL溶液。
②取10. 00 mL溶液于锥形瓶中,加入10.00 mL 3.2mol/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2 mol/L KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去l0.00 mLKSCN溶液。
(5)步骤③中加入硝基苯的作用是
(6)步骤④中X为
(7)反应中POC13的百分含量为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
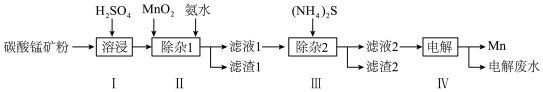
解题方法
【推荐2】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴的碳酸盐及SiO2杂质)为原 料生产金属锰的工艺流程如下:
料生产金属锰的工艺流程如下:
已知25℃时,部分物质的溶度积常数如下:
(1)步骤I中,为加快溶浸速率,可采取的措施是__________ (至少答两条)。
(2)步骤II中,加氨水调节溶液的pH为5.0~6.0,则滤渣1的成分主要为________ (填化学式);已知MnO2的作用为氧化剂,“除杂1”中涉及的离子方程式为NH3·H2O+H+=NH4++H2O、_____________ 、___________ 。
(3)步骤中,所加(NH4)2S的浓度不宜过大的原因是______________ 。
(4)滤液2中,c(Co2+):c(Ni2+)=____________ 。
 料生产金属锰的工艺流程如下:
料生产金属锰的工艺流程如下:
已知25℃时,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | Fe(OH)3 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.1×10-36 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤I中,为加快溶浸速率,可采取的措施是
(2)步骤II中,加氨水调节溶液的pH为5.0~6.0,则滤渣1的成分主要为
(3)步骤中,所加(NH4)2S的浓度不宜过大的原因是
(4)滤液2中,c(Co2+):c(Ni2+)=
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如图所示。

部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
(1)浸出过程中加入Na2SO3的目的是___ 。
(2)写出加入NaClO3后发生反应的离子方程式__ ,检验离子是否反应完全的试剂是__ (写试剂名称)。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。
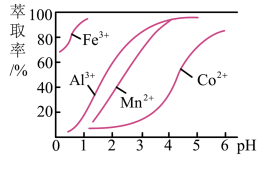
滤液Ⅱ中加入萃取剂的作用是___ ,使用萃取剂适宜的pH是___ (填序号)。
A.接近2.0 B.接近3.0 C.接近5.0
(4)除“钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液中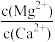 =
=__ 。
(5)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离常数Kb=1.8×10-5,H2SO3的电离常数Ka1=1.2×10-2,Ka2=1.3×10-8。在通入废气的过程中:当恰好形成正盐时,溶液中离子浓度的大小关系为__ ,当恰好形成酸式盐时,加入少量NaOH溶液,反应的离子方程式为__ 。

部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 金属离子 | Fe3+ | Fe2+ | Co2+ | Al3+ | Mn2+ |
| 沉淀完全的pH | 2.8 | 8.3 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是
(2)写出加入NaClO3后发生反应的离子方程式
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。

滤液Ⅱ中加入萃取剂的作用是
A.接近2.0 B.接近3.0 C.接近5.0
(4)除“钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液中
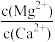 =
=(5)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离常数Kb=1.8×10-5,H2SO3的电离常数Ka1=1.2×10-2,Ka2=1.3×10-8。在通入废气的过程中:当恰好形成正盐时,溶液中离子浓度的大小关系为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O):
CO(NH2)2+2NaOH+NaClO===Na2CO3+N2H4·H2O+NaCl
实验一:制备NaClO溶液(实验装置如图所示)
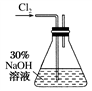
(1)配制 30% NaOH溶液时,所需的玻璃仪器除量筒外,还有________ (填标号)。
A.容量瓶
B.烧杯
C.烧瓶
D.玻璃棒
(2)锥形瓶中发生反应的化学方程式是____________________________________ 。
(3)因后续实验需要,需利用中和滴定原理测定反应后锥形瓶内混合溶液中NaOH的浓度。请选用所提供的试剂,设计实验方案:_____________________________________________________ 。
提供的试剂:H2O2溶液、FeCl2溶液、0.100 0 mol·L-1盐酸、酚酞试液
实验二:制取水合肼(实验装置如图所示)。
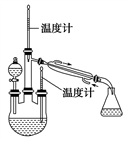
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114 ℃馏分。(已知:N2H4·H2O+2NaClO===N2↑+3H2O+2NaCl)
(4)分液漏斗中的溶液是________ (填标号)。
A.CO(NH2)2溶液
B.NaOH和NaClO混合溶液
选择的理由是____________________________________________ 。
实验三:测定馏分中水合肼的含量。
称取馏分5.000 g,加入适量NaHCO3固体,加水配成250 mL溶液,移取25.00 mL,用0.100 0 mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。
(已知:N2H4·H2O+2I2===N2↑+4HI+H2O)
(5)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是_________________________ 。
(6)实验测得消耗I2溶液的平均值为18.00 mL,馏分中水合肼(N2H4·H2O)的质量分数为________ 。
CO(NH2)2+2NaOH+NaClO===Na2CO3+N2H4·H2O+NaCl
实验一:制备NaClO溶液(实验装置如图所示)

(1)配制 30% NaOH溶液时,所需的玻璃仪器除量筒外,还有
A.容量瓶
B.烧杯
C.烧瓶
D.玻璃棒
(2)锥形瓶中发生反应的化学方程式是
(3)因后续实验需要,需利用中和滴定原理测定反应后锥形瓶内混合溶液中NaOH的浓度。请选用所提供的试剂,设计实验方案:
提供的试剂:H2O2溶液、FeCl2溶液、0.100 0 mol·L-1盐酸、酚酞试液
实验二:制取水合肼(实验装置如图所示)。

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114 ℃馏分。(已知:N2H4·H2O+2NaClO===N2↑+3H2O+2NaCl)
(4)分液漏斗中的溶液是
A.CO(NH2)2溶液
B.NaOH和NaClO混合溶液
选择的理由是
实验三:测定馏分中水合肼的含量。
称取馏分5.000 g,加入适量NaHCO3固体,加水配成250 mL溶液,移取25.00 mL,用0.100 0 mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。
(已知:N2H4·H2O+2I2===N2↑+4HI+H2O)
(5)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是
(6)实验测得消耗I2溶液的平均值为18.00 mL,馏分中水合肼(N2H4·H2O)的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】活性炭载钯(Pd/C)催化剂被广泛应用于医药和化工行业,某废钯催化剂(钯碳)的杂质主要含炭、有机物及少量Fe、Zn等。如图是利用钯碳制备氧化钯( )和Pd的流程。
)和Pd的流程。______ (填仪器名称)中模拟“焚烧”过程。 为二元弱碱,常温下
为二元弱碱,常温下 的电离常数
的电离常数 、
、 ,则常温下0.1mol/L
,则常温下0.1mol/L  水溶液pH=
水溶液pH=______ 。
(2)“溶浸”步骤中钯与王水发生反应生成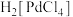 和一种有毒的无色气体A,A为
和一种有毒的无色气体A,A为______ (填化学式),钯的浸出率与反应的时间、温度的关系如图所示,则最佳的浸取时间和温度为______ ,写出“除锌铁”步骤中钯的化合物与试剂Ⅰ反应的化学方程式______ 。______ (填名称),加入该试剂的目的是______ 。
(4)海绵钯具有优良的储氢功能。假设海绵钯的密度为 ,其吸附的氢气是其体积的n倍(标准状况),则此条件下,氢气的浓度
,其吸附的氢气是其体积的n倍(标准状况),则此条件下,氢气的浓度
______ mol(氢气的浓度r为1mol Pd吸附氢气的物质的量,用含 、n的分数式表示)。
、n的分数式表示)。
 )和Pd的流程。
)和Pd的流程。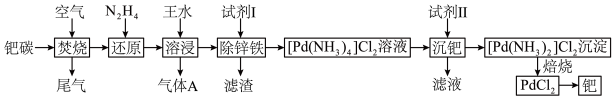
 为二元弱碱,常温下
为二元弱碱,常温下 的电离常数
的电离常数 、
、 ,则常温下0.1mol/L
,则常温下0.1mol/L  水溶液pH=
水溶液pH=(2)“溶浸”步骤中钯与王水发生反应生成
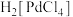 和一种有毒的无色气体A,A为
和一种有毒的无色气体A,A为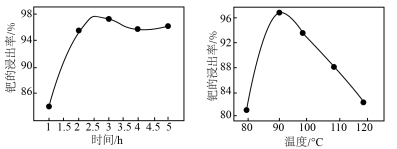
(4)海绵钯具有优良的储氢功能。假设海绵钯的密度为
 ,其吸附的氢气是其体积的n倍(标准状况),则此条件下,氢气的浓度
,其吸附的氢气是其体积的n倍(标准状况),则此条件下,氢气的浓度
 、n的分数式表示)。
、n的分数式表示)。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
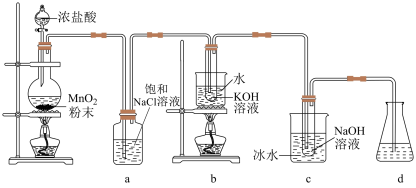
【推荐3】氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域,实验室中利用如图装置(部分装置省略)制备 和NaClO,并探究其氧化还原性质。
和NaClO,并探究其氧化还原性质。
已知:温度会影响 与碱反应氧化产物的价态。
与碱反应氧化产物的价态。
回答下列问题:
(1)发生装置中添加浓盐酸的仪器名称是___________ ,装置a的作用是___________ 。
(2)写出b中试管内反应的化学方程式___________ 。
(3)装置c采用冰水浴冷却的目的是___________ 。
(4)反应结束后,取出b中试管,经蒸发浓缩,___________ ,___________ ,少量冷水洗涤,干燥,得到 晶体。
晶体。
(5)设计实验探究 和NaClO氧化性强弱。实验方案如下,完成下列表格。
和NaClO氧化性强弱。实验方案如下,完成下列表格。
因此, 的氧化能力
的氧化能力___________ (填“大于”或“小于”)NaClO的氧化能力。
(6) 是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得:
是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得: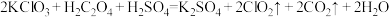 。
。
①请在答题卡上用单线桥表示该反应中电子转移的方向和数目:___________
②“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。
的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。 的有效氯含量为
的有效氯含量为___________ 。(计算结果保留两位小数)
 和NaClO,并探究其氧化还原性质。
和NaClO,并探究其氧化还原性质。
已知:温度会影响
 与碱反应氧化产物的价态。
与碱反应氧化产物的价态。回答下列问题:
(1)发生装置中添加浓盐酸的仪器名称是
(2)写出b中试管内反应的化学方程式
(3)装置c采用冰水浴冷却的目的是
(4)反应结束后,取出b中试管,经蒸发浓缩,
 晶体。
晶体。(5)设计实验探究
 和NaClO氧化性强弱。实验方案如下,完成下列表格。
和NaClO氧化性强弱。实验方案如下,完成下列表格。| 实验操作 | 现象 | |
| Ⅰ | 取  溶液,振荡。 溶液,振荡。 | 无明显变化 |
| Ⅱ | 取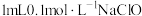 溶液于2号试管中, 溶液于2号试管中, | 出现红褐色沉淀 |
 的氧化能力
的氧化能力(6)
 是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得:
是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得: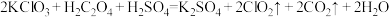 。
。①请在答题卡上用单线桥表示该反应中电子转移的方向和数目:
②“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。
的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。 的有效氯含量为
的有效氯含量为
您最近一年使用:0次



