下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:

(1)元素p为26号元素,请写出其基态原子的电子排布式___________ ,该元素的价电子排布图___________ 。
(2)d与a的单质反应生成的产物分子中,中心原子的杂化形式为___________ ,分子空间构型为___________ 。d、e元素分别形成的两种简单氢化物中键角较大的是___________ ,原因是___________ 。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:___________ 。
(4)o、p两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此你的解释是___________ 。
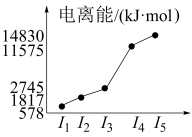
(5)表中所列的某主族元素的电离能情况如图所示,则该元素是___________ (填元素符号)。

(1)元素p为26号元素,请写出其基态原子的电子排布式
(2)d与a的单质反应生成的产物分子中,中心原子的杂化形式为
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:
(4)o、p两元素的部分电离能数据列于下表:
| 元素 | o | p | |
电离能 |  | 717 | 759 |
 | 1509 | 1561 | |
 | 3248 | 2957 | |
(5)表中所列的某主族元素的电离能情况如图所示,则该元素是

更新时间:2023-10-03 21:49:00
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】X、Y、Z、W、P、Q是元素周期表前四周期的六种常见元素,原子序数依次增大。X在自然界中有多种同素异形体,其中一种是自然界中最硬的单质;Z是地壳中含量最多的元素;W基态原子核外的9个原子轨道上填充了电子,且有1个未成对电子;P是常见的金属元素,其单质能与盐酸反应,不与碱反应,它的某种氧化物可用作红色颜料;Q基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。回答以下问题:
(1)P、Q中位于周期表的d区的是__________ (填元素符号,下同),基态Q原子的价层电子排布式为__________ ;元素X、Y、Z中,电负性最大的是__________ 。
(2)烃 的1个分子中含有
的1个分子中含有__________ 个σ键;X和Y的简单氢化物中沸点更高的是__________ (填化学式),理由是__________ (答2点)。
(3)化合物 可用作杀菌消毒剂和漂白剂,
可用作杀菌消毒剂和漂白剂, 分子的中心原子杂化类型是
分子的中心原子杂化类型是__________ ;工业上可用W的单质与潮湿的碳酸钠反应制取 ,并生成另外两种含钠的化合物,反应中无其它气体生成,写出该反应的化学方程式
,并生成另外两种含钠的化合物,反应中无其它气体生成,写出该反应的化学方程式__________ 。
(1)P、Q中位于周期表的d区的是
(2)烃
 的1个分子中含有
的1个分子中含有(3)化合物
 可用作杀菌消毒剂和漂白剂,
可用作杀菌消毒剂和漂白剂, 分子的中心原子杂化类型是
分子的中心原子杂化类型是 ,并生成另外两种含钠的化合物,反应中无其它气体生成,写出该反应的化学方程式
,并生成另外两种含钠的化合物,反应中无其它气体生成,写出该反应的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】柠檬酸亚铁(FeC6H6O7)是一种易被人体吸收的高效铁制剂,医疗上可以用来治疗缺铁性贫血。某课题组以硫铁矿烧渣(含Fe2O3、SiO2、少量Al2O3等)为原料,先制备碳酸亚铁,再与柠檬酸反应可以制得柠檬酸亚铁。其工艺流程如下:

已知:相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
(1)基态Fe2+的核外电子排布式为_______ 。
(2)“浸泡”时加入过量硫酸的目的:_______ 。
(3)“除杂”时有同学提出下列两种途径,请选择较合理的途径并说明理由_______ 。
途径一:
途径二:
(4)“制备FeCO3”时,Na2CO3溶液的浓度对沉淀中铁元素的质量分数以及FeCO3产率的影响如图:
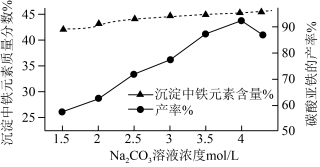
Na2CO3溶液的浓度大于4mol/L时,FeCO3的产率有所下降,而沉淀中铁元素质量分数仍在上升的原因是_______ 。
(5)已知柠檬酸亚铁易被氧化,能溶于水,不溶于乙醇。设计试验方案,从“除杂”后的FeSO4溶液制备柠檬酸亚铁晶体:_______ ,静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。(必须用到的试剂有:Fe粉、4mol/LNa2CO3溶液、柠檬酸溶液、无水乙醇)
(6)产品纯度的测定。产品中铁的含量用 EDTA 配位滴定法测定:称取0.4000g产品中加入足量H2O2溶液和适量的稀H2SO4,充分反应后再用0.0600mol·L-1EDTA溶液滴定至终点(其他离子对滴定过程无干扰),消耗EDTA溶液的体积为20.00mL(已知:EDTA与Fe3+的滴定比例为1:1,柠檬酸亚铁的摩尔质量为246g/mol)。计算产品的纯度为_______ 。
(7)上述滴定过程中,导致测定结果偏大的是_______ 。
a.滴定前,盛装EDTA的酸式滴定管未润洗
b.滴定时,酸式滴定管中开始有气泡,后来无气泡
c.滴定开始时平视,滴定结束时俯视

已知:相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
金属离子 | 沉淀开始pH | 沉淀完全pH |
Al3+ | 3.1 | 5.1 |
Fe2+ | 5.9 | 6.9 |
Fe3+ | 1.2 | 3.2 |
(1)基态Fe2+的核外电子排布式为
(2)“浸泡”时加入过量硫酸的目的:
(3)“除杂”时有同学提出下列两种途径,请选择较合理的途径并说明理由
途径一:

途径二:

(4)“制备FeCO3”时,Na2CO3溶液的浓度对沉淀中铁元素的质量分数以及FeCO3产率的影响如图:

Na2CO3溶液的浓度大于4mol/L时,FeCO3的产率有所下降,而沉淀中铁元素质量分数仍在上升的原因是
(5)已知柠檬酸亚铁易被氧化,能溶于水,不溶于乙醇。设计试验方案,从“除杂”后的FeSO4溶液制备柠檬酸亚铁晶体:
(6)产品纯度的测定。产品中铁的含量用 EDTA 配位滴定法测定:称取0.4000g产品中加入足量H2O2溶液和适量的稀H2SO4,充分反应后再用0.0600mol·L-1EDTA溶液滴定至终点(其他离子对滴定过程无干扰),消耗EDTA溶液的体积为20.00mL(已知:EDTA与Fe3+的滴定比例为1:1,柠檬酸亚铁的摩尔质量为246g/mol)。计算产品的纯度为
(7)上述滴定过程中,导致测定结果偏大的是
a.滴定前,盛装EDTA的酸式滴定管未润洗
b.滴定时,酸式滴定管中开始有气泡,后来无气泡
c.滴定开始时平视,滴定结束时俯视
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】在铜、银催化下,乙烯与氧气反应生成环氧乙烷( )和乙醛,下图是该反应的部分历程。
)和乙醛,下图是该反应的部分历程。

(2)鉴别以上产物乙醛和环氧乙烷可以用___________。
| A.原子发射光谱 | B.原子吸收光谱 | C.核磁共振氢谱 | D.红外光谱 |
(3)以下电子排布式和价电子轨道表示式中,正确且对应微粒为基态原子的是___________。
A.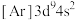 | B.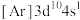 |
C. | D.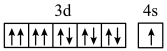 |
(4)已知
 的熔点为1235℃,
的熔点为1235℃, 的熔点为1130℃,二者晶体结构类似,且熔点都较高,但
的熔点为1130℃,二者晶体结构类似,且熔点都较高,但 熔点比
熔点比 高,其原因是
高,其原因是(5)
 晶胞结构如图所示,其中
晶胞结构如图所示,其中 代表的原子是
代表的原子是 ,晶胞参数为a pm,则阿伏加德罗常数值
,晶胞参数为a pm,则阿伏加德罗常数值
 和a的代数式表示)
和a的代数式表示)
 可以形成一种配位化合物,其结构如下图所示。以下说法正确的是___________。
可以形成一种配位化合物,其结构如下图所示。以下说法正确的是___________。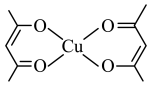
A. 的配位数是2 的配位数是2 |
| B.此配合物中存在配位键、极性键、非极性键 |
| C.配体中O原子提供空轨道 |
D. 提供孤电子对 提供孤电子对 |
(7)已知:常温下,①
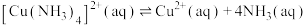
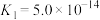 ;
;②


则常温下
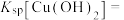
您最近一年使用:0次
【推荐1】X、Y、Z、M、Q、R是元素周期表前四周期元素,且原子序数依次增大,其相关信息如表:
请用化学用语填空:
(1)请写出Q元素基态原子的外围电子排布图:____ 。
(2)X、Y、Z、M四种元素的原子半径由小到大的顺序是____ (用元素符号表示)。
(3)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是___ 。
(4)含Z元素的焰火显黄色,主要与____ 有关。
(5)M元素原子的逐级电离能越来越大的原因是____ 。
(6)与M元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物的水化物反应的化学方程式:____ ;已知T元素和Q元素的电负性分别为1.5和3.0,则它们形成的化合物是____ (填“离子化合物”或“共价化合物”)。
| 元素 | 相关信息 |
| X | 原子核外有6种不同运动状态的电子 |
| Y | 基态原子中s电子总数与p电子总数相等 |
| Z | 原子半径在同周期元素中最大 |
| M | 逐级电离能(kJ·mol-1)依次为578、1817、2745、11575、14830、18376 |
| Q | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
| R | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
(1)请写出Q元素基态原子的外围电子排布图:
(2)X、Y、Z、M四种元素的原子半径由小到大的顺序是
(3)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是
(4)含Z元素的焰火显黄色,主要与
(5)M元素原子的逐级电离能越来越大的原因是
(6)与M元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物的水化物反应的化学方程式:
您最近一年使用:0次
【推荐2】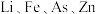 等均为重要的合金材料,回答下列问题:
等均为重要的合金材料,回答下列问题:
(1)Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因是_______ 。
(2) 和
和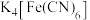 常用于检验
常用于检验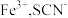 的空间结构为
的空间结构为_______ ,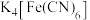 中所含元素第一电离能由大到小的顺序为
中所含元素第一电离能由大到小的顺序为_______ 。 与
与 既在同一周期,又在同一族,
既在同一周期,又在同一族, 通常易形成六配位的配合物,已知
通常易形成六配位的配合物,已知 有多种结构,若取
有多种结构,若取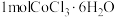 溶于水后滴加足量的硝酸银溶液,能够形成
溶于水后滴加足量的硝酸银溶液,能够形成 沉淀,则
沉淀,则 中配离子为
中配离子为_______ 。
(3) 的酸性弱于
的酸性弱于 的原因为
的原因为_______ 。含砷有机物“对氨基苯砷酸”的结构简式如图,As原子杂化轨道类型为_______ 。

(4)锌和镉位于同族,而锌与铜相邻。现有3种铜、锌元素的相应状态,①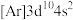 、②
、②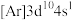 、③
、③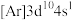 。失去1个电子需要的能量由大到小排序是
。失去1个电子需要的能量由大到小排序是_______ (填字母)。
A.②①③ B.②③① C.①②③ D.①③②
若Zn基态原子次外层1个d电子激发进入最外层的np能级,则该激发态原子的价电子排布式为_______ 。
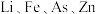 等均为重要的合金材料,回答下列问题:
等均为重要的合金材料,回答下列问题:(1)Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因是
(2)
 和
和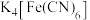 常用于检验
常用于检验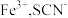 的空间结构为
的空间结构为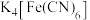 中所含元素第一电离能由大到小的顺序为
中所含元素第一电离能由大到小的顺序为 与
与 既在同一周期,又在同一族,
既在同一周期,又在同一族, 通常易形成六配位的配合物,已知
通常易形成六配位的配合物,已知 有多种结构,若取
有多种结构,若取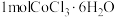 溶于水后滴加足量的硝酸银溶液,能够形成
溶于水后滴加足量的硝酸银溶液,能够形成 沉淀,则
沉淀,则 中配离子为
中配离子为(3)
 的酸性弱于
的酸性弱于 的原因为
的原因为
(4)锌和镉位于同族,而锌与铜相邻。现有3种铜、锌元素的相应状态,①
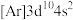 、②
、②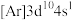 、③
、③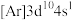 。失去1个电子需要的能量由大到小排序是
。失去1个电子需要的能量由大到小排序是A.②①③ B.②③① C.①②③ D.①③②
若Zn基态原子次外层1个d电子激发进入最外层的np能级,则该激发态原子的价电子排布式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)基态镍原子的核外电子排布式为___________ 。
(2)很多不饱和有机物在Ni催化下可与H2发生加成反应,如:① ②
② ③
③ ④HCHO,其中碳原子的杂化轨道类型为sp2杂化的分子有
④HCHO,其中碳原子的杂化轨道类型为sp2杂化的分子有___________ (填物质序号)。
(3) 中阴离子的立体构型是
中阴离子的立体构型是___________ 。比较氨气(NH3)的沸点与膦(PH3),理由是___________ 。
(4)某镍白铜合金的立方晶胞结构如图所示,请回答:

①晶胞中镍原子的堆积模型名称是___________ 。
②元素铜与镍的第二电离能分别为 ,
,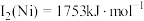 ,
, 的原因是
的原因是___________ 。
③若合金的密度为 ,晶胞参数(即棱长)a=
,晶胞参数(即棱长)a=___________ nm。(用NA表示阿伏加德罗常数的值)
(1)基态镍原子的核外电子排布式为
(2)很多不饱和有机物在Ni催化下可与H2发生加成反应,如:①
 ②
② ③
③ ④HCHO,其中碳原子的杂化轨道类型为sp2杂化的分子有
④HCHO,其中碳原子的杂化轨道类型为sp2杂化的分子有(3)
 中阴离子的立体构型是
中阴离子的立体构型是(4)某镍白铜合金的立方晶胞结构如图所示,请回答:

①晶胞中镍原子的堆积模型名称是
②元素铜与镍的第二电离能分别为
 ,
,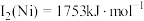 ,
, 的原因是
的原因是③若合金的密度为
 ,晶胞参数(即棱长)a=
,晶胞参数(即棱长)a=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题:
(1)甲烷在一定条件下可生成以下微粒:
A.碳正离子(CH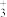 ) B.碳负离子(CH
) B.碳负离子(CH ) C. 甲基 (—CH3) D.碳烯 (
) C. 甲基 (—CH3) D.碳烯 ( CH2)
CH2)
①四种微粒中,键角为120°的是___________ (填序号)。
②碳负离子(CH )的空间构型为
)的空间构型为___________ ,与(CH )互为等电子体的一种分子是
)互为等电子体的一种分子是___________ (填化学式)。
(2)在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学方程式为(HAc表示醋酸)Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac.请回答下列问题:
①该反应中含有的第二周期非金属元素的第一电离能由大到小的顺序为___________ 。
②在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中碳原子轨道的杂化类型为___________ ;1 mol尿素分子中,σ 键的数目为___________ 。
③Cu与O形成的某种化合物的晶胞结构如下图所示,若阿伏加德罗常数的值为NA,晶胞的边长为a pm,则该晶体的密度为___________ g·cm-3。
(1)甲烷在一定条件下可生成以下微粒:
A.碳正离子(CH
 ) B.碳负离子(CH
) B.碳负离子(CH ) C. 甲基 (—CH3) D.碳烯 (
) C. 甲基 (—CH3) D.碳烯 ( CH2)
CH2)①四种微粒中,键角为120°的是
②碳负离子(CH
 )的空间构型为
)的空间构型为 )互为等电子体的一种分子是
)互为等电子体的一种分子是(2)在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学方程式为(HAc表示醋酸)Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac.请回答下列问题:
①该反应中含有的第二周期非金属元素的第一电离能由大到小的顺序为
②在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中碳原子轨道的杂化类型为
③Cu与O形成的某种化合物的晶胞结构如下图所示,若阿伏加德罗常数的值为NA,晶胞的边长为a pm,则该晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是_____ ;

原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为_____ ;
Se原子序数为_____ ,其核外M层电子的排布式为_____ ;
 离子的立体构型为
离子的立体构型为_____ ;
ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0pm,密度为_____ g·cm-3(列式并计算)。
(2)
(1)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是

原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为
Se原子序数为
 离子的立体构型为
离子的立体构型为ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0pm,密度为
(2)

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】现有A、B、C、D、E五种元素,他们性质如下:
请回答如下问题:
(1)E原子有___________ 个未成对电子,二价E离子的电子排布式为___________ 。
(2)A2D分子中D原子的杂化类型是___________ ,D的氧化物DO3分子空间构型为___________ 。
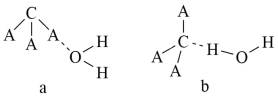
(3)CA3极易溶于水,其原因主要是___________ ,试判断CA3溶于水后,形成CA3·H2O的合理结构:___________ (填“a”或“b”),推理依据是___________ (用相关方程式表示)。
(4)在ESO4溶液中滴入过量氨水,E2+形成深蓝色配合物的离子方程式为:___________ 。
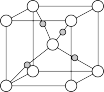
(5)ZnD的晶胞结构如图1所示,在ZnD晶胞中,D2-的配位数为___________ 。

(6)E与金形成的金属互化物结构如图2所示,其晶胞边长为a nm,该金属互化物的密度为___________ (用含a、NA的代数式表示)g·cm-3。

| A | 周期表中原子半径最小的元素 |
| B | 电负性最大的元素 |
| C | C的2p轨道中有三个未成对的单电子 |
| D | 原子核外电子数是B与C核外电子数之和 |
| E | E能形成红色(或砖红色) E2O和黑色的EO两种氧化物 |
(1)E原子有
(2)A2D分子中D原子的杂化类型是
(3)CA3极易溶于水,其原因主要是

(4)在ESO4溶液中滴入过量氨水,E2+形成深蓝色配合物的离子方程式为:
(5)ZnD的晶胞结构如图1所示,在ZnD晶胞中,D2-的配位数为

(6)E与金形成的金属互化物结构如图2所示,其晶胞边长为a nm,该金属互化物的密度为

您最近一年使用:0次



