X、Y、Z、W、P、Q是元素周期表前四周期的六种常见元素,原子序数依次增大。X在自然界中有多种同素异形体,其中一种是自然界中最硬的单质;Z是地壳中含量最多的元素;W基态原子核外的9个原子轨道上填充了电子,且有1个未成对电子;P是常见的金属元素,其单质能与盐酸反应,不与碱反应,它的某种氧化物可用作红色颜料;Q基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。回答以下问题:
(1)P、Q中位于周期表的d区的是__________ (填元素符号,下同),基态Q原子的价层电子排布式为__________ ;元素X、Y、Z中,电负性最大的是__________ 。
(2)烃 的1个分子中含有
的1个分子中含有__________ 个σ键;X和Y的简单氢化物中沸点更高的是__________ (填化学式),理由是__________ (答2点)。
(3)化合物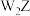 可用作杀菌消毒剂和漂白剂,
可用作杀菌消毒剂和漂白剂,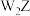 分子的中心原子杂化类型是
分子的中心原子杂化类型是__________ ;工业上可用W的单质与潮湿的碳酸钠反应制取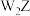 ,并生成另外两种含钠的化合物,反应中无其它气体生成,写出该反应的化学方程式
,并生成另外两种含钠的化合物,反应中无其它气体生成,写出该反应的化学方程式__________ 。
(1)P、Q中位于周期表的d区的是
(2)烃
 的1个分子中含有
的1个分子中含有(3)化合物
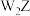 可用作杀菌消毒剂和漂白剂,
可用作杀菌消毒剂和漂白剂,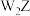 分子的中心原子杂化类型是
分子的中心原子杂化类型是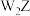 ,并生成另外两种含钠的化合物,反应中无其它气体生成,写出该反应的化学方程式
,并生成另外两种含钠的化合物,反应中无其它气体生成,写出该反应的化学方程式
更新时间:2024-02-22 10:40:20
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中除含有硝酸锌外,还含有自来水带入的Cl-和Fe3+。在实验室里用“烂板液”制取znSO4·7H2O的过程如下:

(1)若稀硝酸腐蚀锌板时还原产物为NH4NO3,氧化剂与还原剂的物质的量之比是_________
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠,写出Zn(OH)2被溶解的离子方程式_____________
(3)滤液D中除了含有OH-离子外,还含有的阴离子有_________ (填离子符号)。
(4)若滤液E的pH=4, c(Zn2+)=2mol/L,c(Fe3+)=2.6×10-9mol/L能求得的溶度积是____ (填选项)
A Ksp[Zn(OH)2] B Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C Ksp[Fe(OH)3]
(5)已知:①Fe(OH)3 (s) Fe3+(aq)+3OH-(aq) △H=a kJ/mol
Fe3+(aq)+3OH-(aq) △H=a kJ/mol
②H2O (l) H+(aq)+ OH-(aq) △H=b kJ/mol
H+(aq)+ OH-(aq) △H=b kJ/mol
请写出Fe3+发生水解反应的热化学方程式___________
(6)若Fe(OH)3的溶度积常数为Ksp,H2O 的离子积常数为Kw ,Fe3+发生水解反应的平衡常数K=________ 。(用含Ksp、Kw的代数式表示)

(1)若稀硝酸腐蚀锌板时还原产物为NH4NO3,氧化剂与还原剂的物质的量之比是
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠,写出Zn(OH)2被溶解的离子方程式
(3)滤液D中除了含有OH-离子外,还含有的阴离子有
(4)若滤液E的pH=4, c(Zn2+)=2mol/L,c(Fe3+)=2.6×10-9mol/L能求得的溶度积是
A Ksp[Zn(OH)2] B Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C Ksp[Fe(OH)3]
(5)已知:①Fe(OH)3 (s)
 Fe3+(aq)+3OH-(aq) △H=a kJ/mol
Fe3+(aq)+3OH-(aq) △H=a kJ/mol②H2O (l)
 H+(aq)+ OH-(aq) △H=b kJ/mol
H+(aq)+ OH-(aq) △H=b kJ/mol请写出Fe3+发生水解反应的热化学方程式
(6)若Fe(OH)3的溶度积常数为Ksp,H2O 的离子积常数为Kw ,Fe3+发生水解反应的平衡常数K=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定,是一种新型多功能水处理剂。其生产工艺如图1所示:
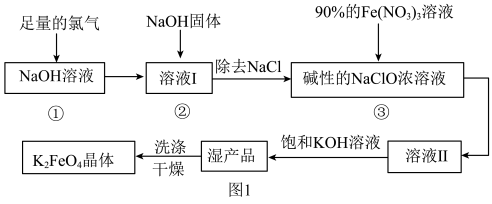
回答下列问题:
(1)Fe(NO3)3中 的空间结构名称为
的空间结构名称为_______ 氮原子的杂化轨道类型为_______
(2)反应①应在温度较低的情况下进行,因温度较高时NaOH与Cl2反应生成NaClO3,取某温度下反应液,测得ClO-与 的物质的量浓度之比是2∶1,则Cl2与氢氧化钠溶液反应时,被氧化的氯原子与被还原的氯原子的物质的量之比为
的物质的量浓度之比是2∶1,则Cl2与氢氧化钠溶液反应时,被氧化的氯原子与被还原的氯原子的物质的量之比为_______ 。
(3)反应③的离子方程式为_______ ,制备时,两溶液混合的操作为_______ 。
(4)往溶液II中加入饱和KOH溶液得到湿产品的原因是_______ 。该工艺流程中可循环使用的物质是_______ (填化学式)。
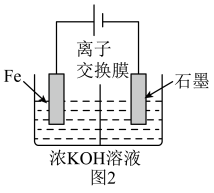
(5)高铁酸钾还可以通过电解法制备,其原理如图2所示:阳极的电极反应式为_______ 。

回答下列问题:
(1)Fe(NO3)3中
 的空间结构名称为
的空间结构名称为(2)反应①应在温度较低的情况下进行,因温度较高时NaOH与Cl2反应生成NaClO3,取某温度下反应液,测得ClO-与
 的物质的量浓度之比是2∶1,则Cl2与氢氧化钠溶液反应时,被氧化的氯原子与被还原的氯原子的物质的量之比为
的物质的量浓度之比是2∶1,则Cl2与氢氧化钠溶液反应时,被氧化的氯原子与被还原的氯原子的物质的量之比为(3)反应③的离子方程式为
(4)往溶液II中加入饱和KOH溶液得到湿产品的原因是
(5)高铁酸钾还可以通过电解法制备,其原理如图2所示:阳极的电极反应式为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】新冠疫情期间使用了大量的消毒剂,其中二氧化氯(ClO2)与亚氯酸钠(NaClO2)都具有强氧化性。两者作漂白剂时,不伤害织物;作饮用水消毒剂时,不残留异味。某研究性学习小组利用如下装置由二氧化氯制备NaClO2·3H2O,并探究其性质。

I.查阅资料:
①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2易与碱溶液反应生成等物质的量的两种盐,其中一种为氯酸盐。
II.制备与分离:
(1)实验加药品前应进行的实验操作是___________ 。
(2)盛放NaClO3和Na2SO3固体的仪器名称是___________ ,该装置中发生反应的化学方程式___________ 。
(3)若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下,请完成下列操作步骤②内容。
①减压,55℃蒸发结晶; ②___________ ;
③用38℃~60℃热水洗涤; ④在38℃~60℃间进行干燥,得到成品。
(4)装置D是处理尾气,反应的化学方程式___________ 。
III.测量与计算:
利用题中原理制备出NaClO2·3H2O晶体的样品,可以用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品2.890g配制成250mL溶液,从中取出25.00mL,加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO +4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1 Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1 Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O =S4O
=S4O +2I-)。
+2I-)。
(5)①下列滴定操作会导致测量结果偏低的是___________ (填字母)。
a 锥形瓶洗涤后没有干燥 b 滴定时锥形瓶中有液体溅出
c 滴定终点时俯视读数 d 滴定管滴定前有气泡,滴定后气泡消失
②样品中NaClO2·3H2O的纯度为___________ %(用含c、v的代数式表示)。

I.查阅资料:
①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2易与碱溶液反应生成等物质的量的两种盐,其中一种为氯酸盐。
II.制备与分离:
(1)实验加药品前应进行的实验操作是
(2)盛放NaClO3和Na2SO3固体的仪器名称是
(3)若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下,请完成下列操作步骤②内容。
①减压,55℃蒸发结晶; ②
③用38℃~60℃热水洗涤; ④在38℃~60℃间进行干燥,得到成品。
(4)装置D是处理尾气,反应的化学方程式
III.测量与计算:
利用题中原理制备出NaClO2·3H2O晶体的样品,可以用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品2.890g配制成250mL溶液,从中取出25.00mL,加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1 Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1 Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O =S4O
=S4O +2I-)。
+2I-)。(5)①下列滴定操作会导致测量结果偏低的是
a 锥形瓶洗涤后没有干燥 b 滴定时锥形瓶中有液体溅出
c 滴定终点时俯视读数 d 滴定管滴定前有气泡,滴定后气泡消失
②样品中NaClO2·3H2O的纯度为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】 现有下列短周期元素的数据(已知Be的原子半径为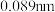 ):
):
(1)上述元素处于同一主族的有___________ (用元素符号表示);比较①⑤⑥的离子半径大小:___________ >___________ >___________ (用离子符号表示)
(2)元素①和⑥能形成两种化合物,写出其中较稳定的化合物与水反应的离子方程式:___________ 。
(3)②和⑦可形成一种化合物,写出该化合物的电子式:___________ 。
(4)含锂材料在社会中广泛应用,如各种储氢材料 等)、便携式电源材料
等)、便携式电源材料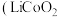 等);
等); 和
和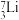 作核反应堆最佳热载体,
作核反应堆最佳热载体,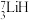 和
和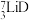 用作高温堆减速剂。下列说法中正确的是
用作高温堆减速剂。下列说法中正确的是___________ 。
A. 和
和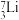 属于同种核素
属于同种核素
B.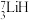 和
和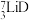 的化学性质不同
的化学性质不同
C.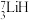 和
和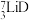 互为同素异形体
互为同素异形体
D.氧化性:
E.赋性:
F.半径: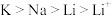
(5)胶奆磁流体在医学上有重要的用途,而纳米级 是磁流体中的重要粒子,其制备过程可简单表示如下:将⑦的最简单的气态氢化物通入到等物质的量的
是磁流体中的重要粒子,其制备过程可简单表示如下:将⑦的最简单的气态氢化物通入到等物质的量的 的混合燃液中,生成两种碱,写出该反应过程中的总离子方程式
的混合燃液中,生成两种碱,写出该反应过程中的总离子方程式___________ 。反应生成的两种䂸继续作用即得到产品。
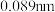 ):
):| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低负化合价 | -2 | -3 | -1 | -3 |
(2)元素①和⑥能形成两种化合物,写出其中较稳定的化合物与水反应的离子方程式:
(3)②和⑦可形成一种化合物,写出该化合物的电子式:
(4)含锂材料在社会中广泛应用,如各种储氢材料
 等)、便携式电源材料
等)、便携式电源材料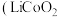 等);
等); 和
和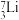 作核反应堆最佳热载体,
作核反应堆最佳热载体,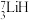 和
和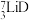 用作高温堆减速剂。下列说法中正确的是
用作高温堆减速剂。下列说法中正确的是A.
 和
和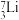 属于同种核素
属于同种核素B.
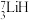 和
和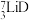 的化学性质不同
的化学性质不同C.
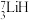 和
和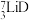 互为同素异形体
互为同素异形体D.氧化性:

E.赋性:

F.半径:
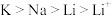
(5)胶奆磁流体在医学上有重要的用途,而纳米级
 是磁流体中的重要粒子,其制备过程可简单表示如下:将⑦的最简单的气态氢化物通入到等物质的量的
是磁流体中的重要粒子,其制备过程可简单表示如下:将⑦的最简单的气态氢化物通入到等物质的量的 的混合燃液中,生成两种碱,写出该反应过程中的总离子方程式
的混合燃液中,生成两种碱,写出该反应过程中的总离子方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】已知X、Y、Z、W均为元素周期表中的短周期元素,具有如下特征:
(1)W的元素符号是___ ,其原子结构示意图为___ 。
(2)四种元素中,原子半径最大的是___ (填元素符号)。
(3)X2Y的电子式是___ 。
(4)Z2Y2中含有化学键的类型是___ 。
(5)Y的非金属性___ (填“强”或“弱”)于W。请用原子结构的知识解释其原因:___ 。
(6)将WY2通入BaCl2溶液中,没有明显变化,再向其中加入Z元素最高价氧化物对应的水化物,可观察到的现象是___ ,发生反应的离子方程式是___ 。
| 元素 | 特征 |
| X | 周期表中,原子半径最小 |
| Y | 常温下,可以形成Y2、Y3型的气体单质 |
| Z | 其原子内层电子与最外层电子数之比为10:1 |
| W | 最高化合价为+6 |
(2)四种元素中,原子半径最大的是
(3)X2Y的电子式是
(4)Z2Y2中含有化学键的类型是
(5)Y的非金属性
(6)将WY2通入BaCl2溶液中,没有明显变化,再向其中加入Z元素最高价氧化物对应的水化物,可观察到的现象是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】短周期A、B、C、D4种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上电子数之和。
(1)元素:A为____ ,B为____ ,C为____ (填元素符号)。
(2)D的质子数和中子数相等。D的原子组成符号为____ ,它的最高价为____ 。
(3)用电子式表示A、B两元素形成AB2的过程____ ,用电子式表示C、D两元素形成化合物的过程____ 。
(1)元素:A为
(2)D的质子数和中子数相等。D的原子组成符号为
(3)用电子式表示A、B两元素形成AB2的过程
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】回答下列问题。
(1)氮元素是重要的非金属元素,可形成卤化氮、氮化物、叠氮化物及配合物等多种化合物。
① 、
、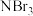 、
、 的沸点由高到低的顺序是
的沸点由高到低的顺序是___________ 。
② 与
与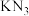 相比,
相比, 的熔点
的熔点___________ (填“>”、“=”或“<”)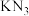 的熔点。
的熔点。
③某元素X形成的离子 中K、L、M三个电子层均充满了电子。它与
中K、L、M三个电子层均充满了电子。它与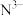 形成晶体的结构如图所示。X是
形成晶体的结构如图所示。X是___________ (填元素符号),晶体中距离每个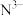 最近的
最近的 有
有___________ 个。 ,酸性比纯硫酸强
,酸性比纯硫酸强 倍,称为超强酸,其与
倍,称为超强酸,其与 作用生成
作用生成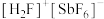 ,则其阳离子的空间结构为
,则其阳离子的空间结构为___________ 。
(3)三价铬离子( +)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。化学式为
+)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。化学式为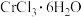 的化合物有多种结构,其中一种可表示为
的化合物有多种结构,其中一种可表示为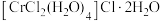 其配位数为
其配位数为___________ 。
(4)由铁原子核形成的四种微粒,价电子排布图分别为:① 、②
、② 、③
、③ 、④
、④ ,有关这些微粒的叙述,正确的是
,有关这些微粒的叙述,正确的是___________ 。
A.微粒半径:
B.得电子能力:
C.微粒③价电子在简并轨道中单独分占,且自旋相同,故不能再继续失去电子
(1)氮元素是重要的非金属元素,可形成卤化氮、氮化物、叠氮化物及配合物等多种化合物。
①
 、
、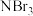 、
、 的沸点由高到低的顺序是
的沸点由高到低的顺序是②
 与
与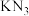 相比,
相比, 的熔点
的熔点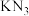 的熔点。
的熔点。③某元素X形成的离子
 中K、L、M三个电子层均充满了电子。它与
中K、L、M三个电子层均充满了电子。它与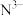 形成晶体的结构如图所示。X是
形成晶体的结构如图所示。X是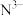 最近的
最近的 有
有
 ,酸性比纯硫酸强
,酸性比纯硫酸强 倍,称为超强酸,其与
倍,称为超强酸,其与 作用生成
作用生成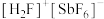 ,则其阳离子的空间结构为
,则其阳离子的空间结构为(3)三价铬离子(
 +)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。化学式为
+)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。化学式为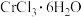 的化合物有多种结构,其中一种可表示为
的化合物有多种结构,其中一种可表示为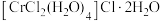 其配位数为
其配位数为(4)由铁原子核形成的四种微粒,价电子排布图分别为:①
 、②
、② 、③
、③ 、④
、④ ,有关这些微粒的叙述,正确的是
,有关这些微粒的叙述,正确的是A.微粒半径:
B.得电子能力:

C.微粒③价电子在简并轨道中单独分占,且自旋相同,故不能再继续失去电子
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】A、B、C、D、E、F六种元素均位于元素周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子占据四个原子轨道;D元素原子的成对电子总数是未成对电子总数的3倍;E与D位于同一主族;F位于ds区,且原子的最外层只有1个电子。
(1)基态F核外电子排布式是____ ,最高能级电子的电子云轮廓形状为____ 。
(2)B、C元素的某些氢化物的分子中均含有18个电子,则B元素的这种氢化物的化学式是____ ;B、C元素的这些氢化物的熔、沸点相差较大的主要原因是____ 。
(3)A、B、D可形成分子式为BA2D的某化合物,则该化合物分子中B原子的杂化轨道类型是___ ;A和D还可以形成1:1的化合物,它的电子式为____ 。
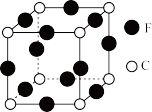
(4)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是____ ,C原子的配位数是____ 。
(1)基态F核外电子排布式是
(2)B、C元素的某些氢化物的分子中均含有18个电子,则B元素的这种氢化物的化学式是
(3)A、B、D可形成分子式为BA2D的某化合物,则该化合物分子中B原子的杂化轨道类型是
(4)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】我国科学家研究发现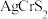 (
(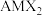 家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题
家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题
(1)基态铬原子的价电子排布式为___________ ;基态硫原子核外电子的运动状态有___________ 种。
(2)同周期元素Si、P、S的第一电离能由大到小的顺序为___________ (用元素符号表示)。
(3)硫元素能形成多种微粒如 、
、 、
、 、
、 、
、 等。
等。 的中心原子的杂化类型是
的中心原子的杂化类型是___________ 。
(4)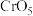 中Cr元素化合价为+6价,常温下呈蓝色,则其结构式可能为
中Cr元素化合价为+6价,常温下呈蓝色,则其结构式可能为___________ (填标号)。
(5)某含铬化合物立方晶胞如图所示。该晶体的化学式为___________ 。

(6)已知晶体的密度为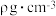 ,
, 为阿伏加德罗常数的值,则相邻
为阿伏加德罗常数的值,则相邻 与
与 之间的最短距离为=
之间的最短距离为=___________ pm(列出计算式即可)。
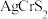 (
(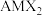 家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题
家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题(1)基态铬原子的价电子排布式为
(2)同周期元素Si、P、S的第一电离能由大到小的顺序为
(3)硫元素能形成多种微粒如
 、
、 、
、 、
、 、
、 等。
等。 的中心原子的杂化类型是
的中心原子的杂化类型是(4)
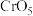 中Cr元素化合价为+6价,常温下呈蓝色,则其结构式可能为
中Cr元素化合价为+6价,常温下呈蓝色,则其结构式可能为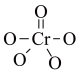 | 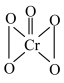 | 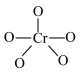 |
| A | B | C |

(6)已知晶体的密度为
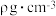 ,
, 为阿伏加德罗常数的值,则相邻
为阿伏加德罗常数的值,则相邻 与
与 之间的最短距离为=
之间的最短距离为=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】短周期元素A、B、C、D,原子序数依次增大,A的基态原子的L层电子是K层电子的两倍;B的价电子层中的未成对电子有3个;C 与B同族;D的最高价含氧酸为酸性最强的无机含氧酸。请回答下列问题:
(1)C的基态原子的电子排布式为_______ ;D的最高价含氧酸酸性比其低两价的含氧酸酸性强的原因是_______ 。
(2)杂化轨道分为等性和不等性杂化,不等性杂化时在杂化轨道中有不参加成键的孤电子对的存在。A、B、C都分别能与D形成中心原子杂化方式均为_______ 的共价化合物X、Y、Z。其中,属于不等性杂化的是_______ (写化学式)。
(3)比较Y、Z的熔沸点Y_______ Z (填“>”、“<”或“=”),并解释理由_______ 。
(4)D 元素能与Cu形成棕黄色固体,加水溶解并稀释过程中,溶液颜色由绿色逐渐转化为蓝色,显绿色离子是_______ ,显蓝色离子中的配位原子_______ 。
(5)A和B能形成多种结构的晶体。其中一种类似石墨的结构,其结构如下图所示(图1为晶体结构,图2为切片层状结构),其化学式为_______ 。实验测得此晶体结构属于六方晶系,晶胞结构见图3。已知图示原子都包含在晶胞内,晶胞参数a=0.64nm,c=0.24nm。其晶体密度为_______ g/cm3 (已知: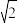 =1.414,
=1.414,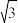 = 1.732,结果精确到小数点后第2位。)
= 1.732,结果精确到小数点后第2位。)

(1)C的基态原子的电子排布式为
(2)杂化轨道分为等性和不等性杂化,不等性杂化时在杂化轨道中有不参加成键的孤电子对的存在。A、B、C都分别能与D形成中心原子杂化方式均为
(3)比较Y、Z的熔沸点Y
(4)D 元素能与Cu形成棕黄色固体,加水溶解并稀释过程中,溶液颜色由绿色逐渐转化为蓝色,显绿色离子是
(5)A和B能形成多种结构的晶体。其中一种类似石墨的结构,其结构如下图所示(图1为晶体结构,图2为切片层状结构),其化学式为
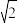 =1.414,
=1.414,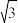 = 1.732,结果精确到小数点后第2位。)
= 1.732,结果精确到小数点后第2位。)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】第ⅥA族的氧、硫、硒、碲等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
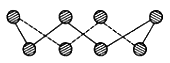
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是_____ ;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为_______ ;
(3)Se原子序数为____ ,其核外M层电子的排布式为____ ;
(4)H2Se的酸性比H2S___ (填“强”或“弱”)。气态SeO3分子的立体构型为___ ,SO32-离子的立体构型为______ ;SO32-离子中S原子的杂化方式为____________ 。
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是

(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为
(3)Se原子序数为
(4)H2Se的酸性比H2S
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】氮化铬常用于薄膜涂层,是一种良好的耐磨材料,同时在超级电容器领域有良好的应用前景。工业上以铬铁矿( )为原料,经过一系列反应,制备氮化铬和铬单质的工艺流程如图:
)为原料,经过一系列反应,制备氮化铬和铬单质的工艺流程如图:
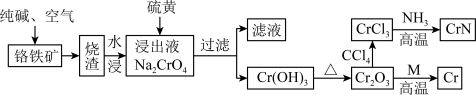
(1)基态铬原子核外有_______ 种能量不同的电子,其最外层电子的电子云轮廓图为_______ 。
(2)M是短周期金属元素,M的部分电离能数据如表所示:
则M是_______ (填元素符号)。
(3)制备 时,发生的主要反应为
时,发生的主要反应为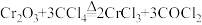 。
。
① 分子中碳原子的杂化方式为
分子中碳原子的杂化方式为_______ , 分子的空间结构是
分子的空间结构是_______ 。
② 溶于水得到配合物-------氯化二氯四水合铬(Ⅲ){
溶于水得到配合物-------氯化二氯四水合铬(Ⅲ){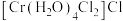 },其中提供电子对形成配位键的原子是
},其中提供电子对形成配位键的原子是_______ ,中心离子配位数为_______ 。
③ 的熔点(83℃)比
的熔点(83℃)比 的熔点(1100℃)低得多,这是由于
的熔点(1100℃)低得多,这是由于_______ 。
 )为原料,经过一系列反应,制备氮化铬和铬单质的工艺流程如图:
)为原料,经过一系列反应,制备氮化铬和铬单质的工艺流程如图:
(1)基态铬原子核外有
(2)M是短周期金属元素,M的部分电离能数据如表所示:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/(kJ/mol) | 578 | 1817 | 2745 | 11575 | 14830 |
(3)制备
 时,发生的主要反应为
时,发生的主要反应为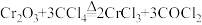 。
。①
 分子中碳原子的杂化方式为
分子中碳原子的杂化方式为 分子的空间结构是
分子的空间结构是②
 溶于水得到配合物-------氯化二氯四水合铬(Ⅲ){
溶于水得到配合物-------氯化二氯四水合铬(Ⅲ){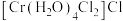 },其中提供电子对形成配位键的原子是
},其中提供电子对形成配位键的原子是③
 的熔点(83℃)比
的熔点(83℃)比 的熔点(1100℃)低得多,这是由于
的熔点(1100℃)低得多,这是由于
您最近一年使用:0次



