电极活性物质Cu4O(PO4)2的制备,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3·H2O = Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O。
(1)上述反应涉及的元素中不属于元素周期表p区元素的是___________ ,写出基态Cu2+的电子排布式___________ 。
(2)P、S元素第一电离能大小关系为P___________ S(填“>”、“<”或“=”),原因是_____________ 。
(3)O的原子核外有_____ 种不同能量的电子,其氢化物沸点高于同族元素H2S的原因是_______ 。
(4)CuSO4溶液中逐滴加入氨水,先产生蓝色沉淀,后又溶解得到深蓝色溶液[Cu(NH3)4]SO4,加入乙醇后有深蓝色沉淀析出,关于该深蓝色物质的说法错误的是________ 。
A.该物质正离子的中心是Cu原子 B.该配合物的配体数等于配位数
C.外界离子的中心原子的杂化方式为sp3 D.乙醇的作用是将配合物转化为Cu(OH)2
写出沉淀溶解生成深蓝色溶液的离子方程式________ 。
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol该配合物含有π键的数目为___________ (NA表示阿伏加德罗常数的值)。
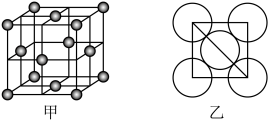
(6)晶体铜的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示,铜原子的配位数为______ ,已知铜原子半径为127.8 pm,NA=6.02×1023 mol-1,计算晶体铜的密度________ g·cm-3(结果保留3位有效数字)。
(1)上述反应涉及的元素中不属于元素周期表p区元素的是
(2)P、S元素第一电离能大小关系为P
(3)O的原子核外有
(4)CuSO4溶液中逐滴加入氨水,先产生蓝色沉淀,后又溶解得到深蓝色溶液[Cu(NH3)4]SO4,加入乙醇后有深蓝色沉淀析出,关于该深蓝色物质的说法错误的是
A.该物质正离子的中心是Cu原子 B.该配合物的配体数等于配位数
C.外界离子的中心原子的杂化方式为sp3 D.乙醇的作用是将配合物转化为Cu(OH)2
写出沉淀溶解生成深蓝色溶液的离子方程式
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol该配合物含有π键的数目为
(6)晶体铜的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示,铜原子的配位数为

更新时间:2023-11-14 16:57:42
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】H、C、N、F、Cl、Ba等是几种重要的元素,Ba的一种氢化物是一种重要的储氢晶体。回答下列问题:
(1)处于基态的F和N原子,下列参数前者小于后者的是________ (填字母)。
A.最外层电子数 B.未成对电子数 C.第一电离能 D.原子半径 E.电负性
(2)咪唑(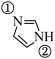 )具有类似苯环的芳香性,①号N比②号N更易与某些金属离子(如
)具有类似苯环的芳香性,①号N比②号N更易与某些金属离子(如 )形成配位键的原因:
)形成配位键的原因:________ 。
(3) 、
、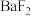 两种物质中熔点较高的是
两种物质中熔点较高的是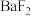 ,其原因是
,其原因是________ 。
(4)三氯乙腈 和过量
和过量 反应可得到一种高能物质M,其结构如图,则
反应可得到一种高能物质M,其结构如图,则 分子中
分子中 键与
键与 键的数目比为
键的数目比为________ , 的空间构型为
的空间构型为________ ,M中N原子杂化方式为________ 。 与
与 形成的氢化物储氢(用H表示)后的晶胞如图:
形成的氢化物储氢(用H表示)后的晶胞如图:________ (填“H”或“ ”)。
”)。
②原子分数坐标为 ,
, ,
, ,d原子的坐标为
,d原子的坐标为________ 。
③根据上图所示,储氢后该晶体的密度为________  。
。
(1)处于基态的F和N原子,下列参数前者小于后者的是
A.最外层电子数 B.未成对电子数 C.第一电离能 D.原子半径 E.电负性
(2)咪唑(
 )具有类似苯环的芳香性,①号N比②号N更易与某些金属离子(如
)具有类似苯环的芳香性,①号N比②号N更易与某些金属离子(如 )形成配位键的原因:
)形成配位键的原因:(3)
 、
、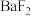 两种物质中熔点较高的是
两种物质中熔点较高的是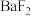 ,其原因是
,其原因是(4)三氯乙腈
 和过量
和过量 反应可得到一种高能物质M,其结构如图,则
反应可得到一种高能物质M,其结构如图,则 分子中
分子中 键与
键与 键的数目比为
键的数目比为 的空间构型为
的空间构型为
 与
与 形成的氢化物储氢(用H表示)后的晶胞如图:
形成的氢化物储氢(用H表示)后的晶胞如图:
 ”)。
”)。②原子分数坐标为
 ,
, ,
, ,d原子的坐标为
,d原子的坐标为③根据上图所示,储氢后该晶体的密度为
 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】钴元素的用途广泛,据古文献记载:宜德时期青花瓷使用的颜料“苏勃泥青"是从一种进口钴毒矿[主要成分:(FeCo)xAsS]中提取出来的。
(1)Co的价电子排布式为_______
(2)无水CoCl2的熔点是735°C ,沸点1049°C ,CoCl2属于_______ 晶体;砷酸(H3AsO4)分子中As原子的杂化方式为_______ 杂化;砷酸根离子的空间构型为_______ ;第一电离能I1(As)_______ I1(Se)(填“大于”或“小于")。
(3)[Co(NH3)4(H2O)2]Cl3是一种特殊的配合物,其中心离子的配位数是_______ ,每个[Co(NH3)4(H2O)2]3+所含共价键的数目是_______ ,配体NH3的熔沸点大于同族元素氢化物AsH3的原因是_______ 。
(4)钴氰化钾K3[Co(CN)6]是一种浅黄色单斜棱晶体,与配体CN-原子总数相等的等电子体是_______ 。
(5)金属钴晶体的晶胞结构如图所示,其中正六边形的面积为apm2,棱长为bpm;每个Co距离最近且相等的Co原子数目为_______ ; 设阿伏加德罗常数的值为NA,则该晶体的密度为_______ (用含a、b、NA的代数式表示) g·cm-3。

(1)Co的价电子排布式为
(2)无水CoCl2的熔点是735°C ,沸点1049°C ,CoCl2属于
(3)[Co(NH3)4(H2O)2]Cl3是一种特殊的配合物,其中心离子的配位数是
(4)钴氰化钾K3[Co(CN)6]是一种浅黄色单斜棱晶体,与配体CN-原子总数相等的等电子体是
(5)金属钴晶体的晶胞结构如图所示,其中正六边形的面积为apm2,棱长为bpm;每个Co距离最近且相等的Co原子数目为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】铜是重要金属,Cu及其化合物在科学研究和工业生产中具有许多用途。请回答以下问题:
(1)CuSO4可由金属铜与稀硫酸并通入氧气反应制备,该反应的化学方程式为_______ ;
(2)无水CuSO4粉末常用来检验一些有机物中的微量水分,现象是________________ ;
(3) 的立体构型是
的立体构型是________ ,其中S原子的杂化轨道类型是_______ ;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为______ ;一种铜合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,该合金中每一层均为__________ (填“密置层”、“非密置层”),金原子的配位数为__________ ;该晶体中,原子之间的作用力是________ ;
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的晶胞结构结构相似,该晶体储氢后的化学式应为___________ 。若Cu原子与Au原子的距离为a cm,则该晶体储氢后的密度为_________ 。(含a的表达式)
(1)CuSO4可由金属铜与稀硫酸并通入氧气反应制备,该反应的化学方程式为
(2)无水CuSO4粉末常用来检验一些有机物中的微量水分,现象是
(3)
 的立体构型是
的立体构型是(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的晶胞结构结构相似,该晶体储氢后的化学式应为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】磷酸铁锂LiFePO4)电池在新能源汽车方面应用广泛。回答下列问题:
(1)基态Fe2+的核外电子排布式为_______ ,其电子在原子核外的空间运动状态有_______ 种,基态Fe2+与Fe3+离子中未成对电子数之比为_______ 。
(2)元素的第一电离能用I1表示,则I1(Li)_______ I1(Na)(填“>”、“<”或“=”)。
(3)生产磷酸铁锂离子电池的原料是草酸亚铁(FeC2O4·2H2O)、磷酸氢二铵[(NH4)2HPO4]和碳酸锂(Li2CO3)等。则碳酸根离子的杂化轨道类型为_______ ,磷酸氢二铵中电负性最高的元素是_______ ,1 mol  含σ键的数目为
含σ键的数目为_______ 。
(4)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。
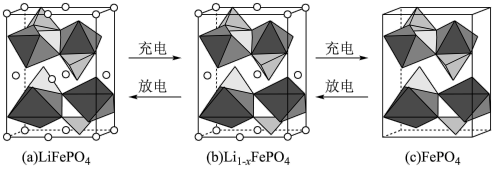
①每个晶胞中含有LiFePO4的单元数有_______ 个。
②当电池充电时,LiFeO4能脱出部分Li+形成Li1-xFePO4,结构示意图如图(b)所示,则x=_______ 。
(1)基态Fe2+的核外电子排布式为
(2)元素的第一电离能用I1表示,则I1(Li)
(3)生产磷酸铁锂离子电池的原料是草酸亚铁(FeC2O4·2H2O)、磷酸氢二铵[(NH4)2HPO4]和碳酸锂(Li2CO3)等。则碳酸根离子的杂化轨道类型为
 含σ键的数目为
含σ键的数目为(4)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。

①每个晶胞中含有LiFePO4的单元数有
②当电池充电时,LiFeO4能脱出部分Li+形成Li1-xFePO4,结构示意图如图(b)所示,则x=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】氢能作为理想的清洁能源之一,已经受到世界各国的普遍关注。氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢方法有:配位氢化物储氢、碳质材料储氢、合金储氢、多孔材料储氢等。请回答下列问题:
(1)氨硼烷(NH3BH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。
①C、N、O第一电离能由大到小的顺序为___________ ,CH4、H2O、CO2键角由大到小的顺序为___________ ,原因为____________________________________________ 。
②)1 mol(HB=NH)3分子中有_____ 个σ键。与(HB=NH)3互为等电子体的分子为_______ (填分子式)。
③氨硼烷在高温下释放氢后生成的立方氮化硼晶体具有类似金刚石的结构,但熔点比金刚石低,原因是____________________________________________ 。
(2)一种储氢合金由镍和镧(La)组成,其晶胞结构如图所示。

①Ni的基态原子核外电子排布式为___________ 。
②该晶体的化学式为___________ 。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:标准状况下氢气的密度为p g·cm-3;阿伏加 德罗常数的值为NA。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为___________ 。(储氢能力=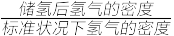 )
)
(1)氨硼烷(NH3BH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。
①C、N、O第一电离能由大到小的顺序为
②)1 mol(HB=NH)3分子中有
③氨硼烷在高温下释放氢后生成的立方氮化硼晶体具有类似金刚石的结构,但熔点比金刚石低,原因是
(2)一种储氢合金由镍和镧(La)组成,其晶胞结构如图所示。

①Ni的基态原子核外电子排布式为
②该晶体的化学式为
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:标准状况下氢气的密度为p g·cm-3;阿伏加 德罗常数的值为NA。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
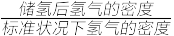 )
)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铍及其化合物的应用正日益被重视。
(l)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子排布图为__________ 。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有_____ (填标号)。
A.铍属于s区主族元素 B.电负性都比镁大
C.铝的第一电离能比镁小 D.氯化物的水溶液pH均大于7
(3)铍、铝晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点(155lK)比铝的熔点(930K)高,原因是_______________________________________________________ 。
(4)氯化铍在气态时存在BeC12分子(a)和二聚分子(BeCl2)2(b),固态时则具有如下图所示的链状结构(c)。
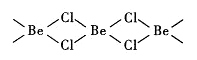
①a属于__________ (填“极性”或“非极性”)分子。
②b中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为____________________ (标出配位键)。
③c中Be原子的杂化方式为__________ 。
④氯化铍晶体(c)中存在的作用力有__________ (填标号)。
A.配位键 B. σ键 C.极性键 D.非极性键 E.离子键
(5)BeO立方晶胞如下图所示。
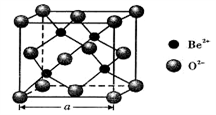
① BeO晶体中,O2-的配位数为___________ 。
② 若BeO晶体的密度为dg/cm3,则晶胞参数
a =___________________________ nm (列出计算式即可)。
(l)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子排布图为
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有
A.铍属于s区主族元素 B.电负性都比镁大
C.铝的第一电离能比镁小 D.氯化物的水溶液pH均大于7
(3)铍、铝晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点(155lK)比铝的熔点(930K)高,原因是
(4)氯化铍在气态时存在BeC12分子(a)和二聚分子(BeCl2)2(b),固态时则具有如下图所示的链状结构(c)。

①a属于
②b中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为
③c中Be原子的杂化方式为
④氯化铍晶体(c)中存在的作用力有
A.配位键 B. σ键 C.极性键 D.非极性键 E.离子键
(5)BeO立方晶胞如下图所示。

① BeO晶体中,O2-的配位数为
② 若BeO晶体的密度为dg/cm3,则晶胞参数
a =
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】人类使用铜及其合金具有悠久的历史,铜及其化合物在电子工业、材料工业、工农业生产及日常生活方面具有广泛用途。
(1) 的核外电子排布式为
的核外电子排布式为______ 。
(2) 和
和 是自然界中重要的铜盐,
是自然界中重要的铜盐, 的立体构型是
的立体构型是______ ,S、O、N三种元素的第一电离能由大到小的顺序为______ 。
(3)向盛有 溶液的试管中加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,得到深蓝色透明溶液,溶液呈深蓝色是因为存在离子
溶液的试管中加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,得到深蓝色透明溶液,溶液呈深蓝色是因为存在离子______ (填离子符号);向反应后的溶液中加入乙醇,析出深蓝色的晶体,该晶体中含有的化学键类型有______ 。
(4)利用 和NaOH制备的
和NaOH制备的 悬浊液检验醛基时,生成红色的
悬浊液检验醛基时,生成红色的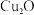 ,其晶胞结构如图所示。
,其晶胞结构如图所示。
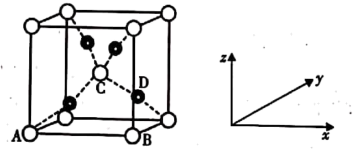
①该晶胞原子坐标参数A为 ;B为
;B为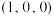 ;C为
;C为 。则D原子的坐标参数为
。则D原子的坐标参数为______ 。
②若 晶体密度为
晶体密度为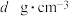 ,晶胞参数为a pm,则阿伏加德罗常数值
,晶胞参数为a pm,则阿伏加德罗常数值
______ 。
(1)
 的核外电子排布式为
的核外电子排布式为(2)
 和
和 是自然界中重要的铜盐,
是自然界中重要的铜盐, 的立体构型是
的立体构型是(3)向盛有
 溶液的试管中加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,得到深蓝色透明溶液,溶液呈深蓝色是因为存在离子
溶液的试管中加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,得到深蓝色透明溶液,溶液呈深蓝色是因为存在离子(4)利用
 和NaOH制备的
和NaOH制备的 悬浊液检验醛基时,生成红色的
悬浊液检验醛基时,生成红色的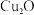 ,其晶胞结构如图所示。
,其晶胞结构如图所示。
①该晶胞原子坐标参数A为
 ;B为
;B为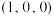 ;C为
;C为 。则D原子的坐标参数为
。则D原子的坐标参数为②若
 晶体密度为
晶体密度为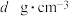 ,晶胞参数为a pm,则阿伏加德罗常数值
,晶胞参数为a pm,则阿伏加德罗常数值
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】含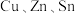 及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1)写出基态 电子排布式
电子排布式___________ 。 与C均为第四主族元素,基态
与C均为第四主族元素,基态 原子的价电子中,两种自旋状态的电子数之比为
原子的价电子中,两种自旋状态的电子数之比为___________ 。
(2) 的空间结构名称为
的空间结构名称为___________ , 中心原子杂化方式为
中心原子杂化方式为___________ 。非金属性氧大于硫,能证明此关系成立的一种事实为___________ 。
(3) 的配位体是
的配位体是___________ , 形成配合物后
形成配合物后 键角会
键角会___________ (填“变大”、“变小”或“不变”),原因是成键电子对之间的排斥力___________ 孤电子对与成键电子对的排斥力(填“>”、“<”或“=”)。
(4)如图是硫的四种含氧酸根的结构:
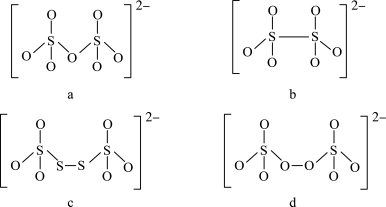
根据组成和结构推断,能在酸性溶液中将 转化为
转化为 的是
的是___________ (填序号),写出其离子反应方程式___________ 。
 及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:(1)写出基态
 电子排布式
电子排布式 与C均为第四主族元素,基态
与C均为第四主族元素,基态 原子的价电子中,两种自旋状态的电子数之比为
原子的价电子中,两种自旋状态的电子数之比为(2)
 的空间结构名称为
的空间结构名称为 中心原子杂化方式为
中心原子杂化方式为(3)
 的配位体是
的配位体是 形成配合物后
形成配合物后 键角会
键角会(4)如图是硫的四种含氧酸根的结构:

根据组成和结构推断,能在酸性溶液中将
 转化为
转化为 的是
的是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】2022年北京冬季奥运会场馆使用了大量不锈钢材质,不锈钢属于合金钢,其基体是铁碳合金,常用的不锈钢中含铬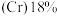 、含镍
、含镍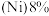 。回答下列问题:
。回答下列问题:
(1)不锈钢所属的晶体类型为_______ 。
(2)铁系元素能与 形成
形成 等金属羰基化合物。已知室温时
等金属羰基化合物。已知室温时 为浅黄色液体,沸点
为浅黄色液体,沸点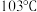 ,则该晶体的晶体类型为
,则该晶体的晶体类型为_______ 晶体, 中含有的化学键类型包括
中含有的化学键类型包括_______ (填字母)。
A.氢键 B.离子键 C.配位键 D.极性共价键 E.金属键 F.范德华力
(3)氧元素与 可形成低价态氧化物
可形成低价态氧化物 。
。
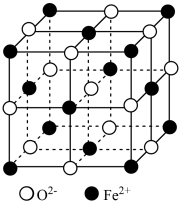
① 立方晶胞结构如图所示,则单位晶胞内
立方晶胞结构如图所示,则单位晶胞内 的个数为
的个数为_______ ;与 紧邻的所有
紧邻的所有 构成的几何构型为
构成的几何构型为_______ 。
②若 与
与 之间最近距离为
之间最近距离为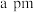 ,则该晶体的密度计算式为
,则该晶体的密度计算式为_______  。(用含
。(用含 的代数式表示,
的代数式表示, 代表阿伏加德罗常数的值)
代表阿伏加德罗常数的值)
 、含镍
、含镍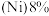 。回答下列问题:
。回答下列问题:(1)不锈钢所属的晶体类型为
(2)铁系元素能与
 形成
形成 等金属羰基化合物。已知室温时
等金属羰基化合物。已知室温时 为浅黄色液体,沸点
为浅黄色液体,沸点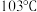 ,则该晶体的晶体类型为
,则该晶体的晶体类型为 中含有的化学键类型包括
中含有的化学键类型包括A.氢键 B.离子键 C.配位键 D.极性共价键 E.金属键 F.范德华力
(3)氧元素与
 可形成低价态氧化物
可形成低价态氧化物 。
。
①
 立方晶胞结构如图所示,则单位晶胞内
立方晶胞结构如图所示,则单位晶胞内 的个数为
的个数为 紧邻的所有
紧邻的所有 构成的几何构型为
构成的几何构型为②若
 与
与 之间最近距离为
之间最近距离为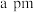 ,则该晶体的密度计算式为
,则该晶体的密度计算式为 。(用含
。(用含 的代数式表示,
的代数式表示, 代表阿伏加德罗常数的值)
代表阿伏加德罗常数的值)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】研究含碳化合物的结构与性质,对生产、科研等具有重要意义
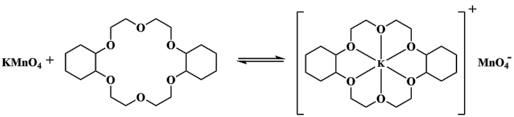
(1)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。

①Li+计与X的空腔大小相近,恰好能进入到X的环内,且Li+与氧原子的一对孤电子对作用形成稳定结构W(如图)。
a.基态锂离子核外能量最高的电子所处能层符号为___________ ;
b.W中Li+与孤对电子之间的作用属于___________ (选填字母标号)
A.离子键 B.共价键 C.配位键 D.氢键 E.以上都不是
②冠醚Y能与K+形成稳定结构,但不能与Li+计形成稳定结构。理由是___________ 。
③烯烃难溶于水,被KMnO4水溶液氧化的效果较差。若烯烃中溶人冠醚Z,氧化效果明显提升。
i.水分子中氧的杂化轨道的空间构型是___________ ,H-O键键角___________ (填“>”“<”或“=”)109°28′
ii.已知:冠醚Z与KMnO4可以发生右图所示的变化。加入冠醚Z后,烯烃的氧化效果明显提升的原因是___________ 。
(2)甲烷是重要的清洁能源,其晶体结构如图所示,晶胞参数为anm。
①常温常压下不存在甲烷晶体。从微粒间相互作用的角度解释,其理由是___________ ;
②甲烷分子的配位数为___________ ;
③A分子中碳原子的坐标参数为(0,0,0),则B分子的碳原子的坐标参数为___________ 。
④甲烷晶体的密度为___________ (g·cm-3)。

(1)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。

①Li+计与X的空腔大小相近,恰好能进入到X的环内,且Li+与氧原子的一对孤电子对作用形成稳定结构W(如图)。
a.基态锂离子核外能量最高的电子所处能层符号为
b.W中Li+与孤对电子之间的作用属于
A.离子键 B.共价键 C.配位键 D.氢键 E.以上都不是
②冠醚Y能与K+形成稳定结构,但不能与Li+计形成稳定结构。理由是
③烯烃难溶于水,被KMnO4水溶液氧化的效果较差。若烯烃中溶人冠醚Z,氧化效果明显提升。
i.水分子中氧的杂化轨道的空间构型是
ii.已知:冠醚Z与KMnO4可以发生右图所示的变化。加入冠醚Z后,烯烃的氧化效果明显提升的原因是

(2)甲烷是重要的清洁能源,其晶体结构如图所示,晶胞参数为anm。
①常温常压下不存在甲烷晶体。从微粒间相互作用的角度解释,其理由是
②甲烷分子的配位数为
③A分子中碳原子的坐标参数为(0,0,0),则B分子的碳原子的坐标参数为
④甲烷晶体的密度为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】 是重要的化学试剂,遇高温分解,与酸发生反应。实验室可通过如图所示装置制备
是重要的化学试剂,遇高温分解,与酸发生反应。实验室可通过如图所示装置制备 。
。

回答下列问题:
(1)仪器A的名称为_______ 。
(2)下列关于装置B的作用叙述正确的是_______ (填标号)
a.通过观察气泡可控制 气流速率
气流速率
b.防止发生倒吸
c.通过长颈漏斗液面升降判断B后面装置是否堵塞
(3)C中生成产品的化学反应方程式为_______ 。
(4)为保证硫代硫酸钠的产率和纯度,实验中通入的 不能过量,原因是
不能过量,原因是_______ 。
(5)为测定所得产品纯度,取m g所得产品溶于蒸馏水中配制成250mL溶液,取25.00mL置于锥形瓶中,加入2滴淀粉试剂,用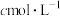 碘的标准溶液滴定,消耗标准液V mL。已知:
碘的标准溶液滴定,消耗标准液V mL。已知: 。
。
①滴定终点现象为_______ 。
②产品纯度为_______ (用m、c、V表示)。
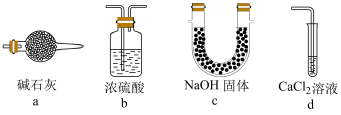
(6)下列装置和试剂能代替E的是_______ (填标号)。
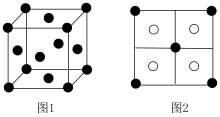
(7)硫化铜是一种难溶固体,晶胞中 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心,晶胞侧视图如图2所示。则与
所构成的四面体中心,晶胞侧视图如图2所示。则与 距离最近的
距离最近的 数目为
数目为_______ 。
 是重要的化学试剂,遇高温分解,与酸发生反应。实验室可通过如图所示装置制备
是重要的化学试剂,遇高温分解,与酸发生反应。实验室可通过如图所示装置制备 。
。
回答下列问题:
(1)仪器A的名称为
(2)下列关于装置B的作用叙述正确的是
a.通过观察气泡可控制
 气流速率
气流速率b.防止发生倒吸
c.通过长颈漏斗液面升降判断B后面装置是否堵塞
(3)C中生成产品的化学反应方程式为
(4)为保证硫代硫酸钠的产率和纯度,实验中通入的
 不能过量,原因是
不能过量,原因是(5)为测定所得产品纯度,取m g所得产品溶于蒸馏水中配制成250mL溶液,取25.00mL置于锥形瓶中,加入2滴淀粉试剂,用
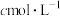 碘的标准溶液滴定,消耗标准液V mL。已知:
碘的标准溶液滴定,消耗标准液V mL。已知: 。
。①滴定终点现象为
②产品纯度为
(6)下列装置和试剂能代替E的是

(7)硫化铜是一种难溶固体,晶胞中
 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的四面体中心,晶胞侧视图如图2所示。则与
所构成的四面体中心,晶胞侧视图如图2所示。则与 距离最近的
距离最近的 数目为
数目为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】Ⅰ.下列各组物质性质的比较,结论正确的是( )
A. 分子的极性: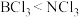 B. 物质的硬度:
B. 物质的硬度: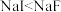
C. 物质的沸点: D.在
D.在 中的溶解度:
中的溶解度:
Ⅱ.锰单质及其化合物应用十分广泛。回答下列问题:

(1) 位于元素周期表中第四周期
位于元素周期表中第四周期____ 族,基态 原子核外未成对电子有
原子核外未成对电子有_____ 个。
(2) 可与
可与 反应生成
反应生成 ,新生成的化学键为
,新生成的化学键为_____ 键。 分子的空间构型为
分子的空间构型为______ ,其中N原子的杂化轨道类型为_______ 。
(3)金属锰有多种晶型,其中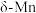 的结构为体心立方堆积,晶胞参数为a pm,
的结构为体心立方堆积,晶胞参数为a pm, 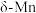 中锰的原子半径为
中锰的原子半径为_____ pm。已知阿伏加 德罗常数的值为 ,
, 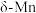 的理论密度
的理论密度
____ 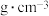 。(列出计算式)
。(列出计算式)
(4)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为____ ,其配位数为____ 。
A. 分子的极性:
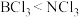 B. 物质的硬度:
B. 物质的硬度: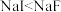
C. 物质的沸点:
 D.在
D.在 中的溶解度:
中的溶解度:
Ⅱ.锰单质及其化合物应用十分广泛。回答下列问题:

(1)
 位于元素周期表中第四周期
位于元素周期表中第四周期 原子核外未成对电子有
原子核外未成对电子有(2)
 可与
可与 反应生成
反应生成 ,新生成的化学键为
,新生成的化学键为 分子的空间构型为
分子的空间构型为(3)金属锰有多种晶型,其中
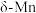 的结构为体心立方堆积,晶胞参数为a pm,
的结构为体心立方堆积,晶胞参数为a pm, 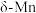 中锰的原子半径为
中锰的原子半径为 ,
, 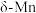 的理论密度
的理论密度
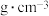 。(列出计算式)
。(列出计算式)(4)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为
您最近一年使用:0次



