氰化钠( )是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。回答下列问题:
)是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。回答下列问题:
(1)氰化钠与硫代硫酸钠的反应为 。已知:
。已知: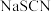 中S为-2价。则
中S为-2价。则 的电子式为
的电子式为___________
(2) 中C元素显+2价,N元素显-3价。说明非金属性
中C元素显+2价,N元素显-3价。说明非金属性 。请设计实验证明:
。请设计实验证明:___________
(3)HCN能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表所示:
①25℃时, 的HCN溶液的
的HCN溶液的 约为
约为___________ (结果保留一位小数,已知 )。
)。
②向 溶液中通入少量
溶液中通入少量 ,发生反应的离子方程式为
,发生反应的离子方程式为___________
③等体积、等物质的量浓度的 和
和 溶液中所含离子总数:
溶液中所含离子总数:
___________ (填“>”“<”或“=”) 。
。
(4)常温下,用 的
的 溶液分别滴定
溶液分别滴定 浓度均为
浓度均为 的
的 溶液和HCN溶液,所得滴定曲线如图所示。
溶液和HCN溶液,所得滴定曲线如图所示。

①常温时 的电离常数为
的电离常数为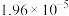 ,
, 的
的 溶液中
溶液中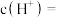
___________ 
②在a点所示的溶液中溶质为___________ (填化学式)。
③在a点和b点所示溶液中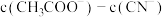
___________  。(填“>”“<”或“=”)
。(填“>”“<”或“=”)
 )是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。回答下列问题:
)是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。回答下列问题:(1)氰化钠与硫代硫酸钠的反应为
 。已知:
。已知: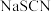 中S为-2价。则
中S为-2价。则 的电子式为
的电子式为(2)
 中C元素显+2价,N元素显-3价。说明非金属性
中C元素显+2价,N元素显-3价。说明非金属性 。请设计实验证明:
。请设计实验证明:(3)HCN能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表所示:
| 弱酸 |  | HCN |  |
| 电离平衡常数(25℃) | 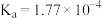 | 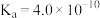 | 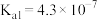 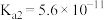 |
 的HCN溶液的
的HCN溶液的 约为
约为 )。
)。②向
 溶液中通入少量
溶液中通入少量 ,发生反应的离子方程式为
,发生反应的离子方程式为③等体积、等物质的量浓度的
 和
和 溶液中所含离子总数:
溶液中所含离子总数:
 。
。(4)常温下,用
 的
的 溶液分别滴定
溶液分别滴定 浓度均为
浓度均为 的
的 溶液和HCN溶液,所得滴定曲线如图所示。
溶液和HCN溶液,所得滴定曲线如图所示。
①常温时
 的电离常数为
的电离常数为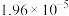 ,
, 的
的 溶液中
溶液中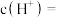

②在a点所示的溶液中溶质为
③在a点和b点所示溶液中
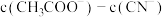
 。(填“>”“<”或“=”)
。(填“>”“<”或“=”)
更新时间:2023-11-24 09:15:39
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】(1)已知常温下,Ka(HNO2)=5×10-4,则反应HNO2(aq)+OH-(aq)⇌NO (aq)+H2O(l)的平衡常数K=
(aq)+H2O(l)的平衡常数K=______ ,相同物质的量浓度的HNO2、NaNO2混合溶液中,各离子的物质的量浓度由大到小的顺序为______ 。
(2)除了OH-之外,S2-也是一种常见的金属离子沉淀剂。本质原因是一些金属硫化物的溶解度极小。已知:25 ℃时,CuS的溶度积为4×10-36,H2S的Ka1=1.25×10-7,Ka2=8.0×10-14。若要在1 L的盐酸中完全溶解0.01 mol CuS,理论上需要盐酸的最低浓度为______ mol·L-1(提示:用离子方程式计算)。
 (aq)+H2O(l)的平衡常数K=
(aq)+H2O(l)的平衡常数K=(2)除了OH-之外,S2-也是一种常见的金属离子沉淀剂。本质原因是一些金属硫化物的溶解度极小。已知:25 ℃时,CuS的溶度积为4×10-36,H2S的Ka1=1.25×10-7,Ka2=8.0×10-14。若要在1 L的盐酸中完全溶解0.01 mol CuS,理论上需要盐酸的最低浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】海水中含有80多种元素,是重要的物质资源宝库,同时海水具有强大的自然调节能力,为解决环境污染问题提供了广阔的空间。
(1)①已知不同pH条件下,水溶液中碳元素的存在形态如图所示。

下列说法不正确 的是___________ (填字母序号)。
 时,溶液中含碳元素的微粒主要是
时,溶液中含碳元素的微粒主要是
 点,溶液中
点,溶液中 和
和 浓度相同
浓度相同
 当
当 时,
时,
②向上述 的水溶液中加入NaOH溶液时发生反应的离子方程式是
的水溶液中加入NaOH溶液时发生反应的离子方程式是_______ 。
(2)海水pH稳定在 之间,可用于烟道气中
之间,可用于烟道气中 和
和 的吸收剂。
的吸收剂。
①海水中含有的 可以吸收烟道气中的
可以吸收烟道气中的 ,同时为海水脱钙,生产
,同时为海水脱钙,生产 。写出此反应的离子方程式:
。写出此反应的离子方程式:___________ 。
②已知: 时,
时, 电离平衡常数
电离平衡常数 、
、 ,
, 电离平衡常数
电离平衡常数 、
、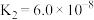 ,海水中含有的
,海水中含有的 可用于吸收
可用于吸收 ,该过程产物中有
,该过程产物中有 和
和___________ 。
(1)①已知不同pH条件下,水溶液中碳元素的存在形态如图所示。

下列说法
 时,溶液中含碳元素的微粒主要是
时,溶液中含碳元素的微粒主要是
 点,溶液中
点,溶液中 和
和 浓度相同
浓度相同 当
当 时,
时,
②向上述
 的水溶液中加入NaOH溶液时发生反应的离子方程式是
的水溶液中加入NaOH溶液时发生反应的离子方程式是(2)海水pH稳定在
 之间,可用于烟道气中
之间,可用于烟道气中 和
和 的吸收剂。
的吸收剂。①海水中含有的
 可以吸收烟道气中的
可以吸收烟道气中的 ,同时为海水脱钙,生产
,同时为海水脱钙,生产 。写出此反应的离子方程式:
。写出此反应的离子方程式:②已知:
 时,
时, 电离平衡常数
电离平衡常数 、
、 ,
, 电离平衡常数
电离平衡常数 、
、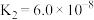 ,海水中含有的
,海水中含有的 可用于吸收
可用于吸收 ,该过程产物中有
,该过程产物中有 和
和
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】Ⅰ.已知在25℃时,次氯酸、碳酸和亚硫酸的电离平衡常数分别为:
HClO

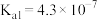
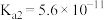

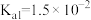
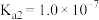
(1)相同浓度的 、
、 、
、 、
、 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为_______ 。
(2)写出 的电离方程式
的电离方程式_______ 。
(3)室温下, 通入NaOH溶液中,在所得溶液中,
通入NaOH溶液中,在所得溶液中,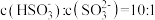 ,则溶液的pH=
,则溶液的pH=_______ 。
II.水在25℃和95℃时电离平衡曲线如图。
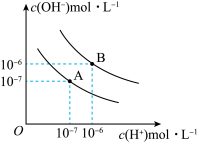
(4)在曲线A所对应的温度下,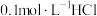 溶液由水电离出来的
溶液由水电离出来的
_______  。
。
(5)在曲线A所对应的温度下, 的下列溶液:①HCl②
的下列溶液:①HCl② ③
③ ④NaOH ⑤
④NaOH ⑤ ,pH由大到小的顺序是
,pH由大到小的顺序是_______ (填序号顺序)。
(6)在曲线A所对应的温度下, 的醋酸与
的醋酸与 的NaOH等体积混合,所得溶液的pH
的NaOH等体积混合,所得溶液的pH_______ 7(填“>”“<”或“=”)。
(7)在曲线B所对应的温度下,将 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的6,则NaOH溶液与
溶液混合,若所得混合溶液的6,则NaOH溶液与 溶液的体积比为
溶液的体积比为_______ 。
HClO


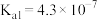
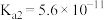

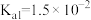
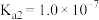
(1)相同浓度的
 、
、 、
、 、
、 结合
结合 的能力由强到弱的顺序为
的能力由强到弱的顺序为(2)写出
 的电离方程式
的电离方程式(3)室温下,
 通入NaOH溶液中,在所得溶液中,
通入NaOH溶液中,在所得溶液中,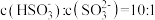 ,则溶液的pH=
,则溶液的pH=II.水在25℃和95℃时电离平衡曲线如图。

(4)在曲线A所对应的温度下,
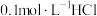 溶液由水电离出来的
溶液由水电离出来的
 。
。(5)在曲线A所对应的温度下,
 的下列溶液:①HCl②
的下列溶液:①HCl② ③
③ ④NaOH ⑤
④NaOH ⑤ ,pH由大到小的顺序是
,pH由大到小的顺序是(6)在曲线A所对应的温度下,
 的醋酸与
的醋酸与 的NaOH等体积混合,所得溶液的pH
的NaOH等体积混合,所得溶液的pH(7)在曲线B所对应的温度下,将
 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的6,则NaOH溶液与
溶液混合,若所得混合溶液的6,则NaOH溶液与 溶液的体积比为
溶液的体积比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】25℃时,某些弱酸、弱碱的电离常数如下:
请回答下列问题:
(1)常温下0.1mol·L-1的CH3COOH在水中约有1%发生电离,将该溶液加蒸馏水稀释,在稀释过程中,下列表达式的数据变大的是_______。
(2)物质的量浓度均为0.1mol·L-1的八种溶液:①Na2CO3②NaClO③CH3COONa④NaHCO3⑤NH4NO3⑥(NH4)2SO4⑦NH4HSO4⑧CH3COONH4,这些溶液的pH由大到小的顺序是_______ (填编号,下同);上述⑤⑥⑦⑧四种溶液中c( )由大到小的顺序是
)由大到小的顺序是_______ 。
(3)实验室中配制FeSO4溶液时常加入_______ ;NaHCO3溶液显碱性的原因:_______ ;用离子方程式表示泡沫灭火器灭火原理_______ 。
(4)常温下0.1mol·L-1的(NH4)2CO3溶液呈_______ 性(填“酸”、“中”、“碱”)。
(5)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c( )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=_______ 。
| 化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O |
| 电离平衡常数K | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | 1.8×10-5 |
请回答下列问题:
(1)常温下0.1mol·L-1的CH3COOH在水中约有1%发生电离,将该溶液加蒸馏水稀释,在稀释过程中,下列表达式的数据变大的是_______。
| A.c(H+) | B.c(CH3COOH)/c(H+) | C.c(H+)·c(OH-) | D.c(OH-)/c(H+) |
 )由大到小的顺序是
)由大到小的顺序是(3)实验室中配制FeSO4溶液时常加入
(4)常温下0.1mol·L-1的(NH4)2CO3溶液呈
(5)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(
 )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】已知:某酸HX、 和
和 都是弱电解质,回答下列问题:
都是弱电解质,回答下列问题:
(1)甲、乙两位同学设计用实验确定某酸HX是弱电解质,存在电离平衡。
甲:取纯度相同,质量、大小相等的锌粒放入两支试管中,同时加入 的HX、
的HX、 溶液各
溶液各 ,按如图1装好,观察现象。
,按如图1装好,观察现象。

乙:用pH计测定物质的量浓度均为 的HX和
的HX和 溶液的pH。
溶液的pH。
①甲方案中,说明HX是弱电解质的实验现象是___________ ;乙方案中说明HX是弱电解质的理由是:测得 的HX溶液的pH
的HX溶液的pH___________ 1(填“>”、“<”或“=”)。
②甲同学为了进一步探究弱电解质电离平衡移动的情况,设计如下实验:
使HX的电离程度和 都减小,
都减小,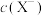 增大,可在
增大,可在 的HX溶液中,选择加入
的HX溶液中,选择加入___________ 试剂(填序号)。
A. 溶液 B.
溶液 B.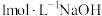 溶液 C.升温
溶液 C.升温
D.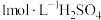 溶液 E.
溶液 E. 固体(可完全溶于水) F.加水稀释
固体(可完全溶于水) F.加水稀释
③乙同学比较了 与HX两种弱酸电离平衡常数:已知室温时,
与HX两种弱酸电离平衡常数:已知室温时,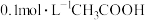 溶液的电离度约为1%,
溶液的电离度约为1%, 的电离平衡常数
的电离平衡常数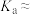
___________ ;室温下,体积均为 、pH均为2的
、pH均为2的 与HX,加水稀释过程中pH与溶液体积的关系如图2所示,则HX的电离平衡常数
与HX,加水稀释过程中pH与溶液体积的关系如图2所示,则HX的电离平衡常数___________ (填“大于”、“小于”或“等于”) 的电离平衡常数。
的电离平衡常数。

(2)某温度时,纯水的电离平衡曲线如图3所示:

①此温度___________ (填“高于”、“低于”或“等于”)25℃。该温度下,浓度为 的
的 溶液中由水电离的
溶液中由水电离的
___________  。
。
②保持温度不变,将 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合后溶液
混合后溶液 (忽略混合时溶液体积变化),则
(忽略混合时溶液体积变化),则
___________ 。
 和
和 都是弱电解质,回答下列问题:
都是弱电解质,回答下列问题:(1)甲、乙两位同学设计用实验确定某酸HX是弱电解质,存在电离平衡。
甲:取纯度相同,质量、大小相等的锌粒放入两支试管中,同时加入
 的HX、
的HX、 溶液各
溶液各 ,按如图1装好,观察现象。
,按如图1装好,观察现象。
乙:用pH计测定物质的量浓度均为
 的HX和
的HX和 溶液的pH。
溶液的pH。①甲方案中,说明HX是弱电解质的实验现象是
 的HX溶液的pH
的HX溶液的pH②甲同学为了进一步探究弱电解质电离平衡移动的情况,设计如下实验:
使HX的电离程度和
 都减小,
都减小,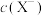 增大,可在
增大,可在 的HX溶液中,选择加入
的HX溶液中,选择加入A.
 溶液 B.
溶液 B.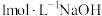 溶液 C.升温
溶液 C.升温D.
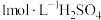 溶液 E.
溶液 E. 固体(可完全溶于水) F.加水稀释
固体(可完全溶于水) F.加水稀释③乙同学比较了
 与HX两种弱酸电离平衡常数:已知室温时,
与HX两种弱酸电离平衡常数:已知室温时,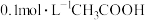 溶液的电离度约为1%,
溶液的电离度约为1%, 的电离平衡常数
的电离平衡常数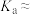
 、pH均为2的
、pH均为2的 与HX,加水稀释过程中pH与溶液体积的关系如图2所示,则HX的电离平衡常数
与HX,加水稀释过程中pH与溶液体积的关系如图2所示,则HX的电离平衡常数 的电离平衡常数。
的电离平衡常数。
(2)某温度时,纯水的电离平衡曲线如图3所示:

①此温度
 的
的 溶液中由水电离的
溶液中由水电离的
 。
。②保持温度不变,将
 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合后溶液
混合后溶液 (忽略混合时溶液体积变化),则
(忽略混合时溶液体积变化),则
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】下列物质①NaHSO4、②H2O、③NaOH、④BaSO4、⑤NH3、⑥CO2、⑦CH3COOH、⑧CH3OH、⑨Fe、⑩氯化钠溶液
(1)属于非电解质的是______ ;属于强电解质的是______ ;既不是电解质也不是非电解质,且常温下能导电的物质是______ (均填序号)。
(2)已知碳酸、亚硫酸、次氯酸的电离平衡常数如下表。
①写出H2SO3的第二步电离方程式______ 。
②试比较 、
、 和HCIO的酸性强弱:
和HCIO的酸性强弱:______ 。
③写出少量CO2与NaClO反应的离子方程式______ 。
(1)属于非电解质的是
(2)已知碳酸、亚硫酸、次氯酸的电离平衡常数如下表。
| 物质 | H2CO3 | H2SO3 | HClO | |
| 电离平衡常数 | Ka1 | 4.40×10-7 | 1.54×10-2 | 2.95×10-8 |
| Ka2 | 5.61×10-11 | 1.02×10-7 | ||
②试比较
 、
、 和HCIO的酸性强弱:
和HCIO的酸性强弱:③写出少量CO2与NaClO反应的离子方程式
您最近一年使用:0次



